Wie man Basalmembran Stiffness als biophysikalische Auslöser in Prostatakrebs und andere altersbedingte Pathologien oder Stoffwechselkrankheiten Studie
Summary
Hier erklären wir ein Protokoll für die Modellierung der biophysikalischen Mikroumgebung, wo die Vernetzung und eine erhöhte Steifigkeit der Basalmembran (BM), induziert durch Advanced Glycation Endprodukten (AGEs) pathologische Relevanz hat.
Abstract
Hier beschreiben wir ein Protokoll , das verwendet werden kann , die biophysikalischen Mikroumgebung zu studieren im Zusammenhang mit erhöhter Dicke und Steifigkeit der Basalmembran (BM) während der altersbedingten Erkrankungen und Stoffwechselstörungen (wie Krebs, Diabetes, der mikrovaskulären Krankheit, Retinopathie, Nephropathie und Neuropathie) . Die Prämisse des Modells ist nicht enzymatische Vernetzung von rekonstituierten BM (RBM) -Matrix durch Behandlung mit Glykolaldehyd (GLA) Advanced Glycation-Endprodukt (AGE) Erzeugung über die Maillard-Reaktion zu fördern. Beispiele von Labortechniken, die verwendet werden können, um AGE Erzeugung nichtenzymatische Vernetzungs- und erhöhte Steifigkeit in GLA behandelten rBM skizziert bestätigen. Dazu gehören Herstellung von nativem rBM (behandelt mit Phosphat-gepufferter Kochsalzlösung, PBS) und steif rBM (behandelt mit GLA) zur Bestimmung von: sein AGE-Gehalt mittels photometrischer Analyse und Immunfluoreszenz-Mikroskopie, seine nicht-enzymatische Vernetzung durch Natriumdodecylsulfat-PolyacrylamidGelelektrophorese (SDS-PAGE) sowie konfokale Mikroskopie und ihre erhöhte Steifigkeit mit rheometry. Das hier beschriebene Verfahren kann die Steifigkeit (Elastizitätsmodul, E) von rBM bis zu 3,2-fache, im Einklang mit Messungen in gesunden gegenüber erkrankten menschlichen Prostatagewebe zu erhöhen, verwendet werden. Um die biophysikalischen Mikro neu mit der Alterung und erkrankten Prostata Drüse drei Prostata-Zelltypen wurden auf nativen rBM eingeführt und steif rBM: RWPE-1, Prostata-Epithelzellen (PEC), die von einer normalen Prostata; BPH-1, Pecs von einer Prostata durch gutartige Prostata-Hyperplasie (BPH) betroffen abgeleitet; und PC3, metastatischen Zellen aus einem sekundären Knochentumor abgeleitet von Prostatakrebs stammt. Mehrere Parameter können gemessen werden, einschließlich der Größe, Form und invasive Eigenschaften des 3D-Drüsenacini von RWPE-1 gebildet und BPH-1 auf nativen im Vergleich zu steifen rBM und mittlere Zelllänge, Migrationsgeschwindigkeit und die Persistenz der Zellbewegung von 3D spheroids von PC3-Zellen unter den gleichen Bedingungen gebildet. Zell-Signalwege und die subzelluläre Lokalisierung von Proteinen kann auch beurteilt werden.
Introduction
The basement membrane (BM) is a sheet of specialized extracellular matrix (ECM) that maintains stable tissue borders by separating layers of epithelial cells from the stroma1. Covalent crosslinking between adjacent triple helices of collagen IV in the BM stabilizes their lateral association by establishing an irregular network of super-twisted helices2. These collagen IV lattices act as a scaffold for its interaction with laminin and other BM components1. The structural arrangement of the BM provides it with the mechanical strength and rigidity necessary for the normal development of glandular epithelia3.
During aging and disease the BM progressively thickens and stiffens3,4. For example, a 3-fold increase in the elastic modulus (E) of the ocular BM occurs between the ages of 50 and 80 in the normal population, and this stiffening is further exacerbated in metabolic disorders like diabetes5. The structural and biomechanical changes in the BM that result in its increased stiffness occur when its ECM components, collagen IV and laminin, become non-enzymatically crosslinked following their exposure to advanced glycation endproducts (AGEs).
The purpose of the method described here was to establish a model for the investigation of how BM stiffness, due to AGE exposure, promotes prostate epithelial cell (PEC) and prostate tumour cell (PTC) invasiveness in the context of the switch to metastatic prostate cancer (PCa). To do this a previous method used for generating 3D glandular acini from mammary epithelial cells (MECs) in reconstituted rBM gels6 was adapted to include an additional step where the rBM gels are pre-treated with glycolaldehyde (GLA). Several techniques for assessing GLA induced crosslinking and stiffening of pre-treated rBM gels are described, including photometric analysis, sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS PAGE), confocal microscopy and rheometric analysis. The prostate cell types selected for culture on the pre-stiffened rBM include: RWPE-1, PECs derived from a normal prostate gland7; BPH-1, PECs derived from a prostate gland affected by BPH8; and PC3, metastatic PTCs derived from a secondary tumor located in the vertebral bone of a prostate cancer (PCa) patient9.
In addition to advancing the study of prostate gland pathology, the protocol for stiffening of rBM gels by their treatment with GLA can be adapted to investigate how BM stiffness contributes to other age-related pathologies and metabolic disorders. For example, the model can be directly applied to investigate how metastatic cancer is induced by BM stiffness in organs such as the breast, colon, ovary and pancreas by the incorporation of appropriate cell types. Furthermore, the protocol can be adapted to investigate how stiff BM promotes biomechanical mechanisms of disease progression in diabetes-related microvascular disease, retinopathy, nephropathy and neuropathy.
Protocol
Representative Results
Discussion
Ein Protokoll für die Erzeugung von 3D – Drüsenacini von MEC in reinen rBM Gele 6 wurde in einer früheren Studie durch die Zugabe von 4 mg / ml Typ I auf der RBM Matrix – Kollagen modifiziert. Die Zugabe von Kollagen resultiert in dem Elastizitätsmodul des Gels rBM Erhöhung von 175 ± 37 bis 1589 ± 380 Pascal. Diese 9,1-fache Erhöhung der Steifigkeit moduliert das Wachstum, Überleben, Migration und Differenzierung von MEC 21. Das Protokoll wurde erneut modifiziert, indem ein Behandlungsschritt mit D einschließlich – (-) – Ribose nichtenzymatische Vernetzung des Typ-I-Kollagen zu fördern, die dem rBM Gel zugesetzt worden war. Die resultierende 15-fachen Anstieg wurde in der Steifigkeit gefunden mit onkogene Transformation von MEC zusammenzuarbeiten , um deren invasive Verhalten 22 zu fördern. Die experimentelle Vorgehensweise der Zugabe von Typ I-Kollagen-Gelen rBM erleichtert die direkte Wechselwirkung von MEC mit Kollagenfasern, die in menschlichem Gewebe erfolgt erst nach der physischen Barriere zwischen dem Stromaund vom BM bereitgestellt Epithel erfährt proteolytischen Abbau. Durch die Erzeugung von 3D – Drüsenacini von PEC in reinen rBM Gelen vorbehandelt mit GLA, öffnet sich das aktuelle Protokoll , um die Art und Weise zu untersuchen , wie BM Steifigkeit per se können ihre invasive Verhalten auslösen (Abbildung 3). Die Niveaus der Steifigkeit BM in diesem Protokoll physiologische Relevanz induziert. Inkubation mit 50 mM GLA 6 h und 14 h erhöht jeweils die Elastizitätsmoduln des reinen rBM Gel auf 175 ± 90 und 322 ± 160 gegenüber 122 ± 55 Pascal in rBM Gelen behandelt mit PBS (Tabelle 1). Diese 1,7-3,2-fache Erhöhung der Steifigkeit rBM rekapituliert die 2,5- bis 3,4-fache Erhöhung der Steifigkeit in malignen beobachtet im Vergleich zu normalen Prostata oder BPH Gewebe 23-26. Wie kürzlich in einer Veröffentlichung 13 die morphologischen Veränderungen durch die Ansammlung von AGE und rBM Steifigkeit in PEC Acini quantifiziert von ar für eine statistisch signifikante Verschiebung werden kann induziert umrissenenounded zu polygonale Form, verringert luminale / total acinar Bereich und vorspringende Zellen aus dem acina in die AGE-reiche rBM (Abbildung 3) zu migrieren. Immunoblotting können auch Marker für EMT zu bewerten verwendet werden (zB Verlust von E-Cadherin 13) und die Kontraktionsverhalten (zB phosphoryliert Myosin Light Chain-2, pMLC2 13) in Pecs in normalen gewachsen im Vergleich zu steifen rBM (Abbildung 3). Frühen endosomalen Antigen 1 und GM130: Eine weitere Bewertung unter Verwendung von Immunfluoreszenzanfärbung und konfokale Mikroskopie kann die BM (zB Laminin, Kollagen IV und AGE Anhäufung 13), zelluläre apikal-to-basale Polarität (zB apikale Lokalisation von EEA1 zu visualisieren angewendet werden 130 kDa cis-Golgi Marker 13) und zelluläre Muster der Adhäsionsmoleküle (zB E-Cadherin – Lokalisierung zu Zell-Zell – Junctions 13) (Abbildung 3).
<img alt = "3" src = "/ files / ftp_upload / 54230 / 54230fig3.jpg" />
Abbildung 3:. Überblick über die verschiedenen Protokolle hier vorgestellten Das Diagramm zeigt , wie die Vorbereitung und versteifen die rekonstituierte Basalmembran (RBM) mit Glykolaldehyd (Maillard – Reaktion), wie Zellen auf Saatgut auf dem steifen rBM, wie das steife rBM zu analysieren ( Ausmaß der Maillard-Reaktion) und Verfahren, die die zellulären und molekularen Veränderungen verwendet werden können, durch AGE-reiche rBM induziert zu analysieren. AGE, Advanced Glycation Endprodukten; BM, Basalmembran; DAPI, 4 ', 6-Diamidino-2-Phenylindol; EEA1, frühe Endosomen Antigen 1; GAPDH, Glyceraldehyd-3-phosphat-Dehydrogenase; GLA, Glykolaldehyd; GEE, glycinethylester; GM130, 130 kDa cis-Golgi-Marker; p-MLC2 (Thr18 / Ser19), Myosin Light Chain-2 an den Stellen phosphoryliert Threonin 18 und Serin 19; rBM, rekonstituierte Basalmembran; SDS-PAGE, Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese. Für RWPE1 acini Maßstabsbalken = 10 & mgr; m; für PC3 TumorzelleSphäroiden Maßstabsbalken = 100 & mgr; m. Diese Zahl hat sich von der Referenz 13 geändert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Schritte zur Fehlerbehebung wird notwendig sein, wenn D – (-) – Ribose als Vernetzungsmittel für rBM gewählt wird. Während die Protokollentwicklung wurde festgestellt , dass die Behandlung mit 1 M D – (-) – Ribose für 72 Stunden, wie zuvor für RBM / Kollagengelen 22 beschrieben, ergab die Dehydratisierung und Schrumpfung von rBM Gelen. Die Auswertung von geringeren Konzentrationen von D – (-) – Ribose und kürzere Behandlungszeiten können dazu beitragen, diese Einschränkung zu überwinden.
Eine mögliche Einschränkung in zukünftigen Anwendungen des Protokolls könnte begegnet werden, bei denen eine höhere rBM Steifigkeit erwünscht sind. Wenn längere Inkubationszeiten und höheren Konzentrationen von GLA induzieren werden verwendet, um höhere rBM Gelsteifheit wird es notwendig sein, beurteilen , ob diese Behandlungsbedingungen einen Einfluss auf das Überleben der Zellen und die Proliferation, wie dies bisher 13 beschrieben. Es sollte auch beachtet werden, dass Inkubation von RWPE-1-Zellen mit Serum eine phänotypische EMT artigen Übergang und Exposition gegenüber Serum oder serumhaltigen Materialien sollten vermieden werden induziert. Wenn beispielsweise die Transfektion von Experimenten short interfering RNA (siRNA) Oligonukleotiden beinhalten, sollte das Verfahren RWPE-1-Zellen in KSFM optimiert werden unter Verwendung gewachsen, ohne die Zellen zu niedrigen Serum Transfektionsmedium Schalt. Dieser Nachteil könnte das Niveau des Gens beeinträchtigen erreicht Silencing bei der Verwendung von transienten siRNA im Modellansätze. Für einige Protein-Targets wäre es ratsam, werden induzierbaren shRNA Vektoren für abstimmbare Gen-Silencing und die gewünschte Verringerung der Protein-Ebene einzusetzen. Adaptionen , die 17 enzymatische Vernetzung durch Stromazellen oder Tumorzelle assoziiert Lysyloxidase (LOX) übernehmen könnte auch in Zukunft Modelle eingebaut werden.
jove_content "> Dieses Protokoll wird die künftige Untersuchung von Pro-invasive Mechanismen ausgelöst durch altersabhängige BM Steifigkeit in Pecs (RWPE-1, BPH-1) und Bewertung von anti-metastatischen Ziele in invasive PTCs (PC3) erleichtern. Da BPH wird als eine Stoffwechselstörung , 27, dieses Protokoll zu sein ebnet auch den Weg zu unserem verbesserten Verständnis des Zusammenhangs zwischen Stoffwechselstörungen und einem erhöhten Risiko von Prostatakrebs. Da durch die Einwirkung von AGEs induzierte BM Steifigkeit in anderen Krebs ein Auslöser für Invasivität sein kann Arten, wird es interessant sein , um das Protokoll zu verwenden , ähnliche Modelle zu schaffen , die normalen Epithelzellen und Tumorzellen von anderen Organen (zB Brust-, Dickdarm-, Ovarien, Pankreas) integrieren.Kritische Schritte innerhalb des Protokolls zusammen mit ihren Zeitpunkten, sind in 4 zusammengefasst. In der ersten Stufe ist es wichtig , die Stammlösung von rBM bei 4 ° C zu halten , während es auftaut seine pol zu verhindernymerization. Pipettenspitzen sollten nicht in die rM Stammlösung gelegt werden, bis sie auf 4 ° C gekühlt wurden. Für den nächsten Schritt ist es auch wichtig, die chamber slides äquilibriert auf 4 ° C haben, um sicherzustellen, bevor sie mit der rBM Lösung beschichtet sind. Sobald die Temperatur der Lösung rBM über 4 ° C erhöht wird, wird es irreversible polymerisieren unter Bildung eines Gels. Es ist wichtig, dass die rBM nicht während der Polymerisationsstufe gestört, um sicherzustellen, dass es sich um eine selbst bildet für die Zellkultur und mikroskopische Analyse geeignete Oberfläche. Die Dauer der Inkubation mit GLA mit oder ohne Inhibitoren der Maillard-Reaktion (Natriumcyanoborhydrid und amingoguanidine) wird bestimmen, wie steif RBM Gel wird. Es wird empfohlen , einen 6 – stündigen Inkubation mit GLA zu verwenden , wenn halbsteifen Bedingungen erforderlich sind, und 14 Stunden Inkubation , wenn steife Bedingungen erforderlich sind (Tabelle 1). Alternative Inkubationszeiten oder Konzentrationen von GLA können, wenn verschiedene Ebenen verwendet werdenSteifigkeit erwünscht. In diesem Fall rheologische Analyse der rBM Gelen benötigen als einen wesentlichen Schritt eingebaut werden. Nach dem Schritt der Maillard-Reaktion durch Inkubation mit GEE und die nachfolgenden Waschschritte mit PBS Abschrecken können die rBM Gele bei 4 ° C gelagert oder sofort verwendet werden, für bis zu 48 Stunden vor ihrer Verwendung für die Zellkultur. Sobald Zellkulturen eingerichtet sind ist es wichtig, die Kulturmedium zu ändern (einschließlich aller Behandlungen) alle zwei Tage. Es wird empfohlen, die 3D-Zellkulturen für 3-12 Tage zu halten nach den Parametern untersucht. Für die 3D-PEC acini empfiehlt es sich, die Kulturen nach 6 Tagen zu analysieren und für die 3D-PTC-Analyse Sphäroide nach 3 Tagen der Kultur in erster Linie empfohlen.
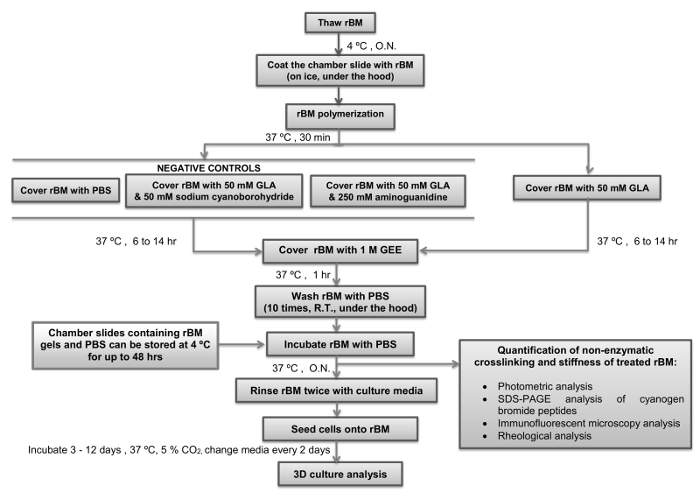
Abbildung 4:. Einfache Übersicht des Protokolls mit kritischen Schritte und Timings zeigte die flow Diagramm zeigt, wie die Vorbereitung und die rekonstituierte Basalmembran (RBM) mit Glykolaldehyd (Maillard-Reaktion) mit kritischen Schritte und Zeiten angegeben versteifen. Punkte, wo das Protokoll kann angehalten werden, und Gele rBM gespeichert sind ebenfalls angegeben. rBM, rekonstituierte Basalmembran; GLA, Glykolaldehyd; GEE, glycinethylester; ON, über Nacht; PBS, Phosphat-gepufferte Salzlösung; RT, Raumtemperatur. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Simon Hayward (Vanderbilt University Medical Center) for the BPH-1 cells; and Thomas Cox and Janine Erler (Biotech Research & Innovation Centre, University of Copenhagen) for their assistance with rheological measurements. MR-T was funded by Worldwide Cancer Research, formerly The Association of International Cancer Research (Grant 08-0803 to JS), The British Embassy Montevideo and Agencia Nacional de Investigacion e Innovacion (UK_RH_2015_1_2 to MR-T). MC was supported by Prostate Cancer UK (Grant S14-017 to JS and GS). KW was funded by The China Scholarship Council. MAM was funded by The Saudi Arabian Cultural Bureau.
Materials
| I – Material for monolayer culture | |||
| BPH-1 | CaP Cell Line Database | PCaCL-132 | Contact: simon.hayward@mcmail.vanderbilt.edu |
| Complete keratinocyte serum-free media | ThermoFisher Scientific | 17005-075 | Do not warm at 37 ºC before use |
| Fetal calf serum | First Link UK Ltd | 02-00-850 | Store at -20 ºC in aliquots |
| PC3 | American Type Culture Collection | CRL-1435 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15070-063 | |
| Phosphate Buffer Saline (Dulbecco A) tablets | Oxoid | BR0014G | |
| RPMI 1640 medium | Sigma-Aldrich | R5886 | warm in 37 ºC water bath before use |
| RWPE-1 | American Type Culture Collection | CRL-11609 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Name | Company | Catalog Number | Comments |
| II – Material for 3D culture | |||
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Aminoguanidine hydrochloride | Sigma-Aldrich | 396494 | Irritating to eyes, respiratory system and skin |
| Chamber slides, 8-well | Thermo Scientific Nunc Lab-Tek | TKT-210-816M | |
| Culture Matrix reconstituted basement membrane (rBM) reduced growth factor extract | AMS Biotechnology | 3445-005-01 | Store Basement membrane (BM) at -80 ºC in aliquots |
| Cyanogen bromide | Sigma-Aldrich | C91492 | Toxic by contact skin and inhalation |
| Formic acid | Sigma-Aldrich | 695076 | |
| Glycine ethyl ester hydrochloride (GEE) | Sigma-Aldrich | 50060 | Irritating to eyes |
| Glycolaldehyde dimer (GLA) | Sigma-Aldrich | G6805 | |
| Sodium cyanoborohydride | Sigma-Aldrich | 71435 | Highly flammable; Toxic by contact skin and inhalation |
| Syringe filter 0.22 microns | Appleton Woods | BC680 | |
| Name | Company | Catalog Number | Comments |
| III – Material to quantify Maillard reaction | |||
| 4’,6-diamidino-2-phenylindole (DAPI) | ThemoFisher Scientific | D3571 | light sensitive and store at -20 ºC in aliquots |
| Cloning cylinders | Sigma-Aldrich | C1059 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11001 | light sensitive |
| Goat anti-rabbit IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11034 | light sensitive |
| Goat serum | Abcam | ab7481 | Store at -20 ºC in aliquots |
| Vectashield mounting media | Vector Laboratories | H-1000 | |
| Mouse anti-pentosidine clone PEN-12 mAb | TransGenic Inc | KH012 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | F8775 | Store at -20 ºC in aliquots |
| Rabbit anti-human collagen IV polyclonal antibody | Acris Antibodies | R1041 | Store at -20 ºC in aliquots |
| Rabbit anti-laminin A/C pAb | Santa Cruz Biotechnology Inc | sc-7292 | Store at -20 ºC in aliquots |
| Polyethylene glycol tert-octylphenyl ether (Triton-X100) | Sigma-Aldrich | T9284 | |
| Polyethylene glycol sorbitan monolaurate (Tween-20) | Sigma-Aldrich | P1379 | |
| Dialysis cassette Slide-A-Lyzer | ThemoFisher Scientific | 66333 | |
| Name | Company | Catalog Number | Comments |
| IV – Equipment | |||
| ARG2 controlled strain rotational rheometer | T.A. Instruments | ||
| Axiovert S100 (20x magnification) microscope | Zeiss | ||
| CO2 controlled humidified incubation chamber for Zeiss Axio S100 microscope | Solent Scientific | ||
| Confocal Axiovert 200M (40x, 63x magnification) microscope | Zeiss | ||
| Olympus LH50A microscope fitted with a digital camera using phase-contrast | Olympus | ||
| PHERAstar Plus plate reader spectrophotometer | BMG Labtech | ||
| Name | Company | Catalog Number | Comments |
| V – Software | |||
| Image J 1.47v | National Institute of Health, USA | ||
| MetaXpress | Molecular Divices |
References
- Timpl, R., Brown, J. C. Supramolecular assembly of basement membranes. Bioessays. 18 (2), 123-132 (1996).
- Yurchenco, P. D., Ruben, G. C. Type IV collagen lateral associations in the EHS tumor matrix. Comparison with amniotic and in vitro networks. Am J Pathol. 132 (2), 278-291 (1988).
- Halfter, W., et al. Protein composition and biomechanical properties of in vivo-derived basement membranes. Cell Adh Migr. 7 (1), 64-71 (2013).
- Candiello, J., Cole, G. J., Halfter, W. Age-dependent changes in the structure, composition and biophysical properties of a human basement membrane. Matrix Biol. 29 (5), 402-410 (2010).
- To, M., et al. Diabetes-induced morphological, biomechanical, and compositional changes in ocular basement membranes. Exp Eye Res. 116, 298-307 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Bello, D., Webber, M. M., Kleinman, H. K., Wartinger, D. D., Rhim, J. S. Androgen responsive adult human prostatic epithelial cell lines immortalized by human papillomavirus 18. Carcinogenesis. 18 (6), 1215-1223 (1997).
- Hayward, S. W., et al. Establishment and characterization of an immortalized but non-transformed human prostate epithelial cell line: BPH-1. In Vitro Cell Dev Biol Anim. 31 (1), 14-24 (1995).
- Kaighn, M. E., Narayan, K. S., Ohnuki, Y., Lechner, J. F., Jones, L. W. Establishment and characterization of a human prostatic carcinoma cell line (PC-3). Invest Urol. 17 (1), 16-23 (1979).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76 (9), 4350-4354 (1979).
- Rabilloud, T. Mechanisms of protein silver staining in polyacrylamide gels: a 10-year synthesis. Electrophoresis. 11 (10), 785-794 (1990).
- Rodriguez-Teja, M., et al. AGE-modified basement membrane cooperates with Endo180 to promote epithelial cell invasiveness and decrease prostate cancer survival. J Pathol. 235 (4), 581-592 (2015).
- Graf, B. W., Boppart, S. A. Imaging and analysis of three-dimensional cell culture models. Methods Mol Biol. 591, 211-227 (2010).
- Yao, N. Y., Larsen, R. J., Weitz, D. A. Probing nonlinear rheology with inertio-elastic oscillations. J Rheology. 52 (4), 1013-1025 (2008).
- Baker, A. M., Bird, D., Lang, G., Cox, T. R., Erler, J. T. Lysyl oxidase enzymatic function increases stiffness to drive colorectal cancer progression through FAK. Oncogene. 32 (14), 1863-1868 (2013).
- Caley, M. P., et al. Tumor-associated Endo180 requires stromal-derived LOX to promote metastatic prostate cancer cell migration on human ECM surfaces. Clin Exp Metastasis. 3 (2), 151-165 (2016).
- Sturge, J., Wienke, D., East, L., Jones, G. E., Isacke, C. M. GPI-anchored uPAR requires Endo180 for rapid directional sensing during chemotaxis. J Cell Biol. 162 (5), 789-794 (2003).
- Sturge, J., Wienke, D., Isacke, C. M. Endosomes generate localized Rho-ROCK-MLC2-based contractile signals via Endo180 to promote adhesion disassembly. J Cell Biol. 175 (2), 337-347 (2006).
- Rodriguez-Teja, M., et al. Survival Outcome and EMT Suppression Mediated by a Lectin Domain Interaction of Endo180 and CD147. Mol Cancer Res. 13 (3), 538-547 (2015).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139 (5), 891-906 (2009).
- Carson, W. C., et al. Material characterization of ex vivo prostate tissue via spherical indentation in the clinic. Med Eng Phys. 33 (3), 302-309 (2011).
- Hoyt, K., et al. Tissue elasticity properties as biomarkers for prostate cancer. Cancer Biomark. 4 (4-5), 213-225 (2008).
- Krouskop, T. A., Wheeler, T. M., Kallel, F., Garra, B. S., Hall, T. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging. 20 (4), 260-274 (1998).
- Zhang, M., et al. Quantitative characterization of viscoelastic properties of human prostate correlated with histology. Ultrasound Med Biol. 34 (7), 1033-1042 (2008).
- Corona, G., et al. Benign prostatic hyperplasia: a new metabolic disease of the aging male and its correlation with sexual dysfunctions. Int J Endocrinol. , (2014).

