Протокол для HER2 рыбы с использованием не кросс ссылок, бесплатно формалин ткань фиксатором объединить преимущества крио сохранение и формалином фиксации
Summary
В сочетании с гистопатология и молекулярной диагностики для отбора терапии в персонализированной медицины часто требуется флуоресцентной гибридизации in situ (рыба). Роман не кросс ссылок, бесплатно формалин ткань фиксатором, который позволяет высокого качества морфологической, молекулярной и рыбы анализов от же образца путем добавления после фиксации шаг перед рыба представлено.
Abstract
Морфологическая оценка образцов, формалин исправлена, парафин врезанных тканей (FFPE) был золотым стандартом для диагностики рака на протяжении десятилетий из-за его отличное сохранение морфологии. Персонализированной медицины чаще предоставляет индивидуально адаптированы и целевой терапии характеризуется отдельных заболеваний, активизируемые комбинированных молекулярных и морфологических аналитических технологий и диагностики. Производительность молекулярных и морфологических анализов из же образца FFPE сложной из-за негативного воздействия формалином из-за химической модификации и структурообразования нуклеиновых кислот и белков. Не кросс ссылок, бесплатно формалин ткань фиксатором недавно была разработана выполнять оба требования, то есть, чтобы сохранить морфология как FFPE и биомолекул как крио сохранение. Так как рыба часто требуется в сочетании с гистопатология и молекулярной диагностики, мы протестировали применимость рыбы протоколов на ткани, относились с этой новой фиксатором. Мы нашли что формалин после фиксации Гистологические срезы не кросс-ссылок, формалин свободных и парафин врезанных (NCFPE) молочной железы рак ткани создаются эквивалентные результаты для тех, кто с FFPE ткани в рецептор человека эпидермального фактора роста 2 (HER2) Анализ рыбы. Этот протокол описывает, как рыбы пробирного первоначально разработан и апробирован для ткани FFPE может использоваться для NCFPE тканей простой шаг после фиксации Гистологические срезы.
Introduction
Персонализированной медицины во все большей степени полагается на испытания Многопараметрический анализ молекулярных и морфологических ткани. Формалин фиксации тканей как золотой стандарт обеспечивает отличные качества морфологической1,2. Однако формалин индуцированной химическая модификация и cross-linking белков и нуклеиновых кислот3,,45 отрицательно вмешивается молекулярный анализ6. Эти молекулярные изменения ограничивают качество нуклеиновых кислот и белков и может привести к генной последовательности артефакты7 или пониженную чувствительность полимеразной цепной реакции (ПЦР)-на основе анализов8. Хотя основные усилия были приняты для оптимизации молекулярные тесты для FFPE ткани, крио сохранение тканей находится в общих превосходит формалин фиксации, что делает необходимым разделить образцы тканей для сохранения различных процедур. Чтобы избежать необходимости крио сохранения для молекулярного анализа, не кросс ссылок, фиксирующие формалин бесплатно, PAXgene ткани был разработан. Это коммерчески доступных система состоит из фиксации и стабилизации раствор, содержащий различные спирты, уксусная кислота и растворимых органических соединений. Надлежащее сохранение нуклеиновых кислот, белков (phospo) и морфология был показан в нескольких исследованиях6,9,10,11,12,13.
Одного конкретного приложения в диагностике рака является рыба, обнаруживать широкий спектр хромосомные изменения, например транслокации, субмикроскопических удалений и амплификаций 14. Например, 20% опухолей инвазивным молочной железы рак Показать амплификации рецептора человека эпидермального фактора роста 2 (HER2) ген15,16,17, который связан с плохой прогноз18 ,19. Определение статуса HER2 гиперэкспрессия и усиления рака молочной железы рыб необходимо выбрать пациентов для анти HER2-направленных терапии и является спутником диагностических перечисленных федеральных наркотиков ассоциации (FDA) (http://www.fda.gov/ MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.htm)17. Для того, чтобы разрешить широкое применение диагностики на основе рыбы компаньон в сфере здравоохранения, анализов были разработаны и утверждены для FFPE тканей.
В предыдущем исследовании мы показали, что NCFPE тканей не может использоваться для рыбы анализов, которые были утверждены для FFPE ткани. Однако испытания времени, серия процедур фиксации различных пост NCFPE тканей с буферизацией 4% формальдегида, показали, что после фиксации раз в 18 ч или более разделов ткани NCFPE эквивалентные результаты для тех, кто с FFPE тканей14.
В этом исследовании мы предоставляем подробный протокол и продемонстрировать, что влияние не кросс ссылок, бесплатно формалин ткань фиксации и 24 h 4% буфер после фиксации формальдегида на секции для HER2 рыбы и РНК качества от же образца основной ткани.
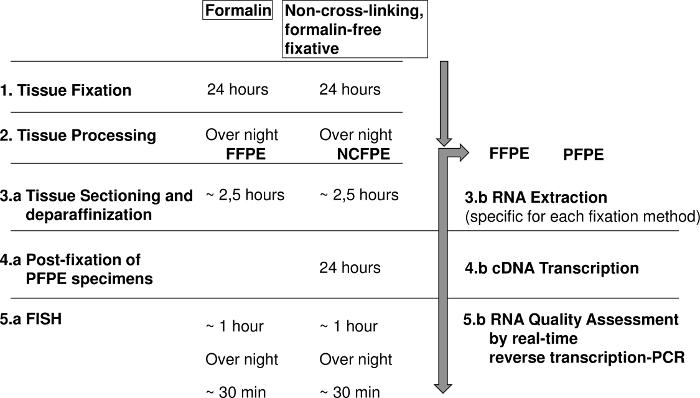
Рис 1: диаграмма, показывающая шаги для флуоресценции в situ гибридизация (рыба) и РНК анализа формалин фиксированной парафин встроенных (FFPE) и не кросс ссылок, формалин бесплатно фиксированной парафин врезанных тканей (NCFPE). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
Результаты демонстрируют два ключевых выводов. Во-первых простой 24 h SBFS шаг после фиксации секций, вырезанные из NCFPE тканей достаточно получить эквивалентные результаты для тех, кто FFPE в рыбы анализа с использованием рыбы анализов, утвержденных для ткани FFPE (см. также ссылка14). Этот протокол имеет преимущество использования рыбы анализов первоначально разработана и утверждена для FFPE без необходимости в повторной проверке всеобъемлющего (например, оптимизации условий предварительного гибридизации для кросс несвязанном ткани). Точно так, как описано в инструкции завода-изготовителя может использоваться протокол рыбы.
Незначительные изменения от manufacturer´s инструкциям, описанным в этот протокол (например ткани раздел диаметр и инкубации периодов на шаги, депарафинизации) результат от предыдущих адаптации, которая явно рекомендованный производителем за счет использования различных тканей типы и методы фиксации.
После фиксации шаг очень важен, потому что он требует химической реакции время 18-24 ч, который расширяет время анализа на один день, но позволяет же ежедневных рабочих процессов, разработанных для FFPE ткани (рис. 1). SBFS, как сообщается, проникает в ткани в среднем 1 мм за22 часа до 5 мм в 2 ч в зависимости от ткани типа23,24. Наблюдения, что только после фиксации длительного более чем 18 h может изменить свойства NCFPE в FFPE секции, указывает, что не проникновения фиксатором, но время химической реакции критически важное значение для достижения желаемых результатов1 ,14.
Во-вторых остальные NCFPE ткани, которая не используется для после фиксации может использоваться для дальнейшего молекулярного анализа как биомолекул хорошо сохранились. Это было продемонстрировано в реальном времени обратной транскрипции ПЦР (рис. 3). Assay более чувствительной, чем electropherogram производные Рин значение (РНК целостности номер) в отношении качества РНК (т.е., химическая модификация и фрагментации) для мРНК, изолированных от парафин врезанных тканей8. Контроль качества был ограничен в этом исследовании для ПЦР в реальном времени, так как независимые группы показали, что в дополнение к РНК, качество ДНК и белков, изолированных от NCFPE лучше, чем из FFPE тканей 8,9, 13.
Протокола, представлены следующим образом, где это применимо (например, SBFS рецепт, фиксации условий, РНК контроль качества, проверка), требования CEN технических спецификаций для предварительно аналитических процедур для in vitro диагностики (ИВД), которые недавно выпустила Европейского комитета стандартизации (ЕКС) (например CEN/TS 16827-1:2015 для РНК-изоляция из FFPE ткани, которая относится к стандарту ISO 15189).
Этот метод ограничен этой конкретной фиксатором. Хотя в нескольких исследованиях была представлена хорошо сохранение биомолекул и морфологии, используя не кросс ссылок, формалин бесплатные фиксатором, он в основном используется в научных исследованиях, но не в обычной медицине. Одной из причин является, что замена золотой стандарт SBFS фиксации по другим фиксатором потребует различных исследований проверки как не все протоколы, оптимизированный для FFPE материал может быть использован для материалов с не кросс ссылок фиксаторы. Другие методы фиксации ткани, не были проверены для этой рыбы протокола.
Простой шаг после фиксации, описанные в этой рукописи имеет преимущество использования IVD одобрил анализы как для FFPE и NCFPE тканей.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим команды в лаборатории молекулярной патологии в Институт патологии медицинского университета Граца для их знания и поддержку. Кроме того мы благодарим Iris Kufferath и Daniela Пабст для оказания технической помощи, Бернадетт Rieger и Сильвия Eidenhammer для обработки случаев HER2 а также Kinga Szurian (патологоанатома) и Тамас Regényi (3DHISTEC). Мы благодарим Пенелопа Kungl за корректуру рукопись. Эта работа финансовую поддержку Кристиан Допплер научный фонд, Австрийское федеральное министерство науки, исследований и экономики и Национальный фонд для научных исследований, технологий и развития.
Materials
| SAV LP GmbH, Flintsbach a. I., Germany | www.sav-lp.de | FN-200L-4-1 | Tissue fixative |
| Simport Plastic Ltd., Beloeil, Canada | www.simport.com | M-498 | Safekeeping device providing labelling, fixation and paraffin embedding for tissue samples. |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 765112 | For collection, fixation, and stabilization of tissue samples: 10 Prefilled Reagent Containers, containing PAXgene Tissue FIX and PAXgene Tissue STABILIZER. |
| ThermoFisher Scientific | www.thermofisher.com | 813150 | Processing of biological specimens from chemical fixation to paraffin infiltration |
| Merck Millipore, Munich, Germany | www.analytics-shop.com/de/hersteller/millipore.html | MC1009834000 | Dehydration of tissue samples |
| VWR Chemicals, Darmstadt, Germany | https://at.vwr.com | 10293EP | Dehydration of tissue samples |
| ACM Herba Chemosan Apotheker AG, Vienna, Austria | www.herba-chemosan.at | 2549662 32 | Paraffin used in a tissue processing device |
| Leica Mikrosysteme Handels GmbH, Vienna, Austria | www.LeicaBiosystems.com | 39602004 | Paraffin embedding medium |
| Sanova Diagnostik, Vienna, Austria | www.sanova.at | 5229 | Paraffin embedding instrument for tissues for histology |
| Histocom Medizintechnik Vertriebs GmbH, Wiener Neudorf, Austria | www.histocom.info | M 910010 | This device is used for especially sophisticated paraffin sectioning techniques in biology and medicine. Only skilled or specially trained personnel must operate the microtome, i.e. clamping the specimen, trimming, sectioning and taking off the sections from the instrument. |
| Dako Denmark A/S, Glostrup, Denmark | www.chem.agilent.com | K802021-2 | Coated glass slides, intended for mounting formalin-fixed, paraffin-embedded tissue sections. |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 73504 | For purification of total RNA from formalin-fixed, paraffin-embedded tissue sections |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 765134 | For purification of total RNA from PAXgene-fixed, paraffin-embedded tissue sections |
| ZytoVision GmbH, Bremerhaven, Germany | www.zytovision.com | Z-2015-200 | For the detection of ERBB2 (a.k.a HER2) gene amplification frequently observed in solid malignant neoplasms e.g. breast cancer samples. |
| 3DHISTEC, Budapest, Hungary | www.3dhistech.com | Digital device for scanning tissue slides equipped with a 40x/1.2 NA objective, Quad band filters (DAPI/FITC/TRITC/Cy5) filters and a 5.5Mpx, 16 bit, cooled scientific CMOS (Complementary Metal Oxide Semiconductor) camera. | |
| ThermoFisher Scientific | www.thermofisher.com | 4368814 | The High Capacity cDNA Reverse Transcription Kit contains all components necessary for the quantitative conversion of up to 2 µg of total RNA to single-stranded cDNA in a single 20 µL reaction. |
| ThermoFisher Scientific | www.thermofisher.com | 4367659 | PCR Master Mix containing polymerase, nucleotides and SYBR Green for PCR and quanitification of amplicons. |
| ThermoFisher Scientific, Wilmington, DE | www.thermofisher.com | Ser. Nr. F239 | Spectrophotometer for nucleic acid quantification. |
| QuantStudio 7 Flex Real-time PCR System | www.thermofisher.com | 4485701 | PCR machine, |
| Vysis/Abbott Laboratories. Abbott Park, Illinois, U.S.A | www.molecular.abbott/us/en/products/instrumentation/thermobrite#order | e.g. (ThermoBrite) 07J91-020 | Temperature controlled slide processing system for in-situ denaturation/hybridization procedures. |
References
- Fox, C. H., Johnson, F. B., Whiting, J., Roller, R. P. Formaldehyde fixation. J. Histochem.Cytochem. 33 (8), 845-853 (1985).
- Oosterhuis, J. W., Coebergh, J. W., van Veen, E. B. Tumour banks: well-guarded treasures in the interest of patients. Nat. Rev. Cancer. 3 (1), 73-77 (2003).
- Masuda, N., Ohnishi, T., Kawamoto, S., Monden, M., Okubo, K. Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples. Nucleic Acids Res. 27 (22), 4436-4443 (1999).
- Metz, B., Kersten, G. F., Hoogerhout, P., Brugghe, H. F., Timmermans, H. A., de Jong, A., et al. Identification of formaldehyde-induced modifications in proteins: reactionswith model peptides. J. Biol. Chem. 279 (8), 6235-6243 (2003).
- Evers, D. L., Fowler, C. B., Cunningham, B. R., Mason, J. T., O’Leary, T. J. The effect of formaldehyde fixation on RNA: optimization of formaldehyde adduct removal. J.Mol. Diagn. 13 (3), 282-288 (2011).
- Groelz, D., Sobin, L., Branton, P., Compton, C., Wyrich, R., Rainen, L. Non-formalin fixative versus formalin-fixed tissue: A comparison of histology and RNA quality. Exp. Mol. Pathol. 94 (1), 188-194 (2013).
- Do, H., Dobrovic, A. Sequence artifacts in DNA from formalin-fixed tissues: causes and strategies for minimization. Clin. Chem. 61, 64-71 (2015).
- Kashofer, K., Viertler, C., Pichler, M., Zatloukal, K. Quality Control of RNA Preservation and Extraction from Paraffin-Embedded Tissue: Implications for RT-PCR and Microarray Analysis. PloS One. 8 (7), e70714 (2013).
- Viertler, C., Groelz, D., Gündisch, S., Kashofer, K., Reischauer, B., Riegman, P. H., et al. A new technology for stabilization of biomolecules in tissues for combined histological and molecular analyses. J. Mol. Diagn. 14 (5), 458-466 (2012).
- Gundisch, S., Slotta-Huspenina, J., Verderio, P., Maura, C., Ciniselli, S. P., Schott, S., et al. Evaluation of colon cancer histomorphology: A comparison between formalin and PAXgene tissue fixation by an international ring trial. Virchows Arch. 465 (5), 509-519 (2014).
- Ergin, B., Meding, S., Langer, R., Kap, M., Viertler, C., Schott, C., et al. Proteomic analysis of PAXgene-fixed tissues. J. Proteome Res. 9 (10), 5188-5196 (2010).
- Kap, M., Smedts, F., Oosterhuis, W., Winther, R., Christensen, N., Reischauer, B., et al. Histological Assessment of PAXgene Tissue Fixation and Stabilization Reagents. PLoS ONE. 6 (11), e27704 (2011).
- Mathieson, W., Marcon, N., Antunes, L., Ashford, D. A., Betsou, F., Frasquilho, S. G., et al. A Critical Evaluation of the PAXgene Tissue Fixation System: Morphology, Immunohistochemistry, Molecular Biology, and Proteomics. Am J Clin Pathol. 146, 25-40 (2016).
- Oberauner-Wappis, L., Loibner, M., Viertler, C., Groelz, D., Wyrich, R., Zatloukal, K. Protocol for HER2 FISH determination on PAXgene-fixed and paraffin-embedded tissue in breast cancer. Int J. Exp. Path. 97 (2), 202-206 (2016).
- Pauletti, G., Godolphin, W., Press, M. F., Slamon, D. J. Detection and quantitation ofHER-2/neu gene amplification in human breast cancer archival material using fluorescence in situ hybridization. Oncogene. 13 (1), 63-72 (1996).
- Owens, M. A., Horten, B. C., Da Silva, M. M. HER2 amplification ratios by fluorescence in situ hybridization and correlation with immunohistochemistry in a cohort of 6556 breast cancer tissues. Clin.Breast Cancer. 5 (1), 63-69 (2004).
- Wolff, A. C., Hammond, M. E., Schwartz, J. N., Hagerty, K. L., Allred, D. C., Cote, R. J., et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med. 131 (1), 18-43 (2007).
- Press, M. F., Bernstein, L., Thomas, P. A., Meisner, L. F., Zhou, J. Y., Ma, Y., et al. HER-2/neu gene amplification characterized by fluorescence in situ hybridization: poor prognosis in node-negative breast carcinomas. J. Clin. Oncol. 15 (8), 2894-2904 (1997).
- Yamauchi, H., Stearns, V., Hayes, D. F. When is a tumor marker ready for prime time? A case study of c-erbB-2 as a predictive factor in breast cancer. J. Clin. Oncol. 19 (8), 2334-2356 (2001).
- Paulik, R., Micsik, T., Kiszler, G., Kaszál, P., Székely, J., Paulik, N., Várhalmi, E., Prémusz, V., Krenács, T., Molnár, B. An optimized image analysis algorithm for detecting nuclear signals in digital whole slides for histopathology. Cytometry A. , (2017).
- Applied Biosystems. . QuantStudio 6 and 7 Flex Real-Time PCR System Software. , (2013).
- NCCLS. . Quality Assurance for Immunocytochemistry. , (1999).
- Baker, J. R. . Principles of Biological Microtechnique. , (1958).
- Hewitt, S. M., Lewis, F., Cao, Y., Conrad, R. C., Cronin, M., Danenberg, K. D., et al. Tissue handling and specimen preparation in surgical pathology: issues concerning the recovery of nucleic acids from formalin-fixed, paraffin-embedded tissue. Arch Pathol. Lab Med. 132 (12), 1929-1935 (2008).

