Değerlendirirken birincil patlama efektleri Vitro
Summary
Nasıl hücreleri tarafından şok dalgalarıyla modüle anlama gelen patlama olayları tetikleyen yaralanmaları arkasında mekanizmaları belirlemenize yardımcı olabilir. Bu iletişim kuralı özel olarak oluşturulmuş şok tüpü ekipman hücre monolayers için şok dalgaları baskıların bir mesafeden uygulamak ve hücre canlılığı üzerinde sonraki etkileri tanımlamak için kullanır.
Abstract
Patlama olaylara maruz akciğerler, kulak ve beyin gibi hayati organlara ağır travma neden olabilir. Böyle patlama kaynaklı yaralanmaları arkasında mekanizmaları anlama patlayıcı kullanımı yönünde son eğilim modern warfare ve terörist ile ilgili olaylar dikkate alınarak büyük önem taşıyor. Patlama kaynaklı yaralanma tamamen anlamak için biz ilk tür patlama olaylara tekrarlanabilir bir yöntemle kontrollü bir ortamda çoğaltmak gerekir. 2D olarak yetiştirilen canlı hücreleri üzerinde şok dalgaları baskıların bir mesafeden türetilebilecek şok tüpü donanımları kullanarak bu tekniği ve işaretleri hücre canlılık hemen bir Redoks göstergesi tahlil ve canlı ve ölü hücreleri floresan görüntüleme kullanılarak analiz edilebilir. Bu yöntem en yüksek patlama aşırı basınç 127 kPa için artan önemli bir düşüş ne zaman tedavi edilmezse kontrollere göre hücre canlılığı içinde teşvik edebilirsiniz olduğunu gösterdi. Test örnekleri yapisan hücrelere sınırlı değildir, ancak hücre süspansiyonlar, ekleyebilirsiniz şok tüp kurulum küçük değişiklikler ile tüm vücut ve doku örnekleri. Doku ve hücreleri bir gerçek patlama olayına maruz kaldığında deneyim kesin şartlar çoğaltılıyor zordur. Bu makalede sunulan bir gibi teknikleri hasar eşikler tanımlayabilir ve şok dalgası maruz ortaya hücrelerde transkripsiyon ve epigenetik değişiklikleri belirlemek için yardımcı olabilir.
Introduction
Modern savaş ve terör eylemleri sivillere doğaçlama patlayıcı cihazların kullanımı doğru son eğilim ile insan vücudunda patlayıcı olaylar etkilerini anlama açısından önemlidir. Patlama olaylara maruz kalma yoluyla elde yaralanmalar ölümcül ve ölümcül yaralanma dört kategoriye bölünmüş fiziksel süreçleri ile olabilir. Yerel olarak vücut ile basınç ve daha sonra geniş bir şekilde etkileşime girer, patlama dalgası doğrudan maruz birincil yaralanmalar sonucu membran ve yumuşak dokular1bozulma neden. İkincil yaralanma künt travma veya nüfuz edici yaralar yüksek hızda patlama dalgası tarafından tahrikli düşük kütle nesnelerle etkisi tarafından neden içerir. Patlama dalgası yüksek kitle ya da bireyler nesneleri karşı nesnelerini atmak için yeterli enerji Tersiyer yaralanmalar meydana gelir. Son olarak, Kuvaterner patlama yaralanmaları flash burns2gibi diğer kategorilere sığmayan diğer çeşitli yaralanma tarafından tanımlanır. Tür patlama olaylara maruz, birincil yaralanmaları dahil travmatik beyin hasarı3,4,5, heterotopik ossifikasyon6,7, patlama akciğer hasarı8, işitme kaybı 9ve diğerleri10.
Yaygın olarak gözlenen bir dalga patlama olaylardan Friedlander dalgadır, ücretsiz alan, bir kapalı alanı, aksine patlama temsil eden. Dalga biçimi pozitif basınç keskin ve hızlı artış olarak tanımlanabilir bir patlama açık oluşur. Bu hemen hava yüksek hız ve basınç atmosferik seviyenin altında azaltır bir yayın dalga hareketli bir patlama rüzgarı izler. Kısmi bir vakum, bölgenin hava yavaş geri tepme sonuç ilk patlamanın yaptı. Dalga (şekil 1A) pozitif ve negatif aşamalarını patlama dalgası1itme-çekme hareketi neden. Arkasında birincil patlama yaralanma mekanizmaları aydınlatmak amacıyla, deneysel modeller gibi hücre ve dokuların gerçek patlama olayına maruz kaldığında karşılaşacağı Friedlander dalga dalga biçimleri üretmek için oluşturulmuştur. Mevcut sistemleri literatürde listelenen şok tüpleri11,12,13,14,15,16,17dahil, barochambers18,19, Kolsky bar20, Gelişmiş patlama simülatörleri21, Split Hopkinson basınç çubuğu22ve kontrollü ortam kullanarak alternatif patlama olayların rekreasyon pentaerythritol tetranitrate23. Çeşitli modeller rağmen patlama dalgaları, uygulanan öncesi stres de dahil olmak üzere ve mekanik özelliklerini, tek hücre türleri veya değerlendirme24altındaki dokuları elde edilen yaralanma fazla değişken etkiler. Çalışma doku veya organ doku deformasyon ve Brüt morfolojik değişiklikler patlama olaylar sonucu olarak sürekli ışık tutabilir iken, hücresel düzeyde analiz şok dalgası tarafından etkilenmiş transkripsiyon ve epigenetik değişikliklerin ortaya çıkarmak.
Bu yöntemleri makalede bir monolayer canlı hücreleri üzerinde baskıların bir mesafeden şok dalgaları yaymak için bir teknik anlatılmaktadır. Bu hücre canlılığı potansiyel hasar eşikleri şok dalgaları üzerinden elucidating, hemen karakterizasyonu için sağlar. Ayrıca, hücrelerin standart kültür koşulları için döndürülebilir ve uzun vadeli biyolojik etkileri patlama olaydan tespit edilebilir. İletişim kuralı aşağıdaki kültüründe hücreleri üzerinde kullanılan iki hücre canlılığı teknikleri açıklar.
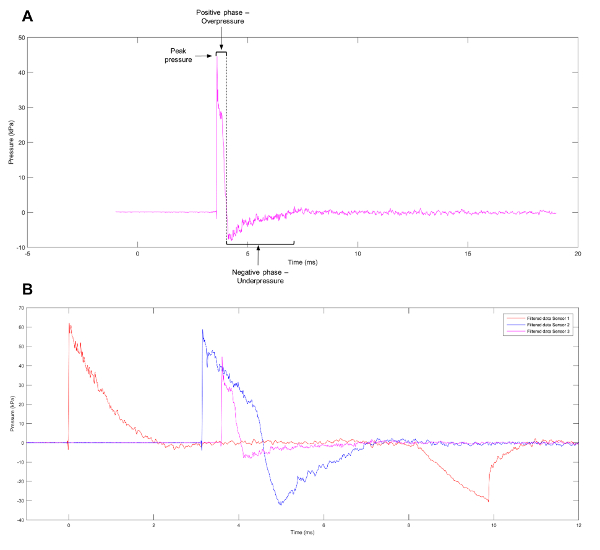
Şekil 1: Yaklaşım Friedlander dalgasının. (A) sensör 3 şok tüpü üzerinde gözlenen bir Friedlander dalga yaklaşık. (B) temsilcisi veri farklı basınç profilleri gösterilen sensörler 1, 2 ve 3 şok tüpü üzerinde gözlenen. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protocol
Representative Results
Discussion
Birincil yaralanmaları patlama olaylara maruz elde henüz tam olarak anlaşılır değil. Belirlenmesi ve travmatik beyin hasarı3,gibi patlama kaynaklı yaralanmaları tetiklemek mekanizmaları anlama4 ve heterotopik ossifikasyon6,7, geliştirmek için önemli ilk adım vardır profilaksi etkili yöntemleri. Bu hedefe ulaşmak yardımcı olmak için deneysel sistemleri bir dizi patlama olay maruz kalma11,12,13,14,18,19 çoğaltmak için geliştirilmiştir . Açıklanan teknik burada şok tüpü donatımı (Şekil 2) şok dalgaları baskıların tüm vücut (Yani, kemirgen), doku veya hücre örnekleri bir mesafeden atış yeteneğine sahip kullanır. Hasar mekanizmaları1,2bir dizi ile aynı anda ortaya çıkabilir gibi tüm dokular yerine tek tek hücre tipleri yüklemek için ayrı hücresel yanıt ayrıştırma yeteneği sağlıyor. Örneğin, travmatik modellemek için beyin hasarı, sinir hücreleri ve astrocytes, tek hücre türleri değerlendirilmesi hücre özgü yaralanma tanımlanması için izin verebilirsiniz. Ayrıca, Bütün organ yanıt beyin dokusu kullanarak tespit edilebilir. Tek hücre türleri ve doku örnekleri değere sahip ve farklı bilgiler verebilir. Çift-yarık veya sürücü-tüp giriş seçerek şok oluşturmak için basınçlı hava miktarını değiştirmek mümkündür. Bu şok dalgası süresi denetler. Diyafram malzeme ve kalınlık en yüksek basınç25değiştirmek için değiştirmek için başka bir olasılık olabilir.
Başka bir faktör dikkate ne zaman örnek konut mevcut sistemi açıklanan EVOC sondaj platformu üzerinde bulduğu gibi şok tüpü çıkış yakınında mevcut olabilir müdahale sonunda etkileri vardır. Chandra vd. sıkıştırma tahrik şok tüpü farklı konumlarda bulunan ve bir yerde içinde şok tüpü15derin Friedlander dalga formu en iyi temsil edildi bulundu patlama dalgası profilleri baktı. Kuriakose vd. Ayrıca ikincil örnek yüklenmesini okudu ve şok tüpü sonunda sonuna plaka yerleşimini istenmeyen yansıyan dalgalar16ortadan kaldırmak mümkün olduğunu fark etti. Verileri dikkate alınarak, bu yayınları15,16‘ da, bu makalede açıklanan şok tüp sistemi geliştirmek için gelecekteki değişiklikler tahrik tüp içinde daha derin bir yerde EVOC teçhizat yerleşimini dahil bulundu veya, Alternatif olarak, bir bitiş plaka üzerinde şok tüpü dahil. Açıklanan yöntemi sınırlamaları nispeten düşük akış verimi, örnekler içerebilir. Tek bir kullanıcı şok tüp bir çıktısını, güvenli bir şekilde çalışabilir saat başına 6-8 örnek. Şu anda, sistem çapında tek 35-mm petri yemekler kullanılan tasarlanmıştır. Bu nedenle, birden çok grubu ve biyolojik çoğaltır içeren daha büyük deneyler elde etmek zor olabilir.
Bu yöntemleri makale nasıl canlılığı yapisan dermal papilla hücre tek bir şok dalgası maruz etkilendi gösterir. Bir kısa süreli şok dalgası (< 10 ms) ≤72 kPa (şekil 3 ve şekil 4) denetimine göre canlılığı etkilemedi. Buna ek olarak, bir şok dalgası 127 kPa, önemli bir düşüş canlılığı, 24 saat sonrası patlama, içinde bir Redoks göstergesi tahlil (şekil 3) ve floresan görüntü analizi (şekil 4) tarafından gösterildiği gibi teşvik. Miller vd. rapor benzer bir azalma hücre canlılığı sıçan organotypic Hipokampal dilim kültürlerde ne zaman hücreleri bir ya da maruz kaldılar bir 147 kPa veya 278 kPa şok dalgası bir açık uçlu, helyum odaklı şok tüpü14kullanarak. Buna ek olarak, VandeVord ve ark. fare astrocytes için bir kısa süreli aşırı basınç-maruz canlılığı üzerinde bir etkisi olduğunu bildirdiler > 200 kPa, her ne kadar bir barochamber ziyade bir şok tüpü18kullanıldı. Bu karmaşık stres dalgalar bünyesinde, bu nedenle yükleme doğası doku veya hücre mekanik özelliklerini son derece bağımlı hale oluşturur, ancak dış basınç patlama dalgası üzerinde bağımlı olduğunu belirtmek. Hücresel olaylarına yanıt olarak patlama ek karakterizasyon çalışmaları gereklidir. Ayrıca, şok dalgası pozlama hücresel düzeyde Bu teknikte gösterildiği tarafından değerlendirilmesi, biyolojik yanıt yolları veya epigenetik değişiklikleri, sinyal pertürbasyon gibi yaralanmalara karşı tetiklenen olabilir tespit ve daha da araştırdı.
Sonuç olarak, bu iş bir paslanmaz çelik şok tüpü ve birincil hücre kültürleri dahil etmek için değiştirilmiş bir EVOC teçhizat kullanımını açıklar. Şok dalgaları baskıların bir mesafeden oluşturulan ve bir patlama dalgası maruz etkileri çoğaltmak için canlı hücreleri üzerine yayılır. Bu iletişim kuralı hücre canlılığı değerlendirmek gösterilmiştir, ama daha uzun vadeli değişiklikleri tek tek hücre tipleri için de okudu. İleriye, biz karmaşık şok dalgaları, farklı hücre tipleri, birincil yaralanmaları patlama kaynaklı anlayışımızı sürdürmek amacıyla temin fark etkilerini değerlendirmek için plan.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Royal British Legion Merkezi finansal destek için patlama yaralanma çalışmalar HA ve tıbbi araştırma Konseyi (M01858X/1) kah için finansman için kabul etmek istiyoruz.
Materials
| MEM α, nucleosides | ThermoFisher | 22571020 | |
| Fetal Bovine Serum, certified, US origin | ThermoFisher | 16000044 | Supplement to create complete growth media. |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich | D8537 | |
| Penicillin-Streptomycin | ThermoFisher | 15070-063 | Supplement to create complete growth media. |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher | 15400-054 | Dilute 1 in 10 before use. |
| CytoOne T-75 Flask, TC-Treated, vented | Starlab | CC7682-4875 | |
| TC Dish (PS) 35mm, 8.5 cm2 | Triple Red | TCD010035 | |
| Petri dish (PS) 90×14.2mm no vent | VWR UK | 391-0453 | |
| Gas Permeable Adhesive Plate Seals | ThermoFisher | AB-0718 | |
| LIVE/DEAD Cell Imaging Kit (488/570) | ThermoFisher | R37601 | |
| Alamarblue cell viability reagent | Fisher Scientific | 13494309 | |
| Virkon tablets | VWR UK | 115-0020 | Use to create 2% solution as viability control reagent. |
| Dumont forceps | SurgicalTools | 11295-10 | Use to remove coverslips from petri dish. |
| Cover glass, square | VWR UK | 631-0125 | |
| Microscope slides | VWR UK | 631-1553 | |
| 96 Well plate, solid black | AppletonWoods | CC760 | Plate to be used for fluorescence measurements. |
| 96 Well plate, clear, (PS) | VWR UK | 734-1799 | Plate to be used for absorbance measurments. |
| Leica DMi1 Camera stand outfit | Leica Microsystems | Optical microscope used for cell culture. | |
| Zeiss PALM MicroBeam Laser Capture Microdisseciton | Zeiss | Fluorescence microsope used for LIVE/DEAD imaging. | |
| EnVision Multilabel Reader | PerkinElmer | 2104-0010A | Plate reader to be used for fluorescence/absorbance readings. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.023mm | RS Components | 785-0782 | Use to create shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.05mm | RS Components | 785-0786 | Use to creatw shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.125mm | RS Components | 785-0798 | Use to create shock tube diaphragm. |
| Current source power unit | Dytran Intruments Inc. | 4103C | Power source for 2300V1 sensor. |
| IEPE Pressure Sensor | Dytran Intruments Inc. | 2300V1 | Pressure sensor located on shock tube. |
| Digital Phosphor Oscilloscope | Tektronix | DPO 4104B | Use to gather and save sensor 2300V1 data. |
References
- Proud, W. G. The physical basis of explosion and blast injury processes. J R Army Med Corps. 159, 4-9 (2013).
- Born, C. T. Blast Trauma: The Fourth Weapon of Mass Destruction. Scand J of Surg. 94 (4), 279-285 (2005).
- Kocsis, J. D., Tessler, A. Pathology of blast-related brain injury. J Rehabil Res Dev. 46 (6), 667-671 (2009).
- Bass, C. R., et al. Brain Injuries from Blast. Ann Biomed Eng. 40 (1), 185-202 (2012).
- Cernak, I., Kobeissy, F. H. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Alfieri, K. A., Forsberg, J. A., Potter, B. K. Blast injuries and heterotopic ossification. Bone Joint Res. 1 (8), 174-179 (2012).
- Potter, B. K., Burns, T. C., Lacap, A. P., Granville, R. R., Gajewski, D. A. Heterotopic Ossification Following Traumatic and Combat-Related Amputations. Prevalence, Risk Factors, and Preliminary Results of Excision. J Bone Joint Surg Am. 89 (3), 476-486 (2007).
- Sasser, S. M., Sattin, R. W., Hunt, R. C., Krohmer, J. Blast Lung Injury. Prehosp Emerg Care. 10 (2), 165-172 (2006).
- Cho, S. -. I., et al. Mechanisms of Hearing Loss after Blast Injury to the Ear. PLoS ONE. 8 (7), 67618 (2013).
- Bull, M. A., Clasper, J., Mahoney, P. . Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. , (2016).
- Arun, P., et al. Studies on blast traumatic brain injury using in-vitro model with shock tube. Neuroreport. 22 (8), 379-384 (2011).
- Ahlers, S. T., et al. Assessment of the effects of acute and repeated exposure to blast overpressure in rodents: toward a greater understanding of blast and the potential ramifications for injury in humans exposed to blast. Front Neurol. 3, 32 (2012).
- Polfer, E. M., et al. The development of a rat model to investigate the formation of blast-related post-traumatic heterotopic ossification. Bone Joint J. 97 (4), 572-576 (2015).
- Miller, A. P., et al. Effects of Blast Overpressure on Neurons and Glial Cells in Rat Organotypic Hippocampal Slice Cultures. Front Neurol. 6, 20 (2015).
- Chandra, N., et al. Evolution of blast wave profiles in simulated air blasts: experiment and computational modeling. Shock Waves. 22 (5), 403-415 (2012).
- Kuriakose, M., et al. Tailoring the Blast Exposure Conditions in the Shock Tube for Generating Pure, Primary Shock Waves: The End Plate Facilitates Elimination of Secondary Loading of the Specimen. PLoS ONE. 11 (9), 0161597 (2016).
- Reneer, D. V., et al. A Multi-Mode Shock Tube for Investigation of Blast-Induced Traumatic Brain Injury. J Neurotrauma. 28 (1), 95-104 (2011).
- VandeVord, P. J., et al. Up-regulation of reactivity and survival genes in astrocytes after exposure to short duration overpressure. Neurosci Lett. 434 (3), 247-252 (2008).
- Kane, M. J., et al. Altered gene expression in cultured microglia in response to simulated blast overpressure: Possible role of pulse duration. Neurosci Lett. 522 (1), 47-51 (2012).
- Nienaber, M., Lee, J. S., Feng, R., Lim, J. Y. Impulsive pressurization of neuronal cells for traumatic brain injury study. J Vis Exp. (56), (2011).
- Zhang, J., et al. Transcriptional Profiling in Rat Hair Follicles following Simulated Blast Insult: A New Diagnostic Tool for Traumatic Brain Injury. PLoS ONE. 9 (8), 104518 (2014).
- Bo, C., et al. Cellular characterization of compression-induceddamage in live biological samples. AIP Conf Proc. 1426 (1), 153-156 (2012).
- Tannous, O., Griffith, C., O’Toole, R. V., Pellegrini, V. D. Heterotopic ossification after extremity blast amputation in a Sprague-Dawley rat animal model. J Orthop Trauma. 25 (8), 506-510 (2011).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-Vitro Approaches for Studying Blast-Induced Traumatic Brain Injury. J Neurotrauma. 26 (6), 861-876 (2009).
- Nguyen, T. T. N., Wilgeroth, J. M., Proud, W. G. Controlling blast wave generation in a shock tube for biological applications. JPCS. 500 (14), 142025 (2014).

