Summary
Compreensão de como as células são moduladas pela exposição a ondas de choque pode ajudar a identificar os mecanismos subjacentes lesões acionados por eventos de explosão. Este protocolo usa equipamento de tubo de choque custom-built para aplicar as ondas de choque em uma gama de pressões de monocamadas de células e identificar os efeitos subsequentes na viabilidade celular.
Abstract
Exposição a eventos de explosão pode causar trauma grave de órgãos vitais como os pulmões, ouvidos e cérebro. Compreender os mecanismos por trás de tais ferimentos induzida a explosão é de grande importância, tendo em conta a recente tendência para a utilização de explosivos em modern warfare e incidentes relacionados ao terrorista. Para entender completamente a lesão induzida pela explosão, nós deve primeiro ser capazes de replicar tais eventos de explosão em um ambiente controlado, usando um método reprodutível. Esta técnica usando equipamento de tubo de choque, as ondas de choque em uma gama de pressões podem ser propagadas sobre células vivas cultivadas em 2D e marcadores de viabilidade celular podem ser imediatamente analisados usando um ensaio de indicador redox e a imagem fluorescente de células vivas e mortas. Este método demonstrou que aumentando a sobrepressão de explosão de pico para 127 kPa pode estimular uma significativa queda na viabilidade celular quando comparados aos controles não tratados. Amostras de teste não estão limitadas a células aderentes, mas pode incluir suspensões celulares, amostras de tecido e todo o corpo, através de pequenas modificações para a instalação de tubo de choque. Replicar as condições exatas que tecidos e células experimentam quando expostos a um evento de explosão genuíno é difícil. Técnicas como o apresentado neste artigo podem ajudar a definir limiares de dano e identificar as alterações epigenéticas e transcriptional dentro das células resultantes de exposição de ondas de choque.
Introduction
Com a recente tendência para a utilização de dispositivos explosivos improvisados em modern warfare e ações terroristas contra civis, compreender os efeitos de eventos explosivos no corpo humano é de grande importância. Ferimentos obtidos através da exposição a eventos de explosão podem ser mortal e letal, com os processos físicos de lesão a ser divididos em quatro categorias. Resultado de lesões primárias de exposição directa para a onda da explosão, que interage com o corpo localmente de forma compressiva e posteriormente expansiva, causando a ruptura de membranas e tecidos moles1. Lesões secundárias incluem trauma contuso ou penetrante feridas causadas pelo impacto com objetos de baixa massa impelidos a alta velocidade pela onda de explosão. Lesões terciárias ocorrem quando a onda da explosão tem energia suficiente para lançar objetos de massa alta ou indivíduos contra objetos. Por último, lesões de explosão quaternária são definidos por outros diversos ferimentos que não cabem as outras categorias, tais como queimaduras flash2. Após exposição a tais eventos de explosão, lesões primárias incluem54,3,do lesão cerebral traumática, ossificação heterotópica6,7, explosão de lesão pulmonar8, perda de audição 9e os outros10.
Uma forma de onda observada comumente de eventos de explosão é a onda de Friedlander, representando uma explosão de campo livre, em oposição a um espaço fechado. A forma de onda é composto por uma frente de explosão que pode ser definida como um aumento afiado e rápido da pressão positiva. Isto é seguido imediatamente por um vento de explosão de ar se movendo em alta velocidade e uma onda de liberação que reduz a pressão para abaixo dos níveis atmosféricos. Um vácuo parcial é deixado na região da explosão inicial, que resulta no lento refluxo de ar. As fases positivas e negativas da onda (figura 1A) resultam no movimento de encaixe da explosão onda1. Para ajudar a elucidar os mecanismos por trás de lesões de impacto, modelos experimentais foram criados para produzir formas de onda, tais como a onda de Friedlander, que células e tecidos terá de enfrentar quando exposta a um evento de explosão genuíno. Atuais sistemas listados na literatura incluem choque tubos11,12,13,14,15,16,17, barochambers18,19, o Kolsky bar20, explosão avançados simuladores21, o Split Hopkinson pressão bar22e a recriação de eventos alternativos de explosão em um ambiente controlado usando Tetranitrato de pentaeritritol23. Apesar da ampla gama de modelos disponíveis, muitas variáveis influenciam o prejuízo obtido a partir de ondas de explosão, incluindo o pré-estresse aplicado e as propriedades mecânicas do, os tipos de células individuais ou tecidos sob avaliação24. Enquanto o estudo de tecidos ou órgãos pode lançar luz sobre a deformação do tecido e brutas alterações morfológicas sofridas como resultado de eventos de explosão, análise a nível celular pode revelar alterações epigenéticas e transcriptional influenciadas pela onda de choque.
Este artigo de métodos descreve uma técnica para propagar ondas de choque em uma gama de pressões sobre células vivas em uma monocamada. Isto permite a caracterização imediata da viabilidade celular, elucidar os limiares de dano potencial das ondas de choque. Além disso, células viáveis podem ser retornadas para as condições de cultura padrão, e podem ser avaliados a longo prazo efeitos biológicos do evento explosão. O protocolo abaixo descreve duas técnicas de viabilidade celular que podem ser usadas em células em cultura.
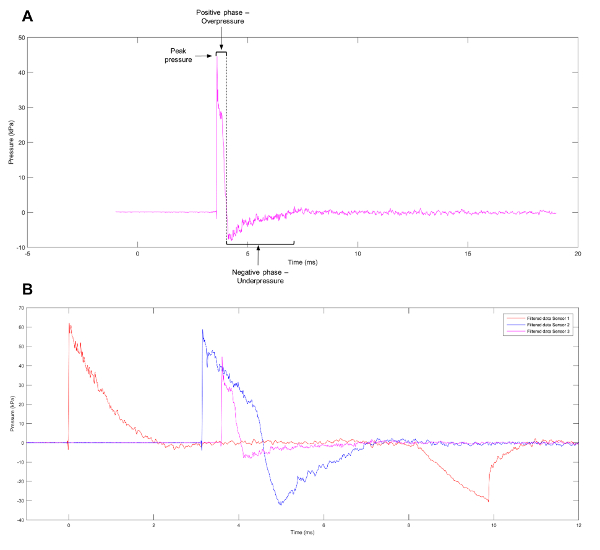
Figura 1: Aproximação de uma onda de Friedlander. (A) uma aproximação de uma onda de Friedlander observada no sensor 3 do tubo de choque. (B) dados representativos mostrando os perfis diferentes de pressão observados em sensores, 1, 2 e 3 do tubo de choque. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Lesões primárias obtidas da exposição a eventos de explosão ainda não são totalmente compreendidos. Identificar e compreender os mecanismos que provocam lesões induzida pela explosão, como da lesão cerebral traumática3,4 e ossificação heterotópica6,7, são importantes primeiros passos para o desenvolvimento métodos eficazes de profilaxia. Para ajudar a alcançar este objetivo, um número de sistemas experimentais foram desenvolvido para replicar a explosão evento exposição11,12,13,14,18,19 . A técnica descrita aqui usa tubo equipamento de choque (Figura 2) capaz de disparar ondas de choque em uma gama de pressões em todo o corpo (ou seja, roedores), amostras de células ou tecidos. A capacidade de carregar tipos de células individuais em vez de tecidos dá a capacidade de analisar respostas celulares distintas, como dano pode ocorrer simultaneamente através de uma variedade de mecanismos1,2. Por exemplo, para modelar traumático lesão cerebral, a avaliação dos tipos de células individuais, tais como os neurônios e astrócitos, pode permitir a identificação de lesões de células específicas. Além disso, a resposta de todo órgão pode ser avaliada usando o tecido cerebral. Ambos os tipos de célula individual e as amostras de tecido tem valor e podem dar informações diferentes. Também é possível alterar a quantidade de ar que é pressurizado para gerar o choque, selecionando a entrada dupla-culatra ou condutor-tubo. Este controla a duração da onda de choque. Outra possibilidade é mudar o diafragma material e espessura para alterar a pressão de pico25.
Outro fator a considerar são efeitos de fim de interferências que podem estar presentes quando o compartimento de amostra está localizado perto da saída do tubo de choque, como a encontrada na plataforma EVOC descrita no actual sistema. Cavalcanti et al . olhou para explosão onda perfis encontrados em locais diferentes em um tubo de choque controlado por compressão e encontrado que a forma de onda Friedlander foi melhor representada em um local dentro do tubo de choque15. Kuriakose et al também estudou o secundário carregamento da amostra e descobriu que a colocação de uma placa final no final do tubo de choque era capaz de eliminar ondas refletidas indesejados16. Considerando os dados encontrados nestas publicações15,16, futuras modificações para melhorar o sistema de tubo de choque descrito neste artigo poderiam envolver a colocação do equipamento em um local mais profundo dentro do tubo conduzido EVOC ou, Alternativamente, a inclusão de uma placa final do tubo de choque. Limitações do método descrito poderiam incluir a taxa de transferência relativamente baixa das amostras. Um único usuário pode operar o tubo de choque com segurança em uma saída de em torno de 6-8 amostras por hora. Actualmente, o sistema é projetado em torno do uso de pratos de petri 35mm único. Portanto, maiores experimentos contendo vários grupos e repetições biológicas podem ser difícil de alcançar.
Este artigo de métodos mostra como a viabilidade das células da papila dérmica aderentes foi afetada pela exposição a uma única onda de choque. Uma onda de choque de curta duração (< 10 ms) de ≤72 kPa não afetou viabilidade quando comparado ao controle (Figura 3 e Figura 4). Em contraste, uma onda de choque no 127 kPa estimulou uma queda significativa na viabilidade no pós explosão 24h, como mostrado por um ensaio de indicador redox (Figura 3) e análise de imagens fluorescentes (Figura 4). Miller et al relataram uma redução similar na viabilidade celular em culturas de fatias hippocampal do rato organotypic quando as células foram expostas a um qualquer um 147 kPa ou onda de choque de 278 kPa usando um tubo de choque em aberto, orientado por Hélio14. Em contraste, VandeVord et al . reportou que não havia nenhum efeito sobre a viabilidade em astrócitos de ratos expostos a uma sobrepressão de curta duração de > 200 kPa, embora um barochamber foi usado em vez de um tubo de choque18. Deve notar-se que a pressão externa é dependente da onda de explosão, embora isto cria ondas de estresse complexo dentro do corpo, portanto, tornando a natureza do carregamento altamente depende das propriedades mecânicas do tecido ou da célula. Estudos de caracterização adicional da resposta celular aos eventos de explosão é necessária. Além disso, avaliando exposição de onda de choque a nível celular, como mostrado nesta técnica, respostas biológicas acionadas por lesão, tais como a perturbação de sinalização de percursos ou alterações epigenéticas, podem ser identificadas e exploradas ainda mais.
Em conclusão, este trabalho descreve o uso de um tubo de aço inoxidável de choque e um aparelho EVOC modificado para incorporar culturas celulares primárias. Ondas de choque em uma gama de pressões podem ser geradas e propagadas em células vivas para replicar os efeitos que ocorrem pela exposição a uma onda de choque. Este protocolo demonstra como avaliar a viabilidade celular, mas a longo prazo alterações em tipos de células individuais também podem ser estudadas. Vai em frente, pretendemos avaliar os efeitos diferenciais que complexas ondas de choque pode eliciar em diferentes tipos de células, com o objectivo de aprofundar a nossa compreensão das lesões primárias induzida pela explosão.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nós gostaríamos de reconhecer o apoio financeiro do centro da Legião real britânica para estudos de lesão explosão HA e financiamento do Conselho de pesquisa médica (M01858X/1) para CAH.
Materials
| MEM α, nucleosides | ThermoFisher | 22571020 | |
| Fetal Bovine Serum, certified, US origin | ThermoFisher | 16000044 | Supplement to create complete growth media. |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich | D8537 | |
| Penicillin-Streptomycin | ThermoFisher | 15070-063 | Supplement to create complete growth media. |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher | 15400-054 | Dilute 1 in 10 before use. |
| CytoOne T-75 Flask, TC-Treated, vented | Starlab | CC7682-4875 | |
| TC Dish (PS) 35mm, 8.5 cm2 | Triple Red | TCD010035 | |
| Petri dish (PS) 90×14.2mm no vent | VWR UK | 391-0453 | |
| Gas Permeable Adhesive Plate Seals | ThermoFisher | AB-0718 | |
| LIVE/DEAD Cell Imaging Kit (488/570) | ThermoFisher | R37601 | |
| Alamarblue cell viability reagent | Fisher Scientific | 13494309 | |
| Virkon tablets | VWR UK | 115-0020 | Use to create 2% solution as viability control reagent. |
| Dumont forceps | SurgicalTools | 11295-10 | Use to remove coverslips from petri dish. |
| Cover glass, square | VWR UK | 631-0125 | |
| Microscope slides | VWR UK | 631-1553 | |
| 96 Well plate, solid black | AppletonWoods | CC760 | Plate to be used for fluorescence measurements. |
| 96 Well plate, clear, (PS) | VWR UK | 734-1799 | Plate to be used for absorbance measurments. |
| Leica DMi1 Camera stand outfit | Leica Microsystems | Optical microscope used for cell culture. | |
| Zeiss PALM MicroBeam Laser Capture Microdisseciton | Zeiss | Fluorescence microsope used for LIVE/DEAD imaging. | |
| EnVision Multilabel Reader | PerkinElmer | 2104-0010A | Plate reader to be used for fluorescence/absorbance readings. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.023mm | RS Components | 785-0782 | Use to create shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.05mm | RS Components | 785-0786 | Use to creatw shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.125mm | RS Components | 785-0798 | Use to create shock tube diaphragm. |
| Current source power unit | Dytran Intruments Inc. | 4103C | Power source for 2300V1 sensor. |
| IEPE Pressure Sensor | Dytran Intruments Inc. | 2300V1 | Pressure sensor located on shock tube. |
| Digital Phosphor Oscilloscope | Tektronix | DPO 4104B | Use to gather and save sensor 2300V1 data. |
References
- Proud, W. G. The physical basis of explosion and blast injury processes. J R Army Med Corps. 159, 4-9 (2013).
- Born, C. T. Blast Trauma: The Fourth Weapon of Mass Destruction. Scand J of Surg. 94 (4), 279-285 (2005).
- Kocsis, J. D., Tessler, A. Pathology of blast-related brain injury. J Rehabil Res Dev. 46 (6), 667-671 (2009).
- Bass, C. R., et al. Brain Injuries from Blast. Ann Biomed Eng. 40 (1), 185-202 (2012).
- Cernak, I., Kobeissy, F. H. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Alfieri, K. A., Forsberg, J. A., Potter, B. K. Blast injuries and heterotopic ossification. Bone Joint Res. 1 (8), 174-179 (2012).
- Potter, B. K., Burns, T. C., Lacap, A. P., Granville, R. R., Gajewski, D. A. Heterotopic Ossification Following Traumatic and Combat-Related Amputations. Prevalence, Risk Factors, and Preliminary Results of Excision. J Bone Joint Surg Am. 89 (3), 476-486 (2007).
- Sasser, S. M., Sattin, R. W., Hunt, R. C., Krohmer, J. Blast Lung Injury. Prehosp Emerg Care. 10 (2), 165-172 (2006).
- Cho, S. -. I., et al. Mechanisms of Hearing Loss after Blast Injury to the Ear. PLoS ONE. 8 (7), 67618 (2013).
- Bull, M. A., Clasper, J., Mahoney, P. . Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. , (2016).
- Arun, P., et al. Studies on blast traumatic brain injury using in-vitro model with shock tube. Neuroreport. 22 (8), 379-384 (2011).
- Ahlers, S. T., et al. Assessment of the effects of acute and repeated exposure to blast overpressure in rodents: toward a greater understanding of blast and the potential ramifications for injury in humans exposed to blast. Front Neurol. 3, 32 (2012).
- Polfer, E. M., et al. The development of a rat model to investigate the formation of blast-related post-traumatic heterotopic ossification. Bone Joint J. 97 (4), 572-576 (2015).
- Miller, A. P., et al. Effects of Blast Overpressure on Neurons and Glial Cells in Rat Organotypic Hippocampal Slice Cultures. Front Neurol. 6, 20 (2015).
- Chandra, N., et al. Evolution of blast wave profiles in simulated air blasts: experiment and computational modeling. Shock Waves. 22 (5), 403-415 (2012).
- Kuriakose, M., et al. Tailoring the Blast Exposure Conditions in the Shock Tube for Generating Pure, Primary Shock Waves: The End Plate Facilitates Elimination of Secondary Loading of the Specimen. PLoS ONE. 11 (9), 0161597 (2016).
- Reneer, D. V., et al. A Multi-Mode Shock Tube for Investigation of Blast-Induced Traumatic Brain Injury. J Neurotrauma. 28 (1), 95-104 (2011).
- VandeVord, P. J., et al. Up-regulation of reactivity and survival genes in astrocytes after exposure to short duration overpressure. Neurosci Lett. 434 (3), 247-252 (2008).
- Kane, M. J., et al. Altered gene expression in cultured microglia in response to simulated blast overpressure: Possible role of pulse duration. Neurosci Lett. 522 (1), 47-51 (2012).
- Nienaber, M., Lee, J. S., Feng, R., Lim, J. Y. Impulsive pressurization of neuronal cells for traumatic brain injury study. J Vis Exp. (56), (2011).
- Zhang, J., et al. Transcriptional Profiling in Rat Hair Follicles following Simulated Blast Insult: A New Diagnostic Tool for Traumatic Brain Injury. PLoS ONE. 9 (8), 104518 (2014).
- Bo, C., et al. Cellular characterization of compression-induceddamage in live biological samples. AIP Conf Proc. 1426 (1), 153-156 (2012).
- Tannous, O., Griffith, C., O’Toole, R. V., Pellegrini, V. D. Heterotopic ossification after extremity blast amputation in a Sprague-Dawley rat animal model. J Orthop Trauma. 25 (8), 506-510 (2011).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-Vitro Approaches for Studying Blast-Induced Traumatic Brain Injury. J Neurotrauma. 26 (6), 861-876 (2009).
- Nguyen, T. T. N., Wilgeroth, J. M., Proud, W. G. Controlling blast wave generation in a shock tube for biological applications. JPCS. 500 (14), 142025 (2014).

