تقييم في وقت واحد Cardiomyocyte الحمض النووي تحضير والصيغة الصبغية: طريقة لمساعدة الكمي لCardiomyocyte التجديد ودوران
Summary
Quantification of cardiomyocyte turnover is challenging. The protocol described here makes an important contribution to this challenge by enabling accurate and sensitive quantification of neo-cardiomyocyte nuclei generation and nuclei ploidy.
Abstract
على الرغم من أن من المسلم به أن القلب لديها امكانات محدودة لتجديد العضلية بسبب الإصابة بجانب أن انخفاض مستويات دوران cardiomyocyte تحدث أثناء الشيخوخة الطبيعية، وتحديد حجم هذه الأحداث لا يزال تحديا. هذا ويرجع ذلك جزئيا إلى ندرة هذه العملية وحقيقة أن مصادر الخلوية متعددة تساهم في صيانة عضلة القلب. وعلاوة على ذلك، ازدواجية الحمض النووي داخل العضلية وغالبا ما يؤدي إلى cardiomyocyte المتعددة الصبغيات ونادرا ما يؤدي إلى العضلية الجديدة عن طريق الانقسام الخلوي. من أجل تحديد بدقة التمييز دوران cardiomyocyte بين هذه العمليات أمر ضروري. بروتوكول الموصوفة هنا يستخدم العلامات نوكليوزيد على المدى الطويل من أجل تسمية كل نوى التي نشأت نتيجة لنوى تكرار الحمض النووي وcardiomyocyte التي تم تحديدها من خلال الاستفادة من العزلة النوى وimmunolabeling PCM1 لاحق. معا وهذا يسمح بتحديد دقيق وحساس من وضع العلامات نوكليوزيد من جardiomyocyte السكان أنويتها. وعلاوة على ذلك، 4 "، ووضع العلامات وتحليل الصيغة الصبغية أنويتها 6 diamidino-2-phenylindole، يمكن التمييز نوى الجدد cardiomyocyte من نوى التي أدرجت نوكليوزيد خلال polyploidization. على الرغم من أن هذه الطريقة لا يمكن السيطرة على ازدواجية النواة cardiomyocyte، لأنها تتيح الكمي السريع والقوي من نوى الجدد cardiomyocyte بينما يمثل polyploidization. هذا الأسلوب لديه عدد من التطبيقات المصب بما في ذلك تقييم العلاجات المحتملة لتعزيز تجديد cardiomyocyte أو التحقيق في آثار أمراض القلب على دوران cardiomyocyte والصيغة الصبغية. هذا الأسلوب هو أيضا متوافقة مع تقنيات immunohistological المصب إضافية، مما يسمح الكمي التأسيس نوكليوزيد في جميع أنواع الخلايا في القلب.
Introduction
في السنوات الأخيرة كان هناك تراكم الأدلة تتحدى الافتراض بأن القلب هو متباينة عضال، بعد الإنقسامية الجهاز 1،2. ومع ذلك، وتحديد حجم دوران cardiomyocyte وتجديد يبقى تحديا.
وذكرت الصعوبات في تحديد بدقة الجيل cardiomyocyte نادر باستخدام تقنيات المناعى القياسية أيضا 3. وبالإضافة إلى ذلك، فإن مصدر الخلوية من الجيل cardiomyocyte لا يزال غير مؤكد مع الدليل على مساهمات من انتشار cardiomyocyte فضلا عن الخلايا الجذعية التمايز 4-6. ولذلك، فإن استخدام نماذج النسب تتبع التي تتطلب معرفة النمط الظاهري cardiomyocyte السلف مستحيل وتقدير الانتشار في عدد السكان واحد، بما في ذلك العضلية، غير مناسب. وعلاوة على ذلك لcardiomyocyte ديه القدرة على endoreplication دون الحرائك النووية (مما أدى إلى السيارة المتعددة الصبغياتdiomyocyte) أو الحرائك النووية في غياب الانقسام السيتوبلازمي (مما أدى إلى cardiomyocyte binucleated) 7،8. والتقدير الدقيق دوران cardiomyocyte يعتمد على القدرة على التمييز بين هذه الأحداث وجيل صحيح الجدد cardiomyocyte. وهذا يخلق تعقيدات فريدة من نوعها لتكرار الحمض النووي والتعبير عن تحركات تعتمد على السيكلين في العضلية لا تظهر على وجه الحصر انقسام الخلايا الحقيقية 9،10.
للمساعدة في القياس الكمي للجيل الجدد cardiomyocyte، جمعنا بين تقنية أنشئت العزلة نوى، ووضع العلامات المناعي من المواد محيط بالمريكز 1 (PCM1) لتحديد نوى cardiomyocyte كما وصفها برغمان وآخرون 7،11 مع طرق جديدة للالمدى الطويل وضع العلامات الحمض النووي وتحليل الصيغة الصبغية. PCM-1 هو بروتين الجسيم المركزي التي تتراكم على سطح النووي متباينة، myocytes غير ركوب الدراجات. وقد أظهرت دراسات سابقة أن الأجسام المضادة ضدPCM-1 تسمية تحديدا نوى cardiomyocyte 7،11 وكما تم استخدام هذا PCM1 من قبل عدد من جماعات مستقلة لتحديد العضلية 1،12،13. وبالإضافة إلى ذلك، لقد أثبتنا أن PCM1 التعبير خرائط لنوى cardiomyocyte المسمى وراثيا في نموذج لجنة المساواة العرقية تي ان تي المعدلة وراثيا الماوس 14 (الشكل التكميلي 1).
بروتوكول صفها هنا يمكن تحديد دقيق وحساس من جيل cardiomyocyte نوى الجدد في قلب فأر، بغض النظر عن أصول الخلوية (الشكل 1A و B) مع استبعاد في نفس الوقت وضع العلامات نوكليوزيد بسبب polyploidization من التحليل (الشكل 1C و D). على الرغم من أن هذه الطريقة لا يمكن السيطرة على ازدواجية النواة cardiomyocyte، لأنها تتيح الكمي السريع والقوي من نوى الجدد cardiomyocyte وهو مطلوب لتقدير دقيق لدوران cardiomyocyte. علاوة على ذلك،أنه يوفر أداة الفرز السريع لتقييم التغيرات المحتملة في ديناميات الجيل cardiomyocyte.
في حين وصفها الحمض النووي وعادة ما ينطوي 5-برومو-2'-deoxyuridine (BrdU) كما التناظرية ثيميدين، وبروتوكول الموصوفة هنا يستخدم فحص 5-إيثينيل-2'-deoxyuridine (EDU) استنادا لأنه يتطلب خطوات المعالجة أقل لأسرع من خلال-وضع ولا يتطلب تغيير طبيعة الحمض النووي للالمناعية الكشف، مما يجعلها متوافقة مع بروتوكولات المناعية الأخرى، وبالتالي زيادة التطبيقات المصب المحتملة لهذه الطريقة.
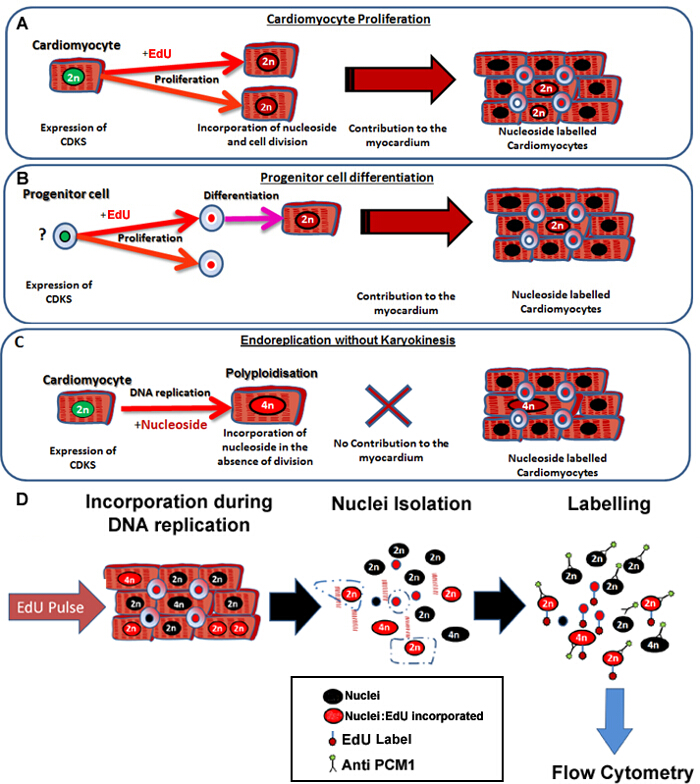
الشكل 1: ينبض المستمر مع ايدو تسميات الجدد العضلية بغض النظر عن الأسلاف الخاصة بهم. أدرج (A) EDU في الحمض النووي العضلية أثناء انقسام الخلية. وانتشار بين السكان cardiomyocyte بالنتيجهتي في زيادة أو استبدال الخلايا العضلية وهو توليف الحمض النووي وبالتالي إنتاجية (يساهم في صيانة الأنسجة وإصلاح). أدرج (ب) EDU في الحمض النووي للخلايا السلف القلب أثناء انقسام الخلية. سيتم الاحتفاظ هذا في الخلية خلال التمايز إلى النسب cardiomyocyte. وهذا تمايز الخلايا الجذعية يؤدي أيضا إلى زيادة في عدد الخلايا العضلية، وبالتالي يساهم في صيانة الأنسجة والإصلاح. (C) العضلية لديها القدرة على الخضوع لتكرار الحمض النووي "غير منتجة" مما أدى إلى زيادة الصيغة الصبغية cardiomyocyte، الذي يرتبط مع تضخم cardiomyocyte وإعادة عضلة القلب، ولكن لا يحل محل العضلية المفقودة. عملية polyploidization تختلف عن ازدواجية النواة كما أنه يؤدي إلى cardiomyocyte مع نواة واحدة والذي يحتوي على أربعة أو أكثر من مجموعات من اثنين من الكروموزومات المتماثلة (> 2N). (D) وبعد نوى ص المستمرulse، يصف هذا البروتوكول العزلة النوى وتحديد نوى cardiomyocyte من التعبير PCM1 للسماح الكمي لكلا الصيغة الصبغية cardiomyocyte وايدو التأسيس. PCM1 التعبير وايدو التأسيس الكشف باستخدام التدفق الخلوي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
لتحديد بدقة دوران cardiomyocyte ويجب أن المقايسات تجديد تميز بين جيل cardiomyocyte صحيح والانقسام الحمض النووي غير منتجة. لا تزال العديد من الدراسات ببساطة تجاهل هذه الأحداث غير منتجة، قياس انتشار cardiomyocyte فقط عن طريق التعبير عن الحركية عند السيكلين وعلامات دورة الخلية. حتى الآن أسلوب واحد الذي يسمح للتقدير دقيق لدوران cardiomyocyte في حين السيطرة على هذه الأحداث غير منتجة يبقى ملمح. وعلى وجه الخصوص ما زال من الصعب حساب لpolyploidization cardiomyocyte الذي يسهم تصل الى ~ 65٪ من cardiomyocyte تكرار الحمض النووي (13). لذلك للمساعدة في تقدير دقيق للجيل cardiomyocyte قمنا بتطوير البروتوكول الذي يسمح الكمي القوي لمعدلات نوى cardiomyocyte الجدد مع استبعاد تكرار الحمض النووي أن يؤدي إلى زيادة الصيغة الصبغية. على الرغم من أن هذا البروتوكول لا يمكن التمييز بين الأجناس الجدد cardiomyocyteنشوئها وcardiomyocyte ثنائية التنوي، ويمكن استخدامه بسرعة وبدقة حساب الجزء العلوي من الحد (المحاسبة عن الصيغة الصبغية) من الجيل cardiomyocyte. وبالتالي يوفر هذا البروتوكول أداة فحص لتقييم التغيرات المحتملة في معدلات توليد cardiomyocyte وpolyploidization في نماذج المرض أو لتقييم كفاءة المحتملة من العلاجات. مرة واحدة يتم تحديد التغيرات في معدل توليد أنويتها الجدد cardiomyocyte باستخدام هذا البروتوكول دراسات لاحقة يمكن أن تستخدم للتأكد ما إذا كان هذا نتيجة للتغيرات في الجيل cardiomyocyte عدد cardiomyocyte التنوي، كما هو موضح سابقا 2،13،17،18. وتشمل هذه استخدام النسيجية ديناميات التنوي الكمي cardiomyocyte خلال الفترة النبض أو تحليلات أقسام الأنسجة التي تم الحصول عليها من ايدو الحيوانات نابض في لمقارنة EDU التأسيس في السكان cardiomyocyte mononucleated ومتعددة النوى.
ويرجع ذلك إلى انخفاض مستويات دوران cardiomyocyte هذايستخدم بروتوكول الحقن متعددة من ايدو على مدى 7 أيام. وهذا يسمح أيضا "مطاردة" من جميع المصادر المحتملة الخلوية من الجيل cardiomyocyte ويسمح الكمي من الجيل cardiomyocyte نوى التراكمي خلال هذه الفترة الزمنية. اعتمادا على هذه الدراسة، يمكن تعديل هذا الإطار الزمني لتتناسب مع المستويات المتوقعة من الجيل cardiomyocyte. لتقدير دقيق لايدو التأسيس في نوى cardiomyocyte، لا بد من أن ليس هناك وسم غير محدد من النوى مع الأجسام المضادة الثانوية تستخدم لكشف PCM-1 التفاعل. وبالتالي سيكون من الحكمة لإجراء التجارب الأجسام المضادة المعايرة الثانوية إضافية من أجل تحسين هذا الجانب من البروتوكول، لا سيما إذا كان الضد الثانوية غير أن اقترح في هذا البروتوكول هو لاستخدامها. بروتوكول الموصوفة هنا يستخدم PCM-1 التعبير لتحديد نوى cardiomyocyte. في حين أن هذا هو علامة cardiomyocyte المعمول بها، علامات بديلة يمكن استخدامها للتحقق من صحةالبيانات؛ وتشمل هذه الأجسام المضادة المحددة للالقلب تروبونين تي والتي تم تحديدها على أنها مترجمة جزئيا في نوى cardiomyocyte 1. وبالمثل، يمكن استخدام البروتينات المترجمة النووية بديلة لتحديد وقياس EDU التأسيس في السكان أنويتها غير ذلك من العضلية. من المهم أن كل نواة cardiomyocyte التي تشهد بنشاط الانقسام مستثناة من التحليل، ومصير هذه توليف الحمض النووي غير معروف ويمكن أن يؤدي في أي انقسام الخلية أو زيادة الصيغة الصبغية. تم تفكيكها PCM1 خلال المرحلة M من دورة الخلية وبالتالي العضلية تمر الانقسام لن يتم تحديدها من قبل التعبير PCM1. وبالإضافة إلى ذلك، ينبغي أن تستبعد كل نواة في مرحلة من مراحل دورة الخلية من تحليل لاحقة. ويمكن تحقيق ذلك عن طريق المعزولة من جميع نوى مع كثافة دابي فوق السكان 2N بما في ذلك تلك التي لديها كثافة دابي بين 2N و4N السكان.
على الرغم من أنها على نحو متزايدقبلت أن القلب لديه القدرة على استبدال العضلية أثناء الشيخوخة الطبيعية، وبعد الإصابة الحادة، ويبقى مصدر ودرجة هذه الإمكانات المثير للجدل. وبالإضافة إلى ذلك، تم الإبلاغ عن معدلات متباينة من دوران cardiomyocyte 1،7،20-22. قد يكون هذا ويرجع ذلك جزئيا إلى الصعوبات في تحديد بدقة وقياس الجدد cardiomyocyte جيل 19. حتى الآن غالبية الدراسات اعتمدوا فقط على استخدام التحليل النسيجي وتحديد العضلية عن طريق التعبير عن بروتينات حشوية، بما في ذلك البروتينات من قسيم عضلي، لتقدير حجم دوران cardiomyocyte وتجديد 2،4،23،24. استخدام هذه الأساليب للكشف عن التعبير عن علامات انتشار الأسلحة النووية، أو كما هو موضح هنا، وإدماج نظائرها ثيميدين يمكن أن يؤدي بسهولة في عدم التعرف على أنواع الخلايا القلبية الأخرى العضلية. في حين أن استخدام التصوير متحد البؤر 3D يمكن أن يساعد على التخفيف من حدة هذه المشاكل عشرطرق جنوب شرقي مكلفة وتستغرق وقتا طويلا. ومن المثير للاهتمام، وبروتوكول الموصوفة هنا يوضح يحدث جيل أنويتها الجدد cardiomyocyte بمعدل 0.17٪ في الأسبوع. وهذا يتفق مع تدفق الآخر الخلوي الدراسات التي تعتمد إظهار معدلات دوران أسبوعية تصل إلى 0.13٪ 5. على الرغم من أنه من المغري لاستقراء معدلات دوران السنوية بناء على هذه البيانات، كما هو الحال في الدراسات السابقة 2،5،25،26، وهذا هو صورة غير ملائمة معدلات دوران ديناميكية خلال فترة حياة الحيوان (13).
هذا الأسلوب لديه عدد من التطبيقات المحتملة بما في ذلك تقييم العلاجات المحتملة لتعزيز تجديد cardiomyocyte أو التحقيق في آثار أمراض القلب على دوران cardiomyocyte ومعدلات polyploidization cardiomyocyte.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the British Heart Foundation, project grant PG/13/69/30454.
Materials
| 0.32 M sucrose | Sigma | 84100 | |
| 10 mM Tris-HCl (pH = 8) | Sigma | T3253 | |
| 5 mM CaCl2 | Sigma | c5086 | |
| 5 mM magnesium acetate | sigma | M-5661 | |
| 2.0 mM EDTA | Sigma | E5134 | |
| 0.5 mM EGTA | Sigma | 63779 | |
| 1 mM DTT | Sigma | D0632 | |
| 70 mM KCl | Sigma | P9541 | |
| 10 mM MgCl2 | Sigma | M8266 | |
| 1.5 mM spermine | Sigma | 85590 | |
| Isotype rabbit IgG- ChIP Grade | abcam | abc7415 | |
| Rabbit anti-PCM-1 antibody | Sigma | HPA023374 | |
| Alexa Fluor 488 F(ab')2 Fragment of Goat Anti-Rabbit IgG (H+L) Antibody | Life technologies | A-11070 | |
| cell strainers 70 μm and 100μm | Fisher scientific | 11597522, 11517532 | |
| Glass dounce (40 ml) and pestle large clearance | Sigma | D9188-1SET | |
| EdU (5-ethynyl-2’-deoxyuridine) | Life technologies | A10044 | |
| Click-iT Plus EdU Alexa Fluor 647 Flow Cytometry Assay Kit | Life technologies | C10634 | This kit inlcudes reagents required for section, EdU reaction buffer, EdU fixative, saponin-based permeabilization solution and the reagents required for the EdU labelling cocktail. |
| CyStain DNA 2 step kit, | Sysmex Partec | 05 5005 | This kit inlcudes reagents required for DAPI labelling (DNA staining solution) |
| Probe homogeniser e.g. TissueRuptor | Qiagen | 9001273 | |
| TissueRuptor Disposable Probes | Qiagen | 990890 | |
| ultracentrifuge | Sorvall | ||
| Facscanto II | BD Biosciences | ||
| Ultracentrifuge Tube, Thinwall, Polypropylene. 38.5 mL, 25 x 89 mm | Beckman Coulter | 326823 | |
| Bovine serum albumin | Sigma | A2153 |
References
- Bergmann, O., et al. Evidence for cardiomyocyte renewal in humans. Science. 324, 98-102 (2009).
- Senyo, S. E., et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 493, 433-436 (2013).
- Soonpaa, M. H., Rubart, M., Field, L. J. Challenges measuring cardiomyocyte renewal. Biochim Biophys Acta. 1833, 799-803 (2013).
- Loffredo, F. S., Steinhauser, M. L., Gannon, J., Lee, R. T. Bone marrow-derived cell therapy stimulates endogenous cardiomyocyte progenitors and promotes cardiac repair. Cell Stem Cell. 8, 389-398 (2011).
- Malliaras, K., et al. Cardiomyocyte proliferation and progenitor cell recruitment underlie therapeutic regeneration after myocardial infarction in the adult mouse heart. EMBO Mol Med. 5, 191-209 (2013).
- Hsieh, P. C., et al. Evidence from a genetic fate-mapping study that stem cells refresh adult mammalian cardiomyocytes after injury. Nat Med. 13, 970-974 (2007).
- Bergmann, O., et al. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Exp Cell Res. 317, 188-194 (2011).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovasc Res. 36, 45-51 (1997).
- Scholzen, T., Gerdes, J. The Ki-67 protein: from the known and the unknown. J Cell Physiol. 182, 311-322 (2000).
- Carmena, M., Earnshaw, W. C. The cellular geography of aurora kinases. Nat Rev Mol Cell Biol. 4, 842-854 (2003).
- Bergmann, O., Jovinge, S. Isolation of Cardiomyocyte Nuclei from Post-mortem Tissue. J. Vis. Exp. , e4205 (2012).
- Gilsbach, R., et al. Dynamic DNA methylation orchestrates cardiomyocyte development, maturation and disease. Nat Commun. 5, 5288 (2014).
- Richardson, G., Laval, S., Owens, W. A. Cardiomyocyte regeneration in the mdx mouse model of non-ischemic cardiomyopathy. Stem Cells Dev. , (2015).
- Jiao, K., et al. An essential role of Bmp4 in the atrioventricular septation of the mouse heart. Genes Dev. 17, 2362-2367 (2003).
- Bergmann, O., et al. Cardiomyocyte renewal in humans. Circ Res. 110, e17-e18 (2012).
- Prigge, J. R., et al. Nuclear double-fluorescent reporter for in vivo and ex vivo analyses of biological transitions in mouse nuclei. Mamm Genome. , (2013).
- Naqvi, N., et al. A proliferative burst during preadolescence establishes the final cardiomyocyte number. Cell. 157, 795-807 (2014).
- Liu, Z., Yue, S., Chen, X., Kubin, T., Braun, T. Regulation of cardiomyocyte polyploidy and multinucleation by CyclinG1. Circ Res. 106, 1498-1506 (2010).
- Ang, K. L., et al. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. Am J Physiol Cell Physiol. 298, C1603-C1609 (2010).
- Kajstura, J., et al. Myocyte turnover in the aging human heart. Circ Res. 107, 1374-1386 (2010).
- Kajstura, J., et al. Cardiomyogenesis in the adult human heart. Circ Res. 107, 305-315 (2010).
- Walsh, S., Ponten, A., Fleischmann, B. K., Jovinge, S. Cardiomyocyte cell cycle control and growth estimation in vivo–an analysis based on cardiomyocyte nuclei. Cardiovasc Res. 86, 365-373 (2010).
- Anversa, P., Leri, A., Kajstura, J. Cardiac regeneration. J Am Coll Cardiol. 47, 1769-1776 (2006).
- Gonzalez-Valdes, I., et al. Bmi1 limits dilated cardiomyopathy and heart failure by inhibiting cardiac senescence. Nat Commun. 6, 6473 (2015).
- Kimura, W., et al. Hypoxia fate mapping identifies cycling cardiomyocytes in the adult heart. Nature. 523, 226-230 (2015).
- Soonpaa, M. H., Field, L. J. Assessment of cardiomyocyte DNA synthesis in normal and injured adult mouse hearts. Am J Physiol. 272, H220-H226 (1997).

