La información estructural a partir de una sola molécula de FRET experimentos utilizando el Nano-posicionamiento Sistema Rápido
Summary
We present the setup and experimental procedure to obtain smFRET data from large donor-acceptor networks with a TIRF microscope. The step-by-step analysis of these measurements with the Bayesian inference software Fast-NPS yields high-resolved structural information via the application of adapted dye models.
Abstract
Single-molecule Förster Resonance Energy Transfer (smFRET) can be used to obtain structural information on biomolecular complexes in real-time. Thereby, multiple smFRET measurements are used to localize an unknown dye position inside a protein complex by means of trilateration. In order to obtain quantitative information, the Nano-Positioning System (NPS) uses probabilistic data analysis to combine structural information from X-ray crystallography with single-molecule fluorescence data to calculate not only the most probable position but the complete three-dimensional probability distribution, termed posterior, which indicates the experimental uncertainty. The concept was generalized for the analysis of smFRET networks containing numerous dye molecules. The latest version of NPS, Fast-NPS, features a new algorithm using Bayesian parameter estimation based on Markov Chain Monte Carlo sampling and parallel tempering that allows for the analysis of large smFRET networks in a comparably short time. Moreover, Fast-NPS allows the calculation of the posterior by choosing one of five different models for each dye, that account for the different spatial and orientational behavior exhibited by the dye molecules due to their local environment.
Here we present a detailed protocol for obtaining smFRET data and applying the Fast-NPS. We provide detailed instructions for the acquisition of the three input parameters of Fast-NPS: the smFRET values, as well as the quantum yield and anisotropy of the dye molecules. Recently, the NPS has been used to elucidate the architecture of an archaeal open promotor complex. This data is used to demonstrate the influence of the five different dye models on the posterior distribution.
Introduction
La determinación de la estructura de una biomolécula es un requisito clave para la comprensión de su función. Dos métodos bien establecidos para la determinación de la estructura son crio-microscopía electrónica y cristalografía de rayos X 1, 2. Hoy en día, ambos métodos proporcionan información estructural de alta resolución con una resolución hasta el nivel de angstrom. Estos dos métodos se han utilizado ampliamente para elucidar la estructura de las grandes biomoléculas tales como los complejos de proteínas. Aunque los métodos existentes constantemente se han mejorado a lo largo de las últimas décadas, la complejidad de las estructuras biológicas sigue planteando un desafío importante para la biología estructural, en particular cuando grandes complejos, dinámicos y transitorios son investigados 3.
Con el fin de estudiar la dinámica de complejos macromoleculares y la relación estructura-función en particular, las metodologías de una sola molécula tienen provided información útil 4. Se desarrollaron varias nuevas estrategias para afrontar de manera ortogonal en la adquisición de información estructural y dinámica. Ejemplos son altos AFM velocidad 5, 6 manipulación mecánica, fluorescencia localización microscopía 7, así como de una sola molécula de transferencia de energía de resonancia de Förster (smFRET) 8, 9. Desde muy temprano en FRET que se ha denominado una regla molecular, debido a la dependencia de la distancia en la escala de longitud de biomacromoléculas 10.
Una aplicación particularmente interesante de smFRET es utilizar la información de distancia obtenida a partir de mediciones smFRET para inferir información estructural 11, 12, 13, 14, 15 </sup>, 16, 17, 18, 19, 20, 21, 22, 23. Debido a la alta resolución temporal de smFRET, la posición de las partes móviles de una estructura de proteína puede ser localizada. Sin embargo, con el fin de extraer información cuantitativa a partir de datos smFRET importantes parámetros de corrección sobre las moléculas de colorante que determinarse durante la medición 24. Con estos factores de corrección, la eficiencia de FRET FRET E se puede calcular utilizando la fórmula
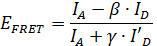 ,
,
en la que A y D I </sub> son las intensidades de fluorescencia del donador y la molécula aceptora, respectivamente (ver Figura 2). El β-factor de cuenta de la diafonía, la fuga de emisión del donante en el canal aceptor y se calcula

donde I 'A e I' d son las intensidades de fluorescencia del donador y la molécula aceptora después de la foto de blanqueo de la molécula aceptora.
El γ-factor de corrige la diferencia en las eficiencias de detección relativos en los dos canales, así como las diferencias en el rendimiento cuántico de fluorescencia del donante y el colorante aceptor. Se calcula a partir de cada curva del tiempo individual
<p class="jove_content" fo:keep-together.within-page="1" fo:text-align="center" style = "text-align: center;">
Nota, que esta descripción descuida excitación directa de la molécula aceptora, que a veces se vuelve importante y tendría que ser corregida para así. Para la determinación de estos factores de corrección es útil para excitar tanto para el donante, así como el aceptor en un esquema de alternancia 25 con el fin de diferenciar entre los cambios de foto-física y dinámica estructural.
Con el fin de no sólo lograr eficiencias smFRET cuantitativos, sino también información estructural cuantitativa, se introdujo el Sistema de Posicionamiento Nano-(NPS) en 2008 26. El nombre fue elegido en base a sus similitudes con el sistema de posicionamiento global por satélite (GPS). El NPS es una técnica híbrida que combina smFRET y datos de cristalografía de rayos X para la localización de las posiciones de tinte desconocidos en los complejos biomacromoleculares. La Cestructura rystal sirve como un marco de referencia y los resultados smFRET se utilizan para obtener información de la distancia entre una posición desconocida fluoróforo (antena) y una posición conocida de la estructura cristalina (satélite). En experimentos consecutivos de las distancias entre la antena y varios satélites se miden y la posición de la antena se determina por medio de un esquema de análisis estadísticamente rigurosa basada en la estimación de parámetros Bayesiano. Como resultado, no sólo la posición más probable de la antena se calcula, pero su distribución de la incertidumbre en 3D completa, la llamada posterior, visualizado por volúmenes creíbles. Por otra parte, fuentes de energía nuclear fue ampliado para permitir el análisis de redes completas smFRET 27.
El NPS se ha utilizado para resolver una serie de cuestiones importantes de la transcripción eucariótica, es decir, el curso de la DNA aguas arriba, el ADN no molde y el ARNm naciente dentro de la elongación co RNA polimerasa IImplex 12, 28, demuestra también el efecto de los factores de transcripción iniciación 26 y la arquitectura dinámica de un promotor-abierta compleja 29. Además, el NPS se utilizó para elucidar la estructura de la archaeal complejo abierto ARN polimerasa 30 y, en particular, la posición del factor de iniciación de la transcripción TFE, que se une competitivamente al mismo sitio como el factor de elongación de la transcripción SPT4 / 5 31.
Desde entonces, una serie de enfoques estructurales basados smFRET se han publicado 15, 18, 21, 23. Al comparar los diferentes métodos estructurales basados smFRET, se hace evidente que la aparente precisión del método depende de la elección particular de los modelos de colorantes altamente. Hay que señalar quemoléculas de colorante pueden mostrar un comportamiento espacial y de orientación diferente en función de su entorno local.
Con este fin, Fast-NPS se introdujo 32. Fast-NPS usa un algoritmo de muestreo avanzado reducir los tiempos de cálculo drásticamente. Por otra parte, Fast-NPS permite a uno realizar un análisis estructural y para cada molécula de colorante que el usuario puede elegir entre una serie de cinco modelos distintos de colorantes que se describirá a continuación. El modelo más conservador, denominado clásico, asume que el colorante ocupa sólo una, pero desconocida, posición. En esta posición, el fluoróforo puede girar libremente dentro de un cono, cuyo tamaño está determinado a partir de su respectivo anisotropía de fluorescencia (dependiente del tiempo). La orientación del cono no es conocida, lo que conduce a grandes incertidumbres al convertir eficiencias smFRET medidos en distancias. A este respecto, el modelo es conservadora, ya que conducirá a la precisión más pequeño en comparación con el otro modo de colorantels. Sólo para distancias muy cortas caso de que las suposiciones hechas por el modelo clásico de plomo a una determinación de la posición notoriamente incorrecto. Para valores típicos smFRET, la posición correcta se entrega siempre en el volumen comparativamente grande creíble.
Sin embargo, desde una precisión más alta es deseable, es importante desarrollar y probar modelos alternativos de colorantes, que podrían ayudar a mejorar la precisión. Si el colorante gira mucho más rápido que su tiempo de vida de fluorescencia inherente, el llamado modelo ISO se puede aplicar. Aquí, el factor de orientación kappa 2 (necesaria para el cálculo del radio de Förster característica isotrópica  ) Está ajustado a 2/3. Como resultado, los volúmenes creíbles calculadas son casi dos órdenes de magnitud más pequeña en comparación con aquellos en el modelo clásico de 32. En el caso de que el fluoróforo se encuentra en un entorno que permita no sólo reori rápidoentación, pero, además, el movimiento rápidamente en todo su volumen accesible, el modelo meanpos-iso debe ser utilizado. En este modelo, el tinte ocupa efectivamente sólo una posición media, en el que el promedio espacial se explica por una conversión distancia polinomio 15. Este modelo se aplica si, por ejemplo el colorante (comúnmente hidrófobo) se une a una región hidrófila, por ejemplo, el ADN. La aplicación del modelo meanpos-iso conduce a una reducción adicional en el tamaño de los volúmenes creíbles por un factor de aproximadamente dos. Sin embargo, un colorante unido a una proteína puede unirse de forma reversible a varios parches hidrófobos en su volumen estéricamente accesible (AV). Un fluoróforo que conmuta instantáneamente entre estas regiones, pero dentro de una región sufre una rotación libre y el movimiento localizada rápido es mejor descrita por el modelo VAR-meanpos-iso. Para una situación similar en la que el colorante no es libre de girar las var-meanpos aplica modelo. más d etails acerca de estos modelos se pueden encontrar en nuestra reciente publicación 32.
) Está ajustado a 2/3. Como resultado, los volúmenes creíbles calculadas son casi dos órdenes de magnitud más pequeña en comparación con aquellos en el modelo clásico de 32. En el caso de que el fluoróforo se encuentra en un entorno que permita no sólo reori rápidoentación, pero, además, el movimiento rápidamente en todo su volumen accesible, el modelo meanpos-iso debe ser utilizado. En este modelo, el tinte ocupa efectivamente sólo una posición media, en el que el promedio espacial se explica por una conversión distancia polinomio 15. Este modelo se aplica si, por ejemplo el colorante (comúnmente hidrófobo) se une a una región hidrófila, por ejemplo, el ADN. La aplicación del modelo meanpos-iso conduce a una reducción adicional en el tamaño de los volúmenes creíbles por un factor de aproximadamente dos. Sin embargo, un colorante unido a una proteína puede unirse de forma reversible a varios parches hidrófobos en su volumen estéricamente accesible (AV). Un fluoróforo que conmuta instantáneamente entre estas regiones, pero dentro de una región sufre una rotación libre y el movimiento localizada rápido es mejor descrita por el modelo VAR-meanpos-iso. Para una situación similar en la que el colorante no es libre de girar las var-meanpos aplica modelo. más d etails acerca de estos modelos se pueden encontrar en nuestra reciente publicación 32.
Estos modelos ofrecen un amplio repertorio para dar cuenta específicamente para los diferentes ambientes un tinte podría encontrar y aplicar de manera inteligente optimiza la precisión de localización. En Fast-NPS cada molécula de colorante unido a una posición específica se puede asignar a un modelo individual, de tal manera que FRET-socios se les permite tener diferentes modelos. Esto permite el modelado ilimitadas y cerca de la naturaleza. Sin embargo, es importante que uno realiza pruebas estadísticas rigurosas para asegurar que el resultado obtenido por la combinación final modelo es todavía de acuerdo con los datos experimentales. Estas pruebas están incluidas en el software Fast-NPS.
Para la aplicación de Fast-NPS a los datos experimentales se requiere la medición de (sólo) tres parámetros de entrada. En primer lugar, el tinte-par específico Förster isotrópica radios (/54782/54782eq5.jpg "/>) Se han determinado. Por lo tanto, el rendimiento cuántico (QY) del colorante donante, los espectros de emisión de fluorescencia del donante y el espectro de absorción del aceptor deben ser medidos. Estas mediciones pueden llevarse a cabo en granel, usando un espectrómetro estándar y un espectrómetro de fluorescencia estándar. Para cada par, la R 0 se calcula entonces utilizando la PhotochemCAD freeware y se puede utilizar en el análisis de NPS. Por otra parte, los (resuelta en el tiempo) anisotropías de fluorescencia de las moléculas de colorante necesitan ser obtenido usando una polarización (y tiempo) espectrómetro de fluorescencia sensible. Sin embargo, los parámetros de entrada más importantes para Fast-NPS son las eficiencias smFRET medidos en una configuración de microscopía de fluorescencia de una sola molécula, tales como un microscopio de fluorescencia de reflexión total interna (TIRFM) .
A continuación, presentamos un protocolo paso a paso para la obtención de datos y la aplicación de smFRET Fast-NPS (Figura 1).
Protocol
Representative Results
Discussion
Presentamos la configuración y experimental procedimiento para determinar con precisión la eficiencia de FRET entre los colorantes unidos a través de enlazadores flexibles a biomacromoléculas, es decir, ácidos nucleicos y / o proteínas.
Con el fin de asegurar mediciones precisas smFRET (Sección 3), es crucial para excluir el aire de la cámara de flujo en cualquier momento durante la medición. Además, asegúrese de no sobrecargar la cámara de flujo con fluoróforos. Los fluoróforos deben estar claramente separados para asegurar el correcto análisis. Como pares smFRET, que no muestran la decoloración del donante tienen que ser excluidos del análisis, asegúrese de que> 80% de las moléculas en el campo de visión se blanquean al final de la película. Para dar cuenta de la falta de homogeneidad en la muestra de la β-factor y el γ-factor de, la corrección de los cross-talk y relativos eficiencias de detección del canal de donante y aceptor, respectivamente, se calculan para cada FRET emparejar individualmente.
<p class= "Jove_content"> Los ajustes de la cámara (tiempo de integración, la ganancia del multiplicador de electrones, la ganancia del preamplificador y de tipo de lectura se describe en la Sección 3.9) debe ajustarse a los valores que dan el mejor compromiso entre la relación señal a ruido, rango dinámico y el tiempo de resolución. Necesitan ser re-ajustado para diferentes experimentos o si se utiliza un hardware diferente. El número de marcos deben ser lo suficientemente alta para asegurar que la mayor parte del donante moléculas lejía dentro del tiempo de observación.Para las mediciones en el espectrómetro de fluorescencia (Secciones 7 a 9) un buen compromiso entre la intensidad de la señal y la resolución espectral de los datos registrados tiene que ser encontrado. Para este fin, las ranuras en la excitación y emisión vía del espectrómetro de fluorescencia tienen que ser adaptados depende del instrumento utilizado y de la concentración de la muestra.
Por otra parte, se presenta el método de análisis rápido de NPS para obtener información estructural de macrom transitoria o dinámicoMOLECULAR complejos. NPS se ha aplicado para revelar el camino de la cadena de ADN no plantilla y la posición de los factores de iniciación de la transcripción en el complejo abierto ARN polimerasa archaeal. El uso de la red de más de 60 diferentes medidas de distancia, puso de manifiesto que Fast-NPS, equipado con un motor de muestreo de reciente aplicación (Eilert, T., Beckers, M., Drechsler, F., y Michaelis, J. en preparación), reduce el tiempo necesario para el análisis de esta red smFRET complejo por ≈2 órdenes de magnitud, en comparación con el método de NPS mundial original de 27. La robustez del algoritmo se basa en un muestreador de Metropolis-dentro-Gibbs combinado con un esquema de templado paralelo. Fast-NPS muestra exacta reproducibilidad de los resultados de la red y es consistente con los resultados publicados anteriormente 30.
Existen varios métodos diferentes han sido publicados con el objetivo de inferir información estructural a partir de mediciones smFRET 11 </sarriba>, 12, 13, 14, 15, 16, 17, 18. Todos estos enfoques proporcionan sólo un modelo de tinte específico. Por lo tanto, colorantes, que no cumplen con las suposiciones hechas por el modelo respectivo, no se pueden utilizar o conducen a la información estructural falsa. Fast-NPS, por el contrario, permite seleccionar para cada molécula de colorante de un modelo diferente. Esto ayuda a explicar diferente comportamiento conformacional de ambos, la propia molécula de colorante, así como el enlazador utilizado para su fijación. El entorno molecular locales de la molécula de colorante, así como sus propiedades físicas se determinan qué modelo es el más adecuado.
Para la red smFRET analizado del complejo de iniciación archaeal, un supuesto isotrópica para todas las moléculas de colorante conduce a una disminución drástica in el tamaño de los volúmenes creíbles en comparación con el modelo clásico. En combinación con una posición dinámica promedio para todos tinte moléculas de la mediana de todos los tamaños de volúmenes creíbles (al 95%) se reduce a menos de 0,5 nm 3. Sin embargo, estos dientes posteriores molécula de colorante ya no responden con sus mediciones smFRET, lo que indica que los supuestos hechos de plomo a la información estructural falsa. En contraste, los posteriores determinados en el modelo clásico son consistentes con las eficiencias smFRET determinados.
A medida que la asunción de la posición isotrópico y / o dinámico con un promedio de todos los tintes presentar inconsistencias, Fast-NPS permite priores molécula de colorante en el que cada colorante se le puede asignar uno de los cinco modelos. Cada modelo utiliza el mismo volumen accesible. El algoritmo para el cálculo de las AV tinte hace varias suposiciones. Al principio, la forma espacial del fluoróforo se aproxima por una esfera. Por lo tanto, un diámetro teniendo en cuenta wid del fluoróforoTH, altura y grosor se deben utilizar (Sección 12). Además, la forma del enlazador se aproxima por una varilla flexible. Los valores presentados en la Sección 12 se calcularon para el colorante Alexa 647 unido a través de un enlazador 12-C. Hasta la fecha, no es posible determinar con precisión a priori qué modelo es el más adecuado, teniendo en cuenta una geometría experimental, y por lo tanto todos los modelos debe ser probado. En general, se elige el modelo que da el tamaño posterior más pequeña posible, sin dejar de ser consistente con los datos. Para probar si una selección de modelos es consistente con los datos smFRET, calculamos tanto la posterior y la probabilidad. La consistencia significa que más del 90% de las muestras recogidas de la posterior están dentro del intervalo de confianza del 95% de la probabilidad.
Si bien es cierto que cuanto más baja la anisotropía, menor será la incertidumbre distancia, en una red smFRET disposiciones geométricas de las moléculas de colorante también tienen que ser tomadas en cuenta. Así, mientras que rREPRESENTAN moléculas de colorante con una anisotropía baja fluorescencia con un modelo ISO es una primera opción típica, la prueba de consistencia proporciona un medio más directo para seleccionar el modelo de tinte correcto. La elección óptima de los modelos de colorante puede conducir a un aumento drástico en la precisión de localización y al mismo tiempo conservar la coherencia de la red con sus datos de FRET.
Para resumir, Fast-NPS permite obtener información estructural y dinámica de grandes complejos macromoleculares. En contraste con los métodos estructurales comunes tales como cristalografía de rayos x o microscopía electrónica de crio esto permite el seguimiento de los complejos altamente flexibles o transitorios, ampliando así en gran medida nuestra comprensión mecanicista de los procesos biológicos complejos.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank B. Gruchmann for the mechanical drawings of the flow chamber. Further, we want to express our gratitude to Max Beckers and Florian Drechsler for insightful comments and discussions regarding NPS and the underlying sampling engine.
Materials
| Flowchamber preparation | |||
| Customized metall sample holder | self-built | n/a | |
| quartz-glass slides, 76 x 26 mm | Technical Glass Products | 26007 | |
| coverslips, 60 x 24 mm | Marienfeld | 101242 | |
| detergent, Hellmanex II | Hellma | 320.001 | |
| ultra-pure water from Synergy UV | Millipore | 2512600 | |
| Zepto plasma cleaner | Diener | n/a | |
| (3-aminopropyl)-triethoxysilane, p.a. | Sigma-Aldrich | A3648 | |
| methoxy PEG-succinimidyl valerate, 5 kDa | Laysan Bio Inc. | MPEG-SVA-5000-1g | |
| biotinylated PEG-succinimidyl valerate, 5 kDa | Laysan Bio Inc. | BIOTIN-PEG-SVA-5000 | |
| Sodium biocarbonate | Sigma-Aldrich | S5761 Sigma | |
| Sodium carbonate | Sigma-Aldrich | S2127 Sigma-Aldrich | |
| sealing film (Nescofilm) | Fisher Scientific | 12981805 | |
| Tygon Flexible Silicone Tubing, 0.8 mm ID, 2.4 mm OD | Saint-Gobain Performance Plastics | 720958 | |
| Fine-Bore Polyethylene Tubing, 0.58 mm ID, 0.96 mm OD (Smiths Medical) | Fisher Scientific | 12665497 | |
| Neutravidin | Life Technologies | A2666 | |
| Name | Company | Catalog Number | Comments |
| Total internal reflection fluorescence microscope | |||
| Nd:YAG Laser, 532 nm | Newport Spectra-Physics | EXLSR-532-100-CDRH | |
| diode-pumped solid-state laser, 491 nm, Calypso | Cobolt | 904010050 | |
| diode laser 643 nm, iBeam smart | Toptica | iBEAM-SMART-640-S | |
| dichroic mirror, 532 RDC | Chroma | F33-540 | |
| dichroic mirror, 476 RDC | Chroma | F33-476z | |
| acousto-optic tunable filter | AA Opto-Electronic | AOTFnC-VIS | |
| plano-convex cylindrical lens, f = 75 mm | Thorlabs | LJ1703L1-A | |
| plano-concave cylindrical, f = -300 mm | Thorlabs | ||
| prism, PS 991 | Thorlabs | PS991 | |
| focussing lens, f = 75 mm | Thorlabs | LA1608-B | |
| syringe pump, PHD 2000 | Harvard Apparatus | 70-2002 | |
| 2 stepper motors, Z812B | Thorlabs | Z812B | |
| piezoelectric actuator, PE4 | Thorlabs | PE4 | |
| IR diode laser | Edmund Optics | CPS808 | part of the autofocus system |
| dichroic mirror, 775 DCXR | Chroma | 775 DCXR | |
| position-sensing detector (PSD), PDP90A | Thorlabs | PDP90A | part of the autofocus system |
| water-immersion objective, Plan Apo 60X WI, NA 1.2 | Nikon | MRD07601 | |
| dichroic mirror, 645 DCXR | Chroma | 645 DCXR | part of the emission pathway |
| emission filter, 3RD550-510 | Omega Optical | 3RD550-510 | green channel in the emission pathway |
| emission filter, 3RD660-760 | Omega Optical | 3RD660-760 | red channel in the emission pathway |
| EMCCD camera, iXon+ DU897EBV | Andor | AND-20-00032 | |
| EMCCD camera, iXon3 DU897D-BV | Andor | AND-20-000141 | |
| Name | Company | Catalog Number | Comments |
| Miscellaneous | |||
| Varian 50 | Cary | UV-VIS spectrometer | |
| Fluorolog2 | SPEX | fluorescence spectrometer | |
| Solis (V4.15) | Andor | control software for the EM-CCD camera | |
| Apt user utility (V1.022) | Thorlabs | control software for the piezo-motors | |
| Norland Optical Adhesive 68 | Thorlabs | adhesive | |
| PC-AFN-0.8 Nile red | Kisker Biotech | avidin-coated fluorescent multispec beads | |
| Matlab | Mathworks | technical computing language for custon written software | |
| Origin (V9.0) | Originlab | scientific graphing and data analysis software | |
| Hellma 105-202-15-40 | Hellma | 105-202-15-40 | absorption cuvette of 1 cm path length |
| Hellma 105-251-15-40 | Hellma | 105-251-15-40 | fluorescence cuvette with 3 mm path length |
References
- Cheng, Y. Single-Particle Cryo-EM at Crystallographic Resolution. Cell. 161, 450-457 (2015).
- Garman, E. F. Developments in X-ray Crystallographic Structure Determination of Biological Macromolecules. Science. 343 (6175), 1102-1108 (2014).
- Sali, A. Outcome of the First wwPDB Hybrid/Integrative Methods Task Force Workshop. Structure. 23, 1156-1167 (2015).
- Hopfner, K. P., Michaelis, J. Mechanisms of nucleic acid translocases: lessons from structural biology and single-molecule biophysics. Curr Opin Struct Biol. 17, 87-95 (2007).
- Ando, T., Uchihashi, T., Kodera, N. High-speed AFM and applications to biomolecular systems. Annu Rev Biophys. 42, 393-414 (2013).
- Neuman, K. K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5, 491-505 (2008).
- Yildiz, A. Myosin V walks hand-over-hand: single fluorophore imaging with 1.5-nm localization. Science. 300 (5628), 2061-2065 (2003).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. Advances in Single-Molecule Fluorescence Methods for Molecular Biology. Annu Rev Biochem. 77 (1), 51-76 (2008).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chem Soc Rev. 43 (4), 1156-1171 (2014).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proc Natl Acad Sci U S A. 58 (2), 719-726 (1967).
- Rasnik, I., Myong, S., Cheng, W., Lohman, T. M., Ha, T. DNA-binding Orientation and Domain Conformation of the E. coli Rep Helicase Monomer Bound to a Partial Duplex Junction: Single-molecule Studies of Fluorescently Labeled Enzymes. J Mol Biol. 336 (2), 395-408 (2004).
- Andrecka, J. Single-molecule tracking of mRNA exiting from RNA polymerase II. Proc Natl Acad Sci U S A. 105 (1), 135-140 (2008).
- Schröder, G. F., Grubmüller, H. FRETsg: Biomolecular structure model building from multiple FRET experiments. Comput Phys Commun. 158 (3), 150-157 (2004).
- Margittai, M. Single-molecule fluorescence resonance energy transfer reveals a dynamic equilibrium between closed and open conformations of syntaxin 1. Proc Natl Acad Sci U S A. 100 (26), 15516-15521 (2003).
- Kalinin, S. A toolkit and benchmark study for FRET-restrained high-precision structural modeling. Nat Methods. 9 (12), 1218-1227 (2012).
- Choi, J. N6-methyladenosine in mRNA disrupts tRNA selection and translation-elongation dynamics. Nat Struct Mol Biol. 23 (August 2015), 110-115 (2015).
- Svensson, B. FRET-based trilateration of probes bound within functional ryanodine receptors. Biophys J. 107 (9), 2037-2048 (2014).
- Stephenson, J. D., Kenyon, J. C., Symmons, M. F., Lever, A. M. L. Characterizing 3D RNA structure by single molecule FRET. Methods. (2016), 1-11 (2016).
- Lee, N. K. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophys J. 88 (4), 2939-2953 (2005).
- McCann, J. J., Choi, U. B., Zheng, L., Weninger, K., Bowen, M. E. Optimizing methods to recover absolute FRET efficiency from immobilized single molecules. Biophys J. 99 (3), 961-970 (2010).
- Brunger, A. T., Strop, P., Vrljic, M., Chu, S., Weninger, K. R. Three-dimensional molecular modeling with single molecule FRET. J Struct Biol. 173, 497-505 (2011).
- Schuler, B. Single-molecule FRET of protein structure and dynamics – a primer. J nanoboitechnology. 11, 1-17 (2013).
- Choi, U. B. Single-molecule FRET-derived model of the synaptotagmin 1-SNARE fusion complex. Nat Struct Mol Biol. 17 (3), 318-324 (2010).
- Dale, R. E., Eisinger, J., Blumberg, W. E. The orientational freedom of molecular probes. The orientation factor in intramolecular energy transfer. Biophys J. 26 (2), 161-193 (1979).
- Kapanidis, A. N. Alternating-laser excitation of single molecules. Acc Chem Res. 38 (7), 523-533 (2005).
- Muschielok, A. A nano-positioning system for macromolecular structural analysis. Nat Methods. 5 (11), 965-971 (2008).
- Muschielok, A., Michaelis, J. Application of the nano-positioning system to the analysis of fluorescence resonance energy transfer networks. J Phys Chem B. 115 (41), 11927-11937 (2011).
- Andrecka, J. Nano positioning system reveals the course of upstream and nontemplate DNA within the RNA polymerase ii elongation complex. Nucleic Acids Res. 37 (17), 5803-5809 (2009).
- Treutlein, B. Dynamic Architecture of a Minimal RNA Polymerase II Open Promoter Complex. Mol Cell. 46 (2), 136-146 (2012).
- Nagy, J. Complete architecture of the archaeal RNA polymerase open complex from single-molecule. FRET and NPS. Nat Commun. 6, 6161 (2015).
- Grohmann, D., et al. The Initiation Factor TFE and the Elongation Factor Spt4/5 Compete for the RNAP Clamp during Transcription Initiation and Elongation. Mol Cell. 43 (2), 263-274 (2011).
- Beckers, M., Drechsler, F., Eilert, T., Nagy, J., Michaelis, J. Quantitative structural information from single-molecule FRET. Faraday Discuss. 184, 117-129 (2015).
- Bennink, M. L. Unfolding individual nucleosomes by stretching single chromatin fibers with optical tweezers. Nat Struct Biol. 8 (7), 606-610 (2001).
- Chandradoss, S. D. Surface passivation for single-molecule protein studies. J Vis Exp. (86), e50549 (2014).
- Würth, C., Grabolle, M., Pauli, J., Spieles, M., Resch-Genger, U. Relative and absolute determination of fluorescence quantum yields of transparent samples. Nat Protoc. 8 (8), 1535-1550 (2013).
- Lakowicz, J. R. . Principles of Fluorescence Spectroscopy. , (2006).
- Korkhin, Y. Evolution of complex RNA polymerases: The complete archaeal RNA polymerase structure. PLoS Biol. 7 (5), (2009).

