إعداد عينة لتحليل المعلوماتية الحيوية لمثيلة الحمض النووي: استراتيجية جمعية السمنة ودراسات السمات ذات الصلة
Summary
تصف هذه الدراسة سير العمل لإدارة بيانات مثيلة الحمض النووي التي تم الحصول عليها بواسطة تقنيات microarray . يوضح البروتوكول الخطوات من إعداد العينات إلى تحليل البيانات. يتم وصف جميع الإجراءات بالتفصيل ، ويعرض الفيديو الخطوات المهمة.
Abstract
ترتبط السمنة ارتباطا مباشرا بنمط الحياة وقد ارتبطت بتغيرات مثيلة الحمض النووي التي قد تسبب تغيرات في عمليات تكوين الدهون وتخزين الدهون التي تسهم في تطور المرض. نحن نظهر بروتوكولا كاملا من الاختيار إلى تحليل البيانات اللاجينية للمرضى الذين يعانون من السمنة أو بدونها. تم اختبار جميع الخطوات من البروتوكول والتحقق من صحتها في دراسة تجريبية. شاركت 32 امرأة في الدراسة ، حيث تم تصنيف 15 شخصا يعانون من السمنة وفقا لمؤشر كتلة الجسم (BMI) (45.1 ± 5.4 كجم / م 2) ؛ وتم تصنيف 17 فردا بدون سمنة وفقا لمؤشر كتلة الجسم (22.6 ± 1.8 كجم / م 2). في المجموعة المصابة بالسمنة ، تم تحديد 564 موقعا من مواقع CpG المتعلقة بكتلة الدهون من خلال تحليل الانحدار الخطي. كانت مواقع CpG في مناطق المروجين. وجد التحليل التفاضلي 470 CpGs hypomethylated و 94 موقعا مفرط الميثيل في الأفراد الذين يعانون من السمنة. كانت المسارات الأكثر تخصيبا بنقص ميثيل في RUNX ، وإشارات WNT ، والاستجابة لنقص الأكسجة. كانت مسارات فرط الميثيل مرتبطة بإفراز الأنسولين ، وإشارات الجلوكاجون ، و Ca2 +. نستنتج أن البروتوكول حدد بشكل فعال أنماط مثيلة الحمض النووي ومثيلة الحمض النووي المرتبطة بالسمات. يمكن أن ترتبط هذه الأنماط بالتعبير الجيني المتغير ، مما يؤثر على تكوين الدهون وتخزين الدهون. أكدت نتائجنا أن نمط الحياة البدينة يمكن أن يعزز التغيرات اللاجينية في الحمض النووي البشري.
Introduction
تم استخدام تقنيات omics واسعة النطاق بشكل متزايد في دراسات الأمراض المزمنة. ميزة مثيرة للاهتمام لهذه الأساليب هي توافر كمية كبيرة من البيانات التي تم إنشاؤها للمجتمع العلمي. لذلك ، نشأ طلب على توحيد البروتوكولات للسماح بالمقارنة الفنية بين الدراسات. تقترح هذه الدراسة توحيد بروتوكول للحصول على بيانات مثيلة الحمض النووي وتحليلها ، باستخدام دراسة تجريبية كمثال مطبق.
يسود إنفاق الطاقة السلبي في أنماط الحياة البشرية الحديثة ، مما يؤدي إلى تراكم مفرط للأنسجة الدهنية ، وبالتالي تطور السمنة¹. أدت العديد من العوامل إلى زيادة معدلات السمنة ، مثل المستقرة ، والوجبات الغذائية عالية السعرات الحرارية ، والروتين المجهد. قدرت منظمة الصحة العالمية (WHO) أن 1.9 مليار بالغ يعانون من السمنة المفرطة في عام 2016 ، مما يعني أن أكثر من 20٪ من سكان العالم لديهم أكثر من 30 كجم / م 2 BMI2. كشف آخر تحديث لعام 2018 أن انتشار السمنة في الولايات المتحدة الأمريكية كان أعلى من 42٪ 3.
علم الوراثة اللاجينية هو التكيف الهيكلي للمناطق الكروموسومية لتسجيل حالات النشاط المتغيرة أو الإشارة إليها أو إدامتها4. مثيلة الحمض النووي هي تغيير كيميائي عكسي في مواقع ثنائي النوكليوتيدات السيتوزين – غوانوزين (مواقع CpG) ، وتشكيل 5-methylcytosine-pG (5mCpG). يمكنه تعديل التعبير الجيني عن طريق تنظيم وصول آلية النسخ إلى الحمض النووي5،6،7،8. في هذا السياق، من الضروري فهم مواقع CpG المرتبطة بالسمات المرتبطة بالسمنة9. يمكن للعديد من العوامل دعم أو منع مثيلة الحمض النووي الخاصة بالموقع. ويمكن للإنزيمات الضرورية لهذه العملية، مثل ميثيل ترانسفيراز الحمض النووي10 (DNTMs) وعشرة إلى أحد عشر عملية نقل (TETs)، أن تعزز مثيلة الحمض النووي أو إزالة الميثيل في ظل التعرض البيئي11.
بالنظر إلى الاهتمام المتزايد بدراسات مثيلة الحمض النووي على مدى السنوات الماضية ، كان اختيار استراتيجية التحليل الأكثر ملاءمة للإجابة بدقة على كل سؤال مصدر قلق أساسي للباحثين12،13،14. تعد مصفوفة مثيلة الحمض النووي 450K الطريقة الأكثر شيوعا ، وتستخدم في أكثر من 360 منشورا14 لتحديد ملف تعريف مثيلة الحمض النووي. يمكنه تحديد مثيلة ما يصل إلى 485000 CpGs الموجودة في 99٪ من الجينات المعروفة15. ومع ذلك ، تم إيقاف هذه الصفيف واستبدالها ب EPIC ، والتي تغطي مواقع 850,000 CpG. يمكن تطبيق البروتوكول الحالي على كل من 450K و EPIC16 و 17 و 18.
يتم عرض البروتوكول خطوة بخطوة في الشكل 1 ويشمل الخطوات التالية: اختيار السكان ، وأخذ العينات ، وإعداد التجارب ، وخط أنابيب مثيلة الحمض النووي ، وتحليل المعلوماتية الحيوية. يتم عرض دراسة تجريبية أجريت في مختبرنا هنا لتوضيح خطوات البروتوكول المقترح.
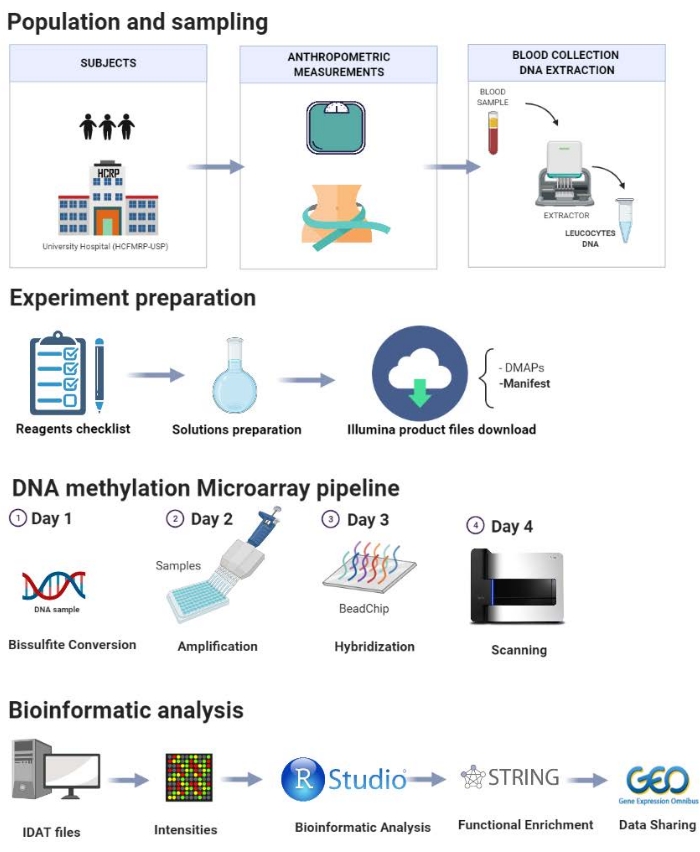
الشكل 1: مخطط البروتوكول المعروض. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
صفائف مثيلة الحمض النووي هي الطرق الأكثر استخداما للوصول إلى مثيلة الحمض النووي بسبب نسبة التكلفة إلى العائد14. وصفت هذه الدراسة بروتوكولا مفصلا باستخدام منصة microarray متاحة تجاريا لتقييم مثيلة الحمض النووي في دراسة تجريبية أجريت في مجموعة برازيلية. وأكدت النتائج التي تم الحصول عليها من الدراسة التجريبية فعالية البروتوكول. ويبين الشكل 3 قابلية العينة للمقارنة والتحويل الكامل للبيسلفيت32.
كخطوة لمراقبة الجودة ، أوصت خوارزمية ChAMP باستبعاد مواقع CpGs أثناء عملية التصفية. الهدف من استبعاد التحقيقات هو تحسين تحليل البيانات والقضاء على التحيز. تمت إزالة CpGs منخفضة الجودة (قيم p أقل من 0.05) للقضاء على الضوضاء التجريبية في مجموعة البيانات. ظلت الأهداف مرتازة في تحليل مخطط الكثافة. وصف Zhou33 أهمية تصفية CpGs بالقرب من SNPs لتجنب عدم التطابق ، وسوء تفسير مثيلة السيتوسيبين متعدد الأشكال ، والتسبب في تبديل لون تصميم المسبار من النوع الأول34. أيضا ، نظرا لأن كروموسومات XY تتأثر بشكل مختلف بالبصمة ، فقد عزز Heiss و Just35 أهمية تصفية هذه المجسات لأنه ، في الإناث ، قد تكون مشاكل التهجين عوامل مربكة 35.
يعتبر تاريخ انتهاء صلاحية DMAPs ، وتاريخ افتتاح الفورماميد ، والجودة التحليلية للإيثانول المطلق ، وإجمالي عدد الكريات البيض خطوات حاسمة في البروتوكول.
علاوة على ذلك ، وفقا لملاحظاتنا ، فإن تقدير نوع الخلية ضروري في إجراء تحليل المعلوماتية الحيوية. تقوم طريقة Houseman بإجراء تقدير نوع الخلية كما هو موضح في دراسة تيان 30. تعتمد هذه الطريقة على 473 موقعا محددا ل CpG يمكنها التنبؤ بالنسب المئوية لأهم أنواع الخلايا ، مثل الخلايا المحببة والخلايا الوحيدة والخلايا البائية والخلايا التائية36. استخدمنا الوظيفة الموصى بها “myRefbase” من حزمة ChAMP. بعد التقدير ، تقوم خوارزمية ChAMP بضبط قيم بيتا وإزالة هذا التحيز من مجموعة البيانات. هذه الخطوة حاسمة في الدراسات التي تركز على السمنة لأن هذه المجموعة لديها اختلاف كبير في خلايا الدم البيضاء بسبب حالتها الالتهابية المزمنة.
لقد غيرنا فقط خريطة الغطاء الأصلية لختم PCR الشائع فيما يتعلق بتعديل الطريقة واستكشاف الأخطاء وإصلاحها. بعد كل عملية طرد مركزي ، تم تغيير الختم لآخر جديد. لم نتمكن من استخدام الختم الحراري القياسي وتكييفه باستخدام رقائق الألومنيوم حول اللوحة.
على الرغم من أن الفحوصات التجارية قد اعتبرت معيارا ذهبيا للدراسات اللاجينية ، إلا أن أحد قيود البروتوكول يمكن أن يكون خصوصية الكواشف والمعدات من علامة تجارية فريدة من نوعها 37،38،39،40. وثمة قيد آخر يتمثل في عدم وجود مؤشرات تسمح بتحديد التقدم الصحيح للتجربة(41).
يمثل توحيد هذا البروتوكول دليلا رائعا للبحوث اللاجينية ، مما يقلل من الأخطاء البشرية أثناء العملية ويسمح بتحليل البيانات بنجاح وقابلية المقارنة بين الدراسات المختلفة.
وفقا لنتائجنا، فإن تجارب مثيلة الحمض النووي مناسبة للدراسات التي تقارن الأفراد الذين يعانون من السمنة وبدونها43. كما أن تحليل المعلوماتية الحيوية المقترح يوفر بيانات عالية الجودة ويمكن النظر فيه في الدراسات واسعة النطاق.
باستخدام تحليل SVD ، حددنا أن السمات المرتبطة بالسمنة (مؤشر كتلة الجسم ، WC ، و FM) أثرت على التباين في بيانات مثيلة الحمض النووي. ونتيجة لذلك، يشير تقدير نوع الخلية إلى أن كلا من الخلايا القاتلة الطبيعية (NK) والخلايا البائية كانت أعلى لدى النساء المصابات بالسمنة منها في النساء غير المصابات بالسمنة (الشكل 5). ويمكن تفسير ارتفاع عدد هذه الخلايا بالحالة الالتهابية المنخفضة الدرجة لهؤلاء الأفراد44. لاحظنا أن المرضى الذين يعانون من السمنة لديهم CpGs نقص وفرط ميثيل في المناطق المروجة للجينات المرتبطة بكتلة الدهون. كانت معظم المواقع هيبوميثيل ، والتي يمكن أن تكون مرتبطة بالزيادة الطبيعية في مستويات أنواع الأكسجين التفاعلية (ROS) في هؤلاء الأفراد. قد تعزز حالة الإجهاد التأكسدي هذه الغوانين perturbance في موقع ثنائي النوكليوتيد ، وتشكل 8-hydroxy-2′-deoxyguanosine (8-OHdG) ، مما يؤدي إلى موقع ثنائي النوكليوتيد 5mCp-8-OHdG ، ويسبب تجنيد إنزيمات. كل هذه الأحداث يمكن أن تكون مسؤولة عن تعزيز نقص ميثيل الحمض النووي وفرط المثيلة من خلال آليات عمل مختلفة45.
بالإضافة إلى ذلك ، يبدو أن معدل تكوين الدهون يزداد لدى الأفراد الذين يعانون من السمنة ، مع ما يقرب من 10 ٪ من الخلايا الجديدة إلى الخلايا القديمة46،47. يمكن للمساهمات اللاجينية، التي تؤكد على البيئة المسببة للسمنة، أن تغير معدلات انتشار الخلايا وتمايزها، مما يفضل تطور كتلة الدهون48. يمكن أن تؤثر التغيرات اللاجينية أيضا على البرامج الشحمية، مما يسهل أو يقيد تطورها. عوامل النسخ الأولية (PPARγ أو C / EBPα) أو تجميع مجمعات البروتينات المتعددة، المتمركزة في مناطق المروج النهائية التي تعمل عن طريق تضمين أو استبعاد الإنزيمات المعدلة فوق الجينية، تنظم التعبير الجيني من خلال فرط أو نقص الميثيل45. تم وصف مسار PPARγ سابقا لتغيير مسار WNT ، الذي كان يحتوي على جينات غنية في هذه الدراسة. على الرغم من أنه لا يزال من غير المعروف كيف تحدث إشارات WNT أثناء تكوين الدهون ، فقد ذكرت الدراسات الحديثة أنه قد يكون لها أدوار أساسية في استقلاب الخلايا الشحمية ، خاصة في ظل الظروف المسببة للسمنة49.
Disclosures
The authors have nothing to disclose.
Acknowledgements
نود أن نشكر يوان تيان ، دكتوراه (tian.yuan@ucl.ac.uk) لكونه متاحا للإجابة على جميع الشكوك حول حزمة ChAMP. ونشكر أيضا غيليرمي تيليس، السيدة على مساهمته في المسائل التقنية والعلمية الواردة في هذه الورقة؛ قدم اعتبارات مهمة فيما يتعلق بعلم الوراثة اللاجينية وتقنيات التقاط الفيديو وتنسيقه (guilherme.telles@usp.br). تمويل المواد الاستهلاكية: مؤسسة ساو باولو للأبحاث (FAPESP) (#2018/24069-3) والمجلس الوطني للتنمية العلمية والتكنولوجية (CNPq: #408292/2018-0). التمويل الشخصي: (FAPESP: #2014/16740-6) وبرنامج التميز الأكاديمي من التنسيق لتطوير موظفي التعليم العالي (CAPES:88882.180020/2018-01). سيتم إتاحة البيانات للجمهور ومجانا دون قيود. مراسلات العنوان إلى NYN (البريد الإلكتروني: nataliayumi@usp.br) أو CBN (البريد الإلكتروني: carla@fmrp.usp.br).
Materials
| Absolute ethanol | J.T. Baker | B5924-03 | |
| Agarose gel | Kasvi | K9-9100 | |
| Electric bioimpedance | Quantum BIA 450 Q – RJL System | ||
| Ethylenediaminetetraacetic acid (EDTA) | Corning | 46-000-CI | |
| EZ DNA Methylation-Gold kit | ZymoResearch, Irvine, CA, USA | D5001 | |
| Formamide | Sigma | F9037 | |
| FMS—Fragmentation solution | Illumina | 11203428 | Supplied Reagents |
| HumanMethylation450 BeadChip | Illumina | ||
| Maxwell Instrument | Promega, Brazil | AS4500 | |
| MA1—Multi-Sample Amplification 1 Mix | Illumina | 11202880 | Supplied Reagents |
| MicroAmp Optical Adhesive Film | Thermo Fisher Scientific | 201703982 | |
| MSM—Multi-Sample Amplification Master Mix | Illumina | 11203410 | Supplied Reagents |
| NaOH | F. MAIA | 114700 | |
| PB1—Reagent used to prepare BeadChips for hybridization | Illumina | 11291245 | Supplied Reagents |
| PB2—Humidifying buffer used during hybridization | Illumina | 11191130 | Supplied Reagents |
| 2-propanol | Emsure | 10,96,34,01,000 | |
| RA1—Resuspension, hybridization, and wash solution | Illumina | 11292441 | Supplied Reagents |
| RPM—Random Primer Mix | Illumina | 15010230 | Supplied Reagents |
| STM—Superior Two-Color Master Mix | Illumina | 11288046 | Supplied Reagents |
| TEM—Two-Color Extension Master Mix | Illumina | 11208309 | Supplied Reagents |
| Ultrapure EDTA | Invitrogen | 155576-028 | |
| 96-Well Reaction Plate with Barcode (0.1mL) | ByoSystems | 4346906 | |
| 96-Well Reaction Plate with Barcode (0.8mL) | Thermo Fisher Scientific | AB-0859 | |
| XC1—XStain BeadChip solution 1 | Illumina | 11208288 | Supplied Reagents |
| XC2—XStain BeadChip solution 2 | Illumina | 11208296 | Supplied Reagents |
| XC3—XStain BeadChip solution 3 | Illumina | 11208392 | Supplied Reagents |
| XC4—XStain BeadChip solution 4 | Illumina | 11208430 | Supplied Reagents |
References
- Manna, P., Jain, S. Obesity, oxidative stress, adipose tissue dysfunction, and the associated health risks: causes and therapeutic strategies. Metabolic Syndrome and Related Disorders. 13 (10), 423-444 (2015).
- . Obesity Available from: https://www.who.int/health-topics/obesity#tab=tab_1 (2017)
- Adult Obesity Facts. Center for Disease Control and Prevention Available from: https://www.cdc.gov/obesity/data/adult.html (2021)
- Bird, A. Perceptions of epigenetics. Nature. 396, (2007).
- Kouzarides, T. Chromatin modifications, and their function. Cell. 128 (4), 693-705 (2007).
- Berger, F. The strictest usage of the term epigenetic. Seminars in Cell & Developmental Biology. 19 (6), 525-526 (2008).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory, and gene regulation. Current Biology. 26 (14), 644-648 (2016).
- Laker, R. C., et al. Transcriptomic and epigenetic responses to short-term nutrient-exercise stress in humans. Scientific Reports. 7 (1), 1-12 (2017).
- Wahl, S., et al. Epigenome-wide association study of body mass index, and the adverse outcomes of adiposity. Nature. 541, 81-86 (2017).
- Jin, B., Robertson, K. D. DNA methyltransferases, DNA damage repair, and cancer. Epigenetic Alterations in Oncogenesis. 754, 3-29 (2013).
- Jang, H. S., Shin, W. J., Lee, J. E., Do, J. T. CpG and non-CpG methylation in epigenetic gene regulation and brain function. Genes. 8 (6), 148 (2017).
- Shen, L., Waterland, R. A. Methods of DNA methylation analysis. Current Opinion in Clinical Nutrition & Metabolic Care. 10 (5), 576-581 (2007).
- Olkhov-Mitsel, E., Bapat, B. Strategies for discovery and validation of methylated and hydroxymethylated DNA biomarkers. Cancer Medicine. 1, 237-260 (2012).
- Kurdyukov, S., Bullock, M. DNA methylation analysis: choosing the right method. Biology. 5 (1), 3 (2016).
- Yong, W. -. S., Hsu, F. -. M., Chen, P. -. Y. Profiling genome-wide DNA methylation. Epigenetics & Chromatin. 9 (1), 1-16 (2016).
- Dugué, P. A., et al. Alcohol consumption is associated with widespread changes in blood DNA methylation: Analysis of cross-sectional and longitudinal data. Addiction Biology. 1, 12855 (2021).
- Colicino, E., et al. Blood DNA methylation sites predict death risk in a longitudinal study of 12, 300 individuals. Aging. 14, 14092-14124 (2020).
- Karlsson, L., Barbaro, M., Ewing, E., Gomez-Cabrero, D., Lajic, S. Genome-wide investigation of DNA methylation in congenital adrenal hyperplasia. The Journal of Steroid Biochemistry and Molecular Biology. 201, 105699 (2020).
- Ribeiro, R. R., Guerra-Junior, G., de Azevedo Barros-Filho, A. Bone mass in schoolchildren in Brazil: the effect of racial miscegenation, pubertal stage, and socioeconomic differences. Journal of Bone and Mineral Metabolism. 27 (4), 494-501 (2009).
- Filozof, C., et al. Obesity prevalence and trends in Latin-American countries. Obesity Reviews. 2 (2), 99-106 (2001).
- Chadid, S., Kreger, B. E., Singer, M. R., Bradlee, M. L., Moore, L. L. Anthropometric measures of body fat and obesity-related cancer risk: sex-specific differences in Framingham Offspring Study adults. International Journal of Obesity. 44 (3), 601-608 (2020).
- Nicoletti, C. F., et al. DNA methylation pattern changes following a short-term hypocaloric diet in women with obesity. European Journal of Clinical Nutrition. 74 (9), 1345-1353 (2020).
- Assessing Your Weight. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/healthyweight/assessing/index.html (2020)
- Giavarina, D., Lippi, G. Blood venous sample collection: Recommendations overview and a checklist to improve quality. Clinical Biochemistry. 50 (10-11), 568-573 (2017).
- Duijs, F. E., Sijen, T. A rapid and efficient method for DNA extraction from bone powder. Forensic Science International: Reports. 2, 100099 (2020).
- . Infinium HD Methylation Assay, Manual Protocol Available from: https://support.illumina.com/content/dam/illumina-support/documents/documentation/chemistry_documentation/infinium_assays/infinium_hd_methylation/infinium-hd-methylation-guide-15019519-01.pdf (2015)
- Serrano, J., Snuderl, M. Whole genome DNA methylation analysis of human glioblastoma using Illumina BeadArrays. Glioblastoma. , 31-51 (2018).
- Leti, F., Llaci, L., Malenica, I., DiStefano, J. K. Methods for CpG methylation array profiling via bisulfite conversion. Disease Gene Identification. 1706, 233-254 (2018).
- Noble, A. J., et al. A validation of Illumina EPIC array system with bisulfite-based amplicon sequencing. PeerJ. 9, 10762 (2021).
- Tian, Y., et al. ChAMP: updated methylation analysis pipeline for Illumina BeadChips. Bioinformatics. 33, 3982-3984 (2017).
- Turinsky, A. L., et al. EpigenCentral: Portal for DNA methylation data analysis and classification in rare diseases. Human Mutation. 41 (10), 1722-1733 (2020).
- . The Chip Analysis Methylation Pipeline Available from: https://www.bioconductor.org/packages/release/bioc/vignettes/ChAMP/inst/doc/ChAMP.html (2020)
- Zhou, W., Laird, P. W., Shen, H. Comprehensive characterization, annotation and innovative use of Infinium DNA methylation BeadChip probes. Nucleic Acids Research. 45 (4), 22 (2017).
- Wanding, Z., Triche, T. J., Laird, P. W., Hui, S. SeSAMe: reducing artifactual detection of DNA methylation by Infinium BeadChips in genomic deletions. Nucleic Acids Research. 46 (20), 123 (2018).
- Heiss, J. A., Just, A. C. Improved filtering of DNA methylation microarray data by detection p values and its impact on downstream analyses. Clinical Epigenetics. 11, 15 (2019).
- Houseman, E. A., et al. DNA methylation arrays as surrogate measures of cell mixture distribution. BMC Bioinformatics. 13, 86 (2012).
- Valavanis, I., Sifakis, E. G., Georgiadis, P., Kyrtopoulos, S., Chatziioannou, A. A. A composite framework for the statistical analysis of epidemiological DNA methylation data with the Infinium human Methylation 450K BeadChip. IEEE Journal of Biomedical and Health Informatics. 18 (3), 817-823 (2014).
- Sun, N., Zhang, J., Zhang, C., Shi, Y., Zhao, B., Jiao, A., Chen, B. Using Illumina Infinium HumanMethylation 450K BeadChip to explore genomewide DNA methylation profiles in a human hepatocellular carcinoma cell line. Molecular Medicine Reports. 18 (5), 4446-4456 (2018).
- Moran, S., Arribas, C., Esteller, M. Validation of a DNA methylation microarray for 850,000 CpG sites of the human genome enriched in enhancer sequences. Epigenomics. 8 (3), 389-399 (2016).
- Bibikova, M., et al. High density DNA methylation array with single CpG site resolution. Genomics. 98 (4), 288-295 (2011).
- Lehne, B., et al. A coherent approach for analysis of the Illumina HumanMethylation450 BeadChip improves data quality and performance in epigenome-wide association studies. Genome Biology. 16 (1), 1-12 (2015).
- Wang, J., Zhang, H., Rezwan, F. I., Relton, C., Arshad, S. H., Holloway, J. W. Pre-adolescence DNA methylation is associated with BMI status change from pre- to post-adolescence. Clinical Epigenetics. 25, 64 (2021).
- Maugeri, A. The effects of dietary interventions on DNA methylation: implications for obesity management. International Journal of Molecular Sciences. 21, 8670 (2020).
- DeFuria, J., et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proceedings of the National Academy of Sciences. 110 (13), 5133-5138 (2013).
- Kietzmann, T., Petry, A., Shvetsova, A., Gerhold, J. M., Görlach, A. The epigenetic landscape related to reactive oxygen species formation in the cardiovascular system. British Journal of Pharmacology. 174, 1533-1554 (2017).
- Chase, K., Sharma, R. P. Epigenetic developmental programs and adipogenesis: implications for psychotropic induced obesity. Epigenetics. 8 (11), 1133-1140 (2013).
- Spalding, K. L., et al. Dynamics of fat cell turnover in humans. Nature. 453, 783-787 (2008).
- Ross, S. E., et al. Inhibition of adipogenesis by Wnt signaling. Science. 289, 950-953 (2000).
- Bagchi, D. P., et al. Wnt/β-catenin signaling regulates adipose tissue lipogenesis and adipocyte-specific loss is rigorously defended by neighboring stromal-vascular cells. Molecular Metabolism. 42, 101078 (2020).

