ニューロン開発中のROSライブ細胞イメージング
Summary
このプロトコルは、神経系の発達中にH2O2の生理的シグナル伝達役割を評価するための培養ゼブラフィッシュニューロンおよび幼虫における遺伝的にコードされた過酸化水素(H2O2)バイオセンサーの使用を記述する。それは、異なる細胞タイプに適用し、一般的な開発で活性酸素種(ROS)を研究するために実験的な治療で変更することができます。
Abstract
活性酸素種(ROS)は、正常な発達、恒常性、生理学において重要なシグナル伝達分子として確立されています。異なるROSの中で、過酸化水素(H2O2)は、細胞シグナル伝達における役割に関して最もよく特徴づけられる。H2O2は、いくつかの種の発達中に関与している。例えば、H2O2の一過性の増加は、受精後の最初の日の間にゼブラフィッシュ胚で検出された。さらに、重要な細胞H2O2源を枯渇させることは、NADPHオキシダーゼ(NOX)、生体内およびインビトロの両方で分化、軸索成長、およびレチナルガングリオン細胞(RGC)の誘導などの神経系の発達を損なう。ここでは、遺伝的にコードされたH2O2特異的バイオセンサーroGFP2-Orp1を用いて、開発中に培養されたゼブラフィッシュニューロンおよび全幼虫における細胞内H2O2レベルをイメージングする方法について説明する。このプローブは、ゼブラフィッシュの幼虫で一過性または安定して発現することができる。さらに、レシオメトリック読み出しは、遺伝子発現の差異や体積効果によるアーチファクトの検出の確率を低下させます。まず、roGFP2-Orp1を一過性発現するゼブラフィッシュ胚由来のRGCを単離し、培養する方法を示す。次に、幼虫全体を使用して、組織レベルでH2O2レベルを監視します。センサーは、H2O2の追加によって検証されています。さらに、この方法論は、組織特異的バイオセンサー発現を有するトランスジェニック動物を生成することによって、特定の細胞タイプおよび組織におけるH2O2レベルを測定するために使用することができる。ゼブラフィッシュが遺伝的および発達的操作を促進するにつれて、ここで実証されたアプローチは、脊椎動物における神経および一般的な胚発生中のH2O2の役割をテストするパイプラインとして役立つ可能性がある。
Introduction
活性酸素種(ROS)シグナル伝達は神経系1の発達および機能を調節する。重要な細胞ROS源は、過酸化水素と過酸化水素を生成する膜貫通タンパク質であるNADPHオキシダーゼ(NOX)である(H2O2)2。NOX酵素は中枢神経系(CNS)全体に見られ、NOX由来のROSは神経細胞の発達に寄与する3、4、5、6。神経幹細胞の維持と分化、神経極性の確立、神経突起伸長、およびシナプス可塑性は、ROS7、8、9、10、11の十分なレベルを必要とすることが示されている。一方、NOXesによるROSの制御不能な産生は、アルツハイマー病、多発性硬化症、および外傷性脳損傷12、13、14を含む神経変性疾患に寄与する。したがって、生理学的に関連するROSの産生は、健康な状態を維持するために重要である。
遺伝子組み換えバイオセンサーの開発は、細胞ROSの検出を大いに促進した。遺伝子組み換えバイオセンサーの重要な利点の1つは、ROS信号の時間的および空間分解能の増加であり、これらのセンサーは特異的に異なる場所を標的とすることができる。レドックス感受性GFP(roGFP)は、ROSバイオセンサーのような一種である。roGFP2-Orp1変異体は、特にそのOrp1ドメインを介してH2O2を検出し、これは酵母15、16由来のグルタチオンペルオキシレドキシンファミリータンパク質である。Orp1タンパク質の酸化は、その立体構造を変化させるためにroGFP2に移される(図1A)。このプローブは、405 nmおよび480 nm付近の2つの励起ピークと、515 nmの単一の放出ピークを示す。酸化すると、励起ピーク周辺の蛍光強度が変化する:405nm励起が増加する一方で、480nmの励起は減少する。従って、roGFP2-Orp1は、レシオメトリックバイオセンサであり、H2O2-レベルは、2つの異なる波長で励起された蛍光強度の比によって検出される(図1B)。全体的に見て、roGFP2-Orp1は、インビボで効率的に利用することができるROSイメージング用の汎用性の高いツールです。
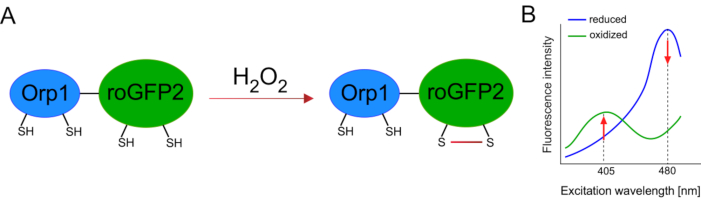
図1: roGFP2-Orp1の模式的表現と励起スペクトル(A)は、H2O2に応答してOrp1とroGFP2の間で酸化伝達が起こり、roGFP2の立体構造変化をもたらす。(B)roGFP2-Orp1の励起スペクトルは、405 nmおよび480 nmの2つの励起ピークと515 nmの単一放出ピークを示す。H2O2による酸化の際、405nm励起は増加し、480nm励起は減少する。この結果、H2 O2の比率の読み出しが得られます。この数字は、ビランとベロウソフ(2017)16とモルガンら(2011)25から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
Danio rerio(ゼブラフィッシュ)モデルシステムは、遺伝的にコード化されたバイオセンサーを適用するためのいくつかの利点を有する。胚および幼虫の光学的透明性は、生体内での非侵襲的なイメージングを可能にする。新しいイメージングツールは、より高い解像度と深い浸透を達成するために開発されています17.さらに、遺伝子操作(異所性mRNA発現、Tol2トランスジェネシス等)やゲノム編集(タレンス、CRISPR/Cas9等)の樹立されたツールがあり、トランスジェニック動物18の生成を促進する。ゼブラフィッシュの胚が母親の外で発達するにつれて、このシステムはさらに胚の容易なアクセスおよび操作を可能にする。例えば、1細胞段階の注射や薬物治療は簡単に行うことができます。
ここでは、ゼブラフィッシュを用いて、生体転写mRNAを注入してH2O2特異的バイオセンサーroGFP2-Orp1を一時的に発現させた。これらの胚は、培養ニューロンのインビトロイメージングとインビボイメージングの両方に使用することができる(図2)。ゼブラフィッシュ胚からの解剖およびメッキのレチナル神経節細胞(RGC)のプロトコルを説明し、続いて培養ニューロンにおけるH2O2-レベルを評価する。次に、共焦点顕微鏡を用いてroGFP2-Orp1発現胚および幼虫のインビボイメージング法を提示する。このアプローチは、生理学的なH2O2-レベルを決定するだけでなく、異なる発達段階または条件で起こる潜在的な変化を決定することを可能にする。全体として、このシステムは、生きた細胞および動物におけるH2O2を検出するための信頼できる方法を提供し、H2O2の発達、健康および疾患における役割を研究する。

図 2.実験アプローチの概要簡単に言えば、胚採取後、roGFP2-Orp1 mRNAを、ゼブラフィッシュ胚の1細胞期の黄身に注入する。現像胚は、インビトロ(A)および(B)インビボイメージングの両方に使用することができる。(A) GFP陽性胚は、34 hpfでのRGC採取のためのレティナを解剖するために使用される。解約されたRGCは、ZFCM(+)メディアのPDL/ラミニンコーティングカバーリップにメッキされています。成長コーンイメージングは、GMCが6〜24時間のめっき後に軸索を延長するにつれて行うことができる。細胞は、H2O2-レベルにおける潜在的変化を測定するために異なる治療を施すことができる。ここでは、RGCの成長コーンにおけるH2O2-レベル(赤色)を測定した。(B)GFP陽性胚は生体内イメージングに使用される。望ましい年齢で、胚は共焦点のイメージ投射のための35のmmガラスの底の皿に麻酔され、取付けることができる。ここでは、胚は、画像の再生のために腹孔に取り付けられている。概略図はゼブラフィッシュのレチナルの発達を示す。GGCは、残膜の最も内側の層であるガングリオン細胞層(GCL)を形成する。RGC軸索は、正中線を横切るために視神経に発達し、視神経を形成する。その後、RGC軸索は、中脳の視状体でシナプスを作るためにドーサリーに成長する。この図の大きなバージョンを表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
このプロトコル全体で注意が必要な重要な手順がいくつかあります。これらの点を考えると、実験の流れが改善されると考えています。一次RGC培養では、この培養培地には抗生物質が含まれておらず、画像処理の前または中に汚染が起こり得るため、ZFCM(-)の無菌性は非常に重要である。これを避けるために、バイオセーフティキャビネット内でのみZFCM(-)を準備して使用し、新鮮なZFCM(-)メデ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、国立衛生研究所(グラントR01NS117701)、国立科学財団(グラント1146944-IOS)、インディアナ外傷性脊髄および脳損傷研究基金(グラント20000289)、パーデュー研究財団(グラント209911)、パーデュー大学研究協力副学長事務所(グラント210362)によって支援されました。ゼブラフィッシュRGC培養プロトコルを確立してくれたコーリー・J・ウィーバー博士とヘイリー・ローダー博士に感謝します。図 4 のデータを提供してくれたヘイリー・ローダーに感謝します。リア・ビアシとケニー・グエンのRGC文化の支援に感謝します。テキストを編集してくれたジェントリーに感謝します。私たちは、roGFP2-Orp1を含むpCS2+ベクターにroGFP2-Orp1と清トウ博士を提供してくれたトビアス・ディック博士に感謝します。図 2 は、Biorender.com を使用して作成されます。
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

