ROS הדמיית תאים חיים במהלך התפתחות עצבית
Summary
פרוטוקול זה מתאר את השימוש במי חמצן מקודד גנטית (H2O2)-biosensor בנוירונים זברה בתרבית וזחלים להערכת תפקידי האיתות הפיזיולוגיים של H2O2 במהלך התפתחות מערכת העצבים. זה יכול להיות מיושם על סוגי תאים שונים ושונה עם טיפולים ניסיוניים לחקור מינים חמצן תגובתי (ROS) בפיתוח כללי.
Abstract
מיני חמצן תגובתי (ROS) הם מולקולות איתות מבוססות היטב, החשובות בהתפתחות תקינה, הומאוסטזיס ופיזיולוגיה. בין ROS שונים, מי חמצן (H2O2) מאופיין בצורה הטובה ביותר ביחס לתפקידים איתות הסלולר. H2O2 כבר מעורב במהלך הפיתוח במספר מינים. לדוגמה, עלייה חולפת H2O2 זוהה בעוברים זברה בימים הראשונים לאחר ההפריה. יתר על כן, דלדול מקור H2O2 הסלולר חשוב, NADPH אוקסידאז (NOX), פוגע בהתפתחות מערכת העצבים כגון בידול, צמיחה אקסונאלית, והנחיה של תאי גנגליון ברשתית (RGCs) הן vivo והן במבחנה. כאן, אנו מתארים שיטה להדמיה תאית H2O2 רמות נוירונים זברה בתרבית וזחלים שלמים במהלך הפיתוח באמצעות Hמקודד גנטית 2O2-ספציפי biosensor, roGFP2-Orp1. בדיקה זו יכולה לבוא לידי ביטוי באופן ארעי או יציב בזחלי זברה. יתר על כן, הקריאה היחסית מפחיתה את ההסתברות לגילוי חפצים עקב ביטוי גנים דיפרנציאלי או השפעות נפח. ראשית, אנו מדגימים כיצד לבודד ולתרבת RGCs הנגזרים מעוברים של דגי זברה המבטאים באופן ארעי roGFP2-Orp1. לאחר מכן, אנו משתמשים בזחלים שלמים כדי לפקח על H2O2 רמות ברמת הרקמה. החיישן אומת על ידי תוספת של H2O2. בנוסף, מתודולוגיה זו יכולה לשמש למדידת H2O2 רמות בסוגי תאים ספציפיים ורקמות על ידי יצירת בעלי חיים מהונדסים עם ביטוי biosensor ספציפי לרקמות. כמו זברה פיש להקל על מניפולציות גנטיות והתפתחותיות, הגישה הוכיחה כאן יכול לשמש צינור כדי לבדוק את התפקיד של H2O2 במהלך התפתחות עוברית עצבית וכללית בחולייתנים.
Introduction
חמצן תגובתי מינים (ROS) איתות מווסת את ההתפתחות והתפקוד של מערכת העצבים1. מקור ROS תאי חשוב הם תחמוצות NADPH (NOX), שהם חלבונים טרנסממברן המייצרים סופראוקסיד ומי חמצן (H2O2)2. אנזימי NOX נמצאים בכל מערכת העצבים המרכזית (מערכת העצבים המרכזית), ו- NOX נגזר ROS לתרום להתפתחות עצבית3,4,5,6. תחזוקה ובידול של תאי גזע עצביים, יצירת קוטביות עצבית, נוייריט נימים, פלסטיות סינפטית הוכחו לדרוש רמות נאותות של ROS7,8,9,10,11. מצד שני, ייצור בלתי מבוקר של ROS על ידי NOXes לתרום הפרעות ניווניות כולל מחלת אלצהיימר, טרשת נפוצה, ופגיעה מוחית טראומטית12,13,14. לפיכך, הייצור של ROS רלוונטי מבחינה פיזיולוגית הוא קריטי לשמירה על תנאים בריאים.
פיתוח של biosensors מקודדים גנטית הקל על גילוי של ROS הסלולר מאוד. אחד היתרונות החשובים של biosensors מקודד גנטית הוא הרזולוציה הזמנית והמרחבית מוגברת של אות ROS, כמו חיישנים אלה יכולים להיות ממוקדים במיוחד למקומות שונים. GFP רגיש לאדומים (roGFP) הוא סוג אחד של ביוסנסורים מסוג ROS. גרסת roGFP2-Orp1 מזהה באופן ספציפי H2O2 דרך תחום Orp1 שלה, שהוא חלבון משפחת גלוטתיון peroxiredoxin משמרים15,16. החמצון של חלבון Orp1 מועבר roGFP2 כדי לשנות את הקונפורמציה שלה (איור 1A). הגשוש מציג שתי פסגות עירור ליד 405 ננומטר ו 480 ננומטר, ושיא פליטה יחיד ב 515 ננומטר. עם החמצון, עוצמת הפלואורסצנטיות סביב עירור מגיעה לשיאה: בעוד שהתרגשות של 405 ננומטר עולה, 480 ננומטר של עירור פוחת. לפיכך, roGFP2-Orp1 הוא ביוסנסור יחסי, ורמות H2O2מזוהות על ידי היחס בין עוצמות הפלואורסצנטיות הנרגשות משני אורכי גל שונים (איור 1B). בסך הכל, roGFP2-Orp1 הוא כלי רב-תכליתי להדמיית ROS שניתן להשתמש בו ביעילות ב- vivo.
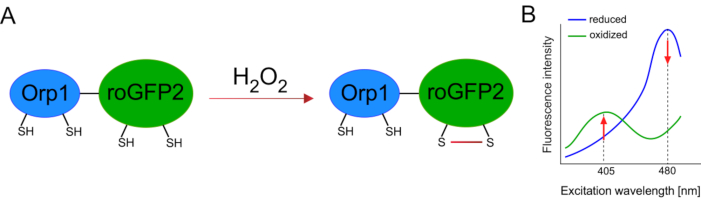
איור 1: ייצוג סכמטי וספקטרום עירור של roGFP2-Orp1. (A) העברת חמצון מתרחשת בין Orp1 ו roGFP2 בתגובה H2O2, המוביל לשינויים קונפורמיים roGFP2. (B)ספקטרום העירור של roGFP2-Orp1 מציג שתי פסגות עירור ב 405 ננומטר ו 480 ננומטר ושיא פליטה יחיד ב 515 ננומטר. עם חמצון על ידי H2O2, עירור 405 ננומטר עולה בעוד 480 ננומטר עירור פוחתת. התוצאה היא קריאה ביחס עבור נוכחות H2O2. הנתון שונה מבילאן ובלושוב (2017)16 ומורגן ואח ‘ (2011)25. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
למערכת המודלים של דניו ריו (זברה-פיש) יש מספר יתרונות ליישום ביוסנסורים מקודדים גנטית. השקיפות האופטית של העוברים והזחלים מאפשרת הדמיה לא פולשנית של vivo. כלי הדמיה חדשים מפותחים כדי להשיג רזולוציה גבוהה יותר וחדירה עמוקה יותר17. יתר על כן, ישנם כלים מבוססים למניפולציה גנטית (ביטוי mRNA חוץ רחמי, Tol2 transgenesis, וכו ‘) ועריכת גנום (TALENs, CRISPR / Cas9, וכו ‘), אשר מקדם את הדור של בעלי חיים מהונדסים18. ככל שעוברי הזברה מתפתחים מחוץ לאם, מערכת זו מאפשרת גישה ומניפולציה קלות יותר של העוברים. לדוגמה, זריקות שלב אחד וטיפולים תרופתיים ניתן לעשות בקלות.
כאן, השתמשנו בזברה כדי לבטא באופן ארעי את ה- H2O2-ספציפי biosensor roGFP2-Orp1 על ידי הזרקת mRNA עם עיטור במבחנה. עוברים אלה יכולים לשמש הן להדמיה במבחנה של נוירונים תרבותיים והן להדמיית vivo (איור 2). אנו מתארים פרוטוקול עבור ניתוח וציפוי תאי גנגליון רשתית (RGCs) מעוברים זברה ולאחר מכן הערכת H2O2-רמות נוירונים תרבותיים. לאחר מכן, אנו מציגים שיטה להדמיה in vivo של עוברים מבטאים roGFP2-Orp1 ותזחלים באמצעות מיקרוסקופיה קונפוקלית. גישה זו לא רק מאפשרת לקבוע פיזיולוגית H2O2-רמות, אלא גם שינויים פוטנציאליים המתרחשים בשלבים התפתחותיים שונים או תנאים. בסך הכל, מערכת זו מספקת שיטה אמינה לגילוי H2O 2 בתאים חיים ובעליחיים כדי ללמוד את התפקיד של H2O2 בפיתוח, בריאות, ומחלות.

איור 2. קווי המתאר של הגישה הניסיונית. בקצרה, לאחר איסוף עוברים, roGFP2-Orp1 mRNA מוזרק לתוך החלמון של עוברי זברה שלב אחד. פיתוח עוברים יכול לשמש הן עבור (A) במבחנה ו –( B) בהדמיה vivo. (A)עוברים חיוביים GFP משמשים לנתח רשתית עבור אוסף RGC ב 34 hpf. RGCs מנותקים מצופים על כריכות מצופות PDL/למין במדיה ZFCM (+). הדמיית חרוט צמיחה יכולה להתבצע כמו RGCs להרחיב את האקסונים שלהם לאחר 6-24 שעות של ציפוי. תאים יכולים להיות כפופים לטיפולים שונים כדי למדוד את השינויים הפוטנציאליים H2O2-רמות. כאן, מדדנו H2O2-רמות בקונוסים הצמיחה של RGCs (אדום). (B)עוברים חיוביים של GFP משמשים להדמיית vivo. בגיל הרצוי, עוברים יכולים להיות מורדמים ומורכבים על כלים תחתונים מזכוכית 35 מ”מ להדמיה קונפוקלית. כאן, עוברים מותקנים באופן מאוורר להדמיה ברשתית. סכמטי מראה התפתחות רשתית בזברפיש. RGCs יוצרים שכבת תא גנגליון (GCL), שהיא השכבה הפנימית ביותר ברשתית. אקסונים RGC לפתח עצב הראייה לחצות קו האמצע, ויוצרים chiasm אופטי. לאחר מכן, אקסונים RGC לגדול dorsally לעשות סינפסות ב טקטום אופטי ב midbrain. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
ישנם מספר שלבים קריטיים הזקוקים לתשומת לב לאורך פרוטוקול זה. אנו מאמינים כי התחשבות בנקודות אלה תשפר את זרימת הניסויים. עבור תרבות RGC העיקרית, הסטריליות של ZFCM(-) חשובה מאוד, שכן מדיה תרבותית זו אינה מכילה אנטיביוטיקה וזיהום יכול להתרחש לפני או במהלך ההדמיה. כדי להימנע מכך, אנו ממליצים להכין ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות (Grant R01NS117701), הקרן הלאומית למדע (Grant 1146944-IOS), קרן המחקר של חוט השדרה הטראומטי של אינדיאנה ופגיעות מוחיות (גרנט 20000289), קרן המחקר פרדו (גרנט 209911) ומשרד סגן נשיא בכיר למחקר ושותפויות באוניברסיטת פרדו (גרנט 210362). אנו מודים לד”ר קורי ג’יי וויבר והיילי רודר על הקמת פרוטוקול תרבות זברה-פיש RGC. אנו מודים להיילי רודר על שסיפקה את הנתונים של איור 4. אנו מודים ללאה ביאסי וקני נגוין על העזרה בתרבות RGC. אנו מודים לג’נטרי לי על עריכת הטקסט. אנו מודים לד”ר טוביאס דיק על שסיפק את roGFP2-Orp1 ואת ד”ר צ’ינג דנג על וקטור pCS2+ המכיל roGFP2-Orp1. איור 2 נוצר באמצעות Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

