Reazioni catalitiche a nanoparticelle di platino stabilizzate con ammine e prive di leganti supportate su Titania durante l'idrogenazione di alcheni e aldeidi
Summary
Questo protocollo mostra un metodo conveniente per confrontare le proprietà catalitiche dei catalizzatori di platino supportati, sintetizzati per deposizione di colloidi di dimensioni nanometriche o per impregnazione. L’idrogenazione del cicloesene serve come reazione modello per determinare l’attività catalitica dei catalizzatori.
Abstract
Ligandi come le ammine sono utilizzati nell’approccio di sintesi colloidale per proteggere le nanoparticelle di platino (Pt NP) dall’agglomerazione. Normalmente, i ligandi come le ammine vengono rimossi da diverse procedure di pre-trattamento prima dell’uso in catalisi eterogenea poiché le ammine sono considerate un veleno catalizzatore. Tuttavia, una possibile influenza benefica di questi modificatori di superficie sulle reazioni di idrogenazione, che è nota dalle specie spettatrici su superfici metalliche, è spesso trascurata.
Pertanto, nanoparticelle di Pt stabilizzate con ammine supportate da titania (P25) sono state utilizzate senza alcun pretrattamento al fine di chiarire una possibile influenza del ligando nelle reazioni di idrogenazione in fase liquida. L’attività catalitica di nanoparticelle di Pt stabilizzate con ammine di due diverse dimensioni è stata studiata in un reattore a serbatoio di agitazione a doppia parete a 69 °C a 130 °C e 1 atm di pressione dell’idrogeno. La conversione del cicloesene in cicloesano è stata determinata mediante gascromatografia (GC) ed è stata confrontata con particelle Pt prive di ligando. Tutti i catalizzatori sono stati controllati prima e dopo la reazione mediante spettroscopia elettronica a trasmissione (TEM) e spettroscopia fotoelettronica a raggi X (XPS) per possibili cambiamenti di dimensioni, forma e guscio del ligando. L’idrogenazione del cicloesene in fase liquida ha rivelato una conversione più elevata per le nanoparticelle di Pt stabilizzate con ammine sulla titania rispetto alle particelle prive di ligando. L’idrogenazione del 5-metilfurfurolo (5-MF) è stata scelta per un’ulteriore reazione di prova, poiché l’idrogenazione delle aldeidi α β-insature è più complessa e presenta vari percorsi di reazione. Tuttavia, XPS e spettroscopia infrarossa (IR) hanno dimostrato che 5-MF agisce come veleno catalizzatore nelle condizioni di reazione date.
Introduction
I catalizzatori delle dimensioni di pochi singoli atomi fino a nanoparticelle più grandi con elevati rapporti superficie-volume e dimensioni definite sono materiali promettenti per una vasta gamma di reazioni catalizzate eterogenee, come l’idrogenazione, la deidrogenazione e le reazioni fotocatalitiche1. Le nanoparticelle di platino sono ampiamente utilizzate nei processi industriali, a causa dell’elevata attività per l’idrogenazione delle olefine. Inoltre, le nanoparticelle di platino sono catalizzatori promettenti per l’idrogenazione selettiva di chetoni α,β-insaturi e aldeidi 1,2,3,4. Qui, diversi parametri come dimensioni, forma e supporto sono in grado di influenzare le proprietà catalitiche 1,5,6.
La dimensione influenza la morfologia delle nanoparticelle, specialmente nell’intervallo da 1 a 5 nm7. In particolare, la dimensione influenza i siti di adsorbimento disponibili (ad esempio: bordi, gradini o terrazze) e quindi la superficie cataliticamente attiva, che influenza ulteriormente l’attività catalitica 7,8,9. Inoltre, il supporto è in grado di interagire con il metallo. Queste interazioni variano e vanno dai processi di trasferimento di carica o spillover a un cambiamento nella morfologia o nell’incapsulamento delle nanoparticelle 6,10. Mentre l’effetto delle dimensioni, della forma e del supporto sulle proprietà catalitiche è ben noto, un possibile effetto degli adsorbati non direttamente coinvolti nella reazione, le cosiddette molecole spettatrici o modificatori di superficie, è meno evoluto 1,5,6,11. Nel caso di un approccio colloidale per la preparazione del catalizzatore, utilizzando nanoparticelle metalliche colloidali che vengono successivamente depositate sul supporto, i ligandi stabilizzano le nanoparticelle e quindi possono potenzialmente influenzare la reazione.
Il grande vantaggio della sintesi colloidale è che nanoparticelle di una certa dimensione e forma possono essere prodotte in modo mirato aiutando a controllare le prestazioni catalitiche attraverso la via di sintesi12,13,14. La funzione del ligando è quella di controllare la dimensione, la forma e la morfologia delle nanoparticelle. Tuttavia, i ligandi simili alle ammine sono spesso considerati come veleno catalizzatore, poiché i ligandi bloccano i siti di adsorbimento disponibili15,16. Pertanto, per aumentare l’attività catalitica dei catalizzatori, i ligandi vengono comunemente rimossi mediante pretrattamento, ad esempio calcinazione o decomposizione indotta dalla luce UV17,18.
Ciò è in contrasto con la catalisi omogenea, dove i leganti sono essenziali per stabilizzare i complessi dei metalli di transizione e regolare la loro reattività15,19. L’interazione tra ligando e reagente consente di controllare la chemioselettività, la regioselettività e la stereoselettività della reazione omogeneamente catalizzata. Poiché la separazione dei catalizzatori omogenei dai prodotti non è banale, i catalizzatori eterogenei sono più comuni sebbene questi siano meno selettivi e sorge quindi la questione se i ligandi abbiano anche un effetto positivo sulla catalisi eterogenea.
Un approccio promettente per i ligandi nella catalisi eterogenea è l’uso di monostrati autoassemblanti contenenti tioli aromatici e alifatici per migliorare la selettività per l’idrogenazione di aldeidi α,β-insaturi e acidi grassi polinsaturi su nanoparticelle Pt e Pd. Il miglioramento della selettività si basa su diversi effetti. Interazioni specifiche tra reagente e modificatore, blocco selettivo di alcuni siti attivi indesiderati ed effetti sterici ed elettronici svolgono un ruolo nel miglioramento della selettività20,21,22,23. Viene fatta una distinzione tra ligandi e spettatori. Gli spettatori non partecipano, ma influenzano la reazione con effetti sterici, mentre i ligandi sono coinvolti nelle reazioni24,25. Uno spettatore può essere formato durante una reazione catalitica o da precedenti processi chimici 11,26.
La scelta di un legante e di un solvente adatti per un’idrogenazione in fase liquida di successo è un compito impegnativo. Il solvente deve avere un’elevata solubilità sia per l’idrogeno che per il reagente. Inoltre, non ci dovrebbero essere reazioni successive o collaterali con il solvente, che possono ridurre la selettività della reazione. Un ligando appropriato dovrebbe avere un forte adsorbimento in siti di adsorbimento selezionati in modo da prevenire il desorbimento del ligando in condizioni di reazione, ma l’attività catalitica è ancora presente. Idealmente, il ligando blocca i siti di adsorbimento, che favoriscono le reazioni collaterali o guidano la selettività della reazione dalle richieste stericamente del ligando e dalle interazioni con il reagente15,21.
Questo lavoro chiarisce se gli effetti sterici ed elettronici dell’ammina dodecilica (DDA) influenzano l’idrogenazione del cicloesene e del 5-metilfurfurolo (5-MF) o meno. DDA non interagisce direttamente con i reagenti, il che implica un’idrogenazione diretta dallo spettatore. Il 5-MF, un derivato non tossico del furfurolo, è stato utilizzato come reagente più complesso e commercialmente interessante, rispetto all’idrogenazione del cicloesene. L’idrogenazione selettiva del furfurolo, un prodotto collaterale della produzione di bio petrolio, e dei derivati del furfurolo sono di interesse industriale in quanto questi composti possono essere ottenuti dalla biomassa e rappresentano componenti di partenza promettenti per la produzione di diversi prodotti chimici fini27,28.
Tuttavia, l’idrogenazione selettiva è impegnativa, poiché l’idrogenazione dei doppi legami di carbonio e il gruppo carbonile sono in competizione. Termodinamicamente, l’idrogenazione dei doppi legami carboniosi è favorita contro l’idrogenazione del gruppo carbonilico29.
Protocol
Representative Results
Discussion
Le nanoparticelle di Pt ricoperte di DDA sono state sintetizzate con successo in due diverse dimensioni e forme12,14. Le piccole nanoparticelle di Pt (1,6 nm) mostrano una forma quasi-sferica mentre le particelle più grandi (2,4 nm) sono più asimmetriche e mostrano strutture parzialmente tripodomiche o ellissoidali. Le possibilità sono limitate per ottenere nanoparticelle di platino quasi-sferiche più grandi, poiché una formazione di strutture allungate si verifica aumentando ulteriormente la dimensione delle particelle per crescita seminata14. La dimensione e la forma delle particelle possono anche essere influenzate dal ligando, dal tempo di reazione e dalla temperatura. Oltre al DDA, altri ligandi possono essere utilizzati nella sintesi, ma l’agente di tappatura influenza la crescita e, quindi, la dimensione e la forma delle nanoparticelle, come è già stato dimostrato per la sintesi di nanoparticelle d’oro39. Dopo aver aggiunto la soluzione di riduzione alla soluzione di sale metallico, la soluzione viene agitata per 60 minuti (90 minuti per la sintesi di particelle più grandi) per garantire che il processo di crescita delle nanoparticelle di Pt sia completato. Il trasporto di monomeri sulla superficie delle particelle può essere un fattore limitante. Inoltre, la temperatura può influenzare il raggio critico, che descrive la dimensione minima delle particelle richiesta, alla quale i semi sono stabili in soluzione. Aumentando la temperatura, il raggio critico diminuisce, con conseguente formazione più rapida di semi e di conseguenza una diminuzione più rapida della concentrazione del monomero55. Dopo la sintesi, le impurità di ammonio e bromuro possono ancora essere osservate nell’XPS che possono essere eliminate eseguendo uno scambio di ligando con DDA. Inoltre, tutte le nanoparticelle sintetizzate sono state depositate su polveri P25 senza alcun cambiamento di forma, dimensione o perdita del ligando. Per confronto, un catalizzatore Pt privo di leganti è stato generato utilizzando il metodo di impregnazione, che presenta una dimensione delle nanoparticelle Pt di 2,1 nm e una forma quasi sferica. XPS rivela inoltre che non solo le specie metalliche di Pt erano presenti sulla superficie, ma anche le specie ossidate. Ciò indica che in assenza di ligandi amminici le nanoparticelle di platino interagiscono con il supporto, il che può comportare un parziale incapsulamento del metallo nel supporto10. Di conseguenza, le particelle perdono parzialmente la loro capacità di scindere l’idrogeno56. Tuttavia, tale incapsulamento è favorito dalla riduzione ad alta temperatura del precursore del sale metallico. La temperatura qui utilizzata per la riduzione (180 °C) è molto inferiore a quella menzionata nella letteratura per l’incapsulamento (600 °C)57. Un’altra spiegazione più probabile sarebbe una riduzione incompleta della fonte Pt utilizzata. Tuttavia, entrambe le spiegazioni comportano una parziale disattivazione del catalizzatore.
In letteratura ligandi come ammine o ammoniaca sono spesso considerati come veleno catalizzatore nella comprensione classica della catalisi eterogenea15,16. Tuttavia, le indagini sull’idrogenazione in fase liquida del cicloesene dimostrano che Pt/DDA/P25 è ancora cataliticamente attivo e ha mostrato una conversione ancora più elevata rispetto al catalizzatore privo di ammine. Le ammine sono note per bloccare sistematicamente i siti di adsorbimento delle terrazze su Pt(111)11,58. I risultati in letteratura hanno già dimostrato che questo promettente effetto di selezione del sito attivo dei ligandi può essere utilizzato per migliorare la selettività per l’idrogenazione dell’acetilene nei flussi ricchi di etilene diluendo i siti di adsorbimento59. Questo effetto di selezione del sito attivo è stato osservato anche per il legame dei tioli su Pd(111)22,23. Per l’idrogenazione del cicloesene, questi siti sono quindi già bloccati dalle ammine, tuttavia sono ancora disponibili centri di reazione altamente attivi e sottocoordinati. Oltre all’effetto di selezione del sito del ligando, si dovrebbe prestare attenzione anche ad altre proprietà del ligando. Quando si seleziona il ligando, è necessario prestare attenzione per garantire che il legante stabilizzi le particelle durante la sintesi e le protegga dall’agglomerazione. Inoltre, il ligando dovrebbe mostrare un forte adsorbimento sulla superficie metallica e una stabilità termica sufficientemente elevata in modo che il ligando non venga desorbito o decomposto in condizioni di reazione. I risultati mostrano che la DDA sembra generalmente essere adatta a questo approccio catalitico. Non è stato possibile osservare alcun effetto dimensionale nella reazione del modello. È interessante notare che il catalizzatore contenente nanoparticelle di Pt che non hanno subito uno scambio di ligando ha mostrato una conversione inferiore (50%) rispetto alle particelle di Pt depositate su P25 dopo lo scambio di ligando (72%). Pertanto, in queste condizioni può essere necessario prendere in considerazione un blocco dei siti attivi da parte di composti ionici. L’esecuzione di uno scambio di leganti è fondamentale per aumentare l’attività delle nanoparticelle di platino rimuovendo composti ionici co-adsorbiti come bromuro e ammonio, come mostra XPS prima e dopo lo scambio di ligando.
Inoltre, l’influenza delle specie superficiali di ammine extra sull’attività catalitica delle nanoparticelle di platino rimane ambigua, poiché questa specie può potenzialmente servire come fonte aggiuntiva di idrogeno localizzata. Gli spettri XP e gli spettri FT-IR sembrano indicare un’astrazione di idrogeno del gruppo amminico da parte del platino che porta ad una specie superficiale di ammina extra. Ciò offre l’opportunità di servire l’idrogeno in aggiunta all’idrogeno disciolto nel toluene, che può influenzare l’attività catalitica. Un effetto donatore di idrogeno dal toluene può essere escluso qui poiché il toluene non è noto per deidrogenare a bassa pressione di idrogeno e temperatura60. Tuttavia, l’influenza dell’estrazione di idrogeno sull’attività catalitica deve ancora essere ulteriormente studiata. L’idrogenazione dell’acetofenone su nanoparticelle di platino modificate con l-prolina ha già dimostrato che il gruppo amminico può accelerare l’idrogenazione mediante un trasferimento di idrogeno dall’ammina al reagente15. Pertanto, dovrebbe essere considerata una possibile influenza dell’ammina e delle specie di superficie sull’idrogenazione.
Nonostante l’uso di successo di nanoparticelle Pt/DDA per l’idrogenazione di alcheni semplici, non è stato osservato alcun turnover per il reagente più esigente 5-MF. Pertanto, diverse possibilità per questo possono essere discusse nel seguito: una spiegazione potrebbe essere che nessuna reazione ha luogo a causa della bassa temperatura di reazione e della pressione dell’idrogeno. La temperatura di reazione è stata limitata a 160 °C. Poiché l’analisi termogravimetrica ha mostrato che il desorbimento del ligando e la decomposizione di nanoparticelle di Pt/DDA di dimensioni comparabili avvengono a queste temperature13. A causa del reattore utilizzato, non è stato possibile utilizzare pressioni superiori a 1 atm di idrogeno. La pressione dell’idrogeno più bassa in contrasto con gli esperimenti di letteratura potrebbe essere la ragione per cui l’idrogenazione di composti carbonilici, come il 5-MF, non era fattibile. Diversi studi hanno inoltre dimostrato che le interazioni di supporto metallico forte (SMSI) sono cruciali per la selettività dell’idrogenazione in fase gassosa del furfurolo61,62,63. L’SMSI porta alla formazione di O-vacanti, che consente l’adsorbimento del furfurolo attraverso il gruppo carbonile sulla superficie della titania. Si forma un furfuril-ossi-intermedio che può essere idrogenato. Tuttavia, questa ipotesi è contrastata dal fatto che, a differenza degli esperimenti in fase gassosa, non è stata trovata alcuna prova di un’influenza di SMSI per l’idrogenazione in fase liquida del furfurolo nel metanolo. Le particelle di platino su diversi ossidi (MgO, CeO 2 e Al2O3) avevano mostrato proprietà catalitiche comparabili64. Ciò indica che l’idrogenazione potrebbe avvenire subendo diversi meccanismi nella fase liquida e gassosa, che deve essere ulteriormente studiata. L’effetto SMSI delle particelle Pt e il supporto sono stati osservati solo per il catalizzatore privo di ligando, che inoltre non mostra alcuna conversione di 5-MF nelle condizioni di reazione utilizzate. Pertanto un impatto dell’effetto SMSI sembra improbabile. Poiché l’avvelenamento del catalizzatore da parte di 5-MF o di un intermedio di superficie sembra più probabile nelle condizioni di reazione applicate, i catalizzatori sono stati ulteriormente analizzati prima e dopo lo scambio di liganti con 5-MF in condizioni di reazione mediante XPS e FT-IR. Queste misurazioni hanno confermato l’ipotesi di avvelenamento da catalizzatore da 5-MF poiché entrambi i metodi mostrano una diminuzione dei picchi corrispondenti all’ammina sulla superficie del Pt. La spettroscopia FT-IR suggerisce inoltre che il 5-MF agisce come veleno catalizzatore poiché le bande appaiono nella regione del numero d’onda al di sotto di 1.200 cm-1, che sono coerenti con le bande assegnate a 5-MF. Si suggerisce una geometria di adsorbimento quasi piatta tenendo conto delle regole di selezione delle superfici. Un disegno schematico per la ristrutturazione della superficie proposta è mostrato nella Figura 8.
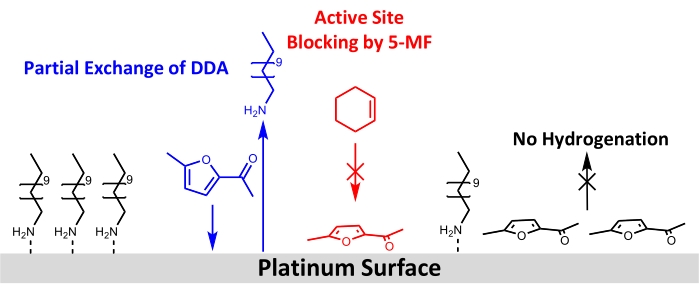
Figura 8: Disegno schematico dei cambiamenti strutturali aggiungendo 5-MF all’idrogenazione del cicloesene sulla superficie delle nanoparticelle di platino stabilizzate con ammine. I risultati di FT-IR e XPS mostrano uno scambio parziale di DDA da parte di 5-MF sulla superficie del platino e il blocco dei siti attivi per l’idrogenazione del cicloesene. I risultati dei dati FT-IR suggeriscono un adsorbimento dell’anello di 5-MF quasi parallelo alla superficie. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Per concludere, le nanoparticelle di Pt ricoperte di ammine su P25 sono candidati promettenti per nuovi catalizzatori di idrogenazione poiché le nanoparticelle di Pt mostrano una conversione più elevata rispetto al catalizzatore privo di ligando nella reazione del modello. Tuttavia, nessuna conversione di 5-MF è stata osservata su entrambi i catalizzatori. Ciò deriva dall’avvelenamento del Pt da parte del reagente e non del ligando come spesso considerato in letteratura nelle condizioni di reazione studiate. Per le applicazioni future, sono necessarie ulteriori conoscenze sull’influenza dei ligandi sul comportamento di adsorbimento dei reagenti e sulla loro interazione con le nanoparticelle metalliche. Una sintesi colloidale è un approccio promettente oltre ai metodi di impregnazione e calcinazione per la fabbricazione di catalizzatori eterogenei, in quanto ciò consente la sintesi di nanoparticelle in dimensioni e forma definite. Poiché l’approccio di sintesi colloidale consente l’uso di diversi ligandi, ad esempio ammine, ammidi, tioli o alcoli, le nanoparticelle di Pt con altri ligandi dovrebbero essere studiate e confrontate. Ciò offre la possibilità di utilizzare ligandi, che mostrano una specifica interazione ligando-reagente, come le interazioni π-π per controllare la geometria di adsorbimento e quindi anche la selettività della reazione. Questo approccio potrebbe essere utilizzato per l’idrogenazione selettiva di chetoni e aldeidi α,β-insaturi, come è già stato dimostrato per l’idrogenazione della cinnamaldeide21. Inoltre, il controllo della stereoselettività in reazioni catalizzate eterogenee è ancora un compito impegnativo; Tuttavia, un ligando chirale appropriato potrebbe essere usato per controllare la chiralità del prodotto come nelle reazioni catalizzate omogenee. Oltre alle interazioni ligando-reagente, l’effetto stabilizzante dei ligandi potrebbe essere utilizzato per proteggere le nanoparticelle metalliche da una forte interazione di supporto metallico. La forte interazione di supporto metallico ridurrebbe il chemisorbimento dell’idrogeno incapsulando le particelle con uno strato di ossido. Per una migliore comprensione dell’influenza dei ligandi, XPS e FT-IR possono fornire informazioni utili sull’effetto avvelenamento selettivo e sulle modalità di legame dei ligandi. Inoltre, il CO è considerato una molecola sensore per identificare i siti superficiali disponibili della nanoparticella di Pt. Inoltre, il comportamento di adsorbimento e le possibili reazioni superficiali di ligandi e reagenti possono essere studiati su singoli cristalli Pt in condizioni di altissimo vuoto per ottenere una comprensione fondamentale dei processi superficiali. Tutto sommato, i ligandi nella catalisi eterogenea possono offrire un nuovo approccio catalitico, che può essere utilizzato per controllare l’attività e la selettività di una reazione catalizzata oltre alla dimensione delle particelle e agli effetti di supporto. Pertanto, il modo tradizionale di pensare alla catalisi eterogenea dei ligandi come veleno catalizzatore dovrebbe essere riconsiderato.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Si ringraziano Edith Kieselhorst e Erhard Rhiel per il supporto al TEM e a Carsten Dosche per il supporto all’XPS. Grazie a Stefan Petrasz per il supporto con il gascromatografo. Si riconosce il finanziamento del dispositivo XPS da parte di DFG (INST: 184/144-1FUGG) e il finanziamento di DFG-RTG 2226.
Materials
| 2-propanol | Sigma Aldrich | 59300-2.5L | puriss. p. a., ACS reagent, >99.8% |
| 4-methyl-2-pentanol | Carl Roth | 4371.2 | purity: >99%, for synthesis |
| 5-methylfurfural | Sigma Aldrich | 137316-100G | ReagentPlus, 99 % |
| acetone | Sigma Aldrich | 32201-2,5L-M | puriss. p. a., ACS reagent, >99.5% |
| cannula | B Braun | 4665643 | diameter: 0.80 mm, length: 120 mm |
| CasaXPS | Casa Software | software, version 2.3.15 | |
| centrifuge | Heraeus | model: Multifuge 1s | |
| centrifuge tube | Schott Duran | 163-9315026 | volume: 80 mL, diameter: 44 mm, length: 100 mm |
| chloroplatinic acid hexahydrate | Merck | 8073400001 | amount of platinum: 40 % |
| column | Agilent Technologies | 19091 S-001 | model: HP-PONA, film: dimethyl polysiloxane, film thickness: 0.2 µm, length: 50 m |
| CRYSTAL 17 | CRYSTAL Theoretical Chemistry Group Torino | software, version: v1.0.2 | |
| crystallizing dish | volume: 50 mL | ||
| cyclohexene | Acros Organics | 154840010 | purity: 99 % |
| desposable syringe | Henke Sass Wolff | Norm-Ject, volume: 1, 2, 5 mL | |
| didodecyldimethylammonium bromide | Acros Organics | 407120250 | purity: 99 % |
| diisopropyl ether | Carl Roth | T899.1 | purity: 98%, for synthesis |
| dodecyl amine | Sigma Aldrich | D222208-500ML | purity: 98 % |
| double walled tank reactor | processed by glass blower | Standard ground glass joint sleeves: 2 x 14/23, 1 x 19/26, 1 x 29/32, reactor volume: 150 mL, material: quartz glas, with outer heating jacket | |
| Fourier-transform infrared spectrometer | Bruker | model: Equinox 55 | |
| rubber balloon | Deutsch & Neumann | 163-7652667 | volume: 4 L, material: latex, |
| gaschromatograph | Agilent Technologies | model: 7820A | |
| HP-PONA-column | Agilent Technologies | 19091S-001 | length: 50 m, film thickness: 0.5 µm, inner diameter: 0.2 mm |
| hydrogen | Air Liquide | P0231L50R2A001 | purity: 5.0 |
| ImageJ | Wayne Rasband | software, version 1.52 | |
| methanol | Sigma Aldrich | 32213-2,5L-M | puriss. p. a., ACS reagent, >99.8% |
| n-hexane | VWR Chemicals | 24577298 | purity: 99 % |
| Opus | Bruker | software, version 5.5 | |
| pasteur pipette | Brand | 747715 | material: glass, length: 145 mm, inside diameter: 1 mm |
| pipette ball | Technikplaza | 89005517 | diameter: 94 mm, material: PVC |
| platinum(IV) chloride | Acros Organics | 195400010 | purity: 99 % |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 005 | volume: 100-1000 µL |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 001 | volume: 0.5-10 µL |
| potassium bromide | Carl Roth | 9252.1 | purity: >98% |
| reflux condenser | neoLab | LZ-1197 | length: 160 mm, NS 14/23 |
| rolled rim glass | VWR Chemicals | 548-0625 | volume: 10 mL |
| round neck flask | Carl Roth | HY50.1 | volume: 10 mL, NS 14/23 |
| rubber septum | Carl Roth | EE04.1 | material: silicone, NS 14/23 |
| syringe filter | Agilent Technologies | 5190-5267 | Captiva Econofilter, pore size 0.2 µm, PTFE menbrane |
| syringe pump | Landgraf Laborsysteme HLL | 106720180 | model: LA180A |
| TEM grid | Plano | diameter: 3.05 mm, 300 mesh, covered with formvar and coal | |
| temperature programmed oven | Nabertherm | model: L5, voltage: 230 V, power: 2.4 kW, controler: C6 | |
| tetrabutylammonium borohydride | Sigma Aldrich | 230170-10G | purity: 98 % |
| three neck round bottom flask | Carl Roth | KY19.1 | volume: 100 mL, NS 14/23, 14/23 |
| Titania P25 | Acros Organics | 384292500 | purity: 99 % |
| toluene | VWR Chemicals | 32249-1L-M | puriss. p. a., ACS reagent, >99.7% |
| transition piece | Carl Roth | with core and stop cock, straight tubing olive, 29/32 | |
| transmission electron microscope | Zeiss | model: 900N | |
| ultrasonic bath | Bandelin | 305 | model: RK 156, volume: 6 L |
| volumetric pipette | Brand | 29718 | volume: 50 mL |
| X-ray photoelectron spectrometer | Thermo Fisher | model: ESCALAB 250 xi |
References
- Liu, L., Corma, A. Metal catalysts for heterogeneous catalysis: From single atoms to nanoclusters and nanoparticles. Chemical Reviews. 118 (10), 4981-5079 (2018).
- Zakarina, N., Bekturov, E. Platinum nanoparticles stabilized by polyvinylpyrrolidone for hydrogenation. Chinese Journal of Catalysis. 29 (11), 1165-1168 (2008).
- Rioux, R. M., et al. Monodisperse platinum nanoparticles of well-defined shape: synthesis, characterization, catalytic properties and future prospects. Topics in Catalysis. 39 (3-4), 167-174 (2006).
- Ikeda, S., et al. Ligand-free platinum nanoparticles encapsulated in a hollow porous carbon shell as a highly active heterogeneous hydrogenation catalyst. Angewandte Chemie. 118 (42), 7221-7224 (2006).
- Mostafa, S., et al. Shape-dependent catalytic properties of Pt nanoparticles. Journal of the American Chemical Society. 132 (44), 15714-15719 (2010).
- van Deelen, T. W., Hernández Mejía, C., de Jong, K. P. Control of metal-support interactions in heterogeneous catalysts to enhance activity and selectivity. Nature Catalysis. 2 (11), 955-970 (2019).
- Rioux, R. M., Hsu, B. B., Grass, M. E., Song, H., Somorjai, G. A. Influence of particle size on reaction selectivity in cyclohexene hydrogenation and dehydrogenation over silica-supported monodisperse Pt particles. Catalysis Letters. 126 (1-2), 10-19 (2008).
- Somorjai, G. A., Carrazza, J. Structure sensitivity of catalytic reactions. Industrial & Engineering Chemistry Fundamentals. 25 (1), 63-69 (1986).
- Somorjai, G. A. Surface science. Science. 201 (4355), 489-497 (1978).
- Fu, Q., Wagner, T. Interaction of nanostructured metal overlayers with oxide surfaces. Surface Science Reports. 62 (11), 431-498 (2007).
- Siemer, M., Tomaschun, G., Klüner, T., Christopher, P., Al-Shamery, K. Insights into spectator-directed catalysis: CO adsorption on amine-capped platinum nanoparticles on oxide supports. ACS Applied Materials & Interfaces. 12 (24), 27765-27776 (2020).
- Jana, N. R., Peng, X. Single-phase and gram-scale routes toward nearly monodisperse Au and other noble metal nanocrystals. Journal of the American Chemical Society. 125 (47), 14280-14281 (2003).
- Fenske, D., et al. Colloidal synthesis of pt nanoparticles: on the formation and stability of nanowires. Langmuir. 24 (16), 9011-9016 (2008).
- Osmić, M., Kolny-Olesiak, J., Al-Shamery, K. Size control and shape evolution of single-twinned platinum nanocrystals in a room temperature colloidal synthesis. CrystEngComm. 16 (42), 9907-9914 (2014).
- Schrader, I., Warneke, J., Backenköhler, J., Kunz, S. Functionalization of platinum nanoparticles with L-proline: simultaneous enhancements of catalytic activity and selectivity. Journal of the American Chemical Society. 137 (2), 905-912 (2015).
- Maxted, E. B., Biggs, M. S. The catalytic toxicity of nitrogen compounds. Toxicity of ammonia and of amines. Journal of the Chemical Society. , 3844-3847 (1957).
- Aliaga, C., et al. Sum frequency generation and catalytic reaction studies of the removal of organic capping agents from Pt nanoparticles by UV−Ozone treatment. The Journal of Physical Chemistry C. 113 (15), 6150-6155 (2009).
- Comotti, M., Li, W. -. C., Spliethoff, B., Schüth, F. Support effect in high activity gold catalysts for CO oxidation. Journal of the American Chemical Society. 128 (3), 917-924 (2006).
- Gorin, D. J., Sherry, B. D., Toste, F. D. Ligand effects in homogeneous Au catalysis. Chemical Reviews. 108 (8), 3351-3378 (2008).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Selective hydrogenation of polyunsaturated fatty acids using alkanethiol self-assembled monolayer-coated Pd/Al2O3 catalysts. ACS Catalysis. 3 (9), 2041-2044 (2013).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Control of metal catalyst selectivity through specific noncovalent molecular interactions. Journal of the American Chemical Society. 136 (1), 520-526 (2014).
- Pang, S. H., Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Directing reaction pathways by catalyst active-site selection using self-assembled monolayers. Nature Communications. 4, 2448 (2013).
- Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Controlling the surface environment of heterogeneous catalysts using self-assembled monolayers. Accounts of Chemical Research. 47 (4), 1438-1445 (2014).
- Grimes, R. N. Small carborane ligands as spectators and as players. Journal of Organometallic Chemistry. 581 (1-2), 1-12 (1999).
- Crabtree, R. H. Multifunctional ligands in transition metal catalysis. New Journal of Chemistry. 35 (1), 18-23 (2011).
- Dostert, K. -. H., O’Brien, C. P., Ivars-Barceló, F., Schauermann, S., Freund, H. -. J. Spectators control selectivity in surface chemistry: Acrolein partial hydrogenation over Pd. Journal of the American Chemical Society. 137 (42), 13496-13502 (2015).
- Hu, L., et al. Catalytic conversion of biomass-derived carbohydrates into fuels and chemicals via furanic aldehydes. RSC Advances. 2 (30), 11184 (2012).
- Pushkarev, V. V., Musselwhite, N., An, K., Alayoglu, S., Somorjai, G. A. High structure sensitivity of vapor-phase furfural decarbonylation/hydrogenation reaction network as a function of size and shape of Pt nanoparticles. Nano Letters. 12 (10), 5196-5201 (2012).
- Liao, X. -. M., Pitchon, V., Cuong, P. -. H., Chu, W., Caps, V. Hydrogenation of cinnamaldehyde over bimetallic Au–Cu/CeO2 catalyst under a mild condition. Chinese Chemical Letters. 28 (2), 293-296 (2017).
- Fang, D., He, F., Xie, J., Xue, L. Calibration of binding energy positions with C1s for XPS results. Journal of Wuhan University of Technology-Materials Science Edition. 35 (4), 711-718 (2020).
- Heiz, U., Landman, U. . Nanocatalysis: With 14 tables. , (2008).
- Nyholm, R., Berndtsson, A., Martensson, N. Core level binding energies for the elements Hf to Bi (Z=72-83). Journal of Physics C: Solid State Physics. 13 (36), 1091-1096 (1980).
- Fu, X., Wang, Y., Wu, N., Gui, L., Tang, Y. Surface modification of small platinum nanoclusters with alkylamine and alkylthiol: An XPS study on the influence of organic ligands on the Pt 4f binding energies of small platinum nanoclusters. Journal of Colloid and Interface Science. 243 (2), 326-330 (2001).
- Ono, L. K., Yuan, B., Heinrich, H., Cuenya, B. R. Formation and thermal stability of platinum oxides on size-selected platinum nanoparticles: Support effects. The Journal of Physical Chemistry C. 114 (50), 22119 (2010).
- Bachmann, P., et al. Dehydrogenation of the Liquid Organic Hydrogen Carrier System Indole/Indoline/Octahydroindole on Pt(111). The Journal of Physical Chemistry C. 122 (8), 4470-4479 (2018).
- Mudiyanselage, K., Trenary, M. Adsorption and thermal decomposition of N-methylaniline on Pt(111). Surface Science. 603 (21), 3215-3221 (2009).
- Briggs, D., Beamson, G. Primary and secondary oxygen-induced C1s binding energy shifts in x-ray photoelectron spectroscopy of polymers. Analytical Chemistry. 64 (15), 1729-1736 (1992).
- Huang, M., Adnot, A., Suppiah, S., Kaliaguine, S. XPS observation of surface interaction between H2 and CO2 on platinum foil. Journal of Molecular Catalysis A: Chemical. 104 (2), 131-137 (1995).
- Mohrhusen, L., Osmić, M. Sterical ligand stabilization of nanocrystals versus electrostatic shielding by ionic compounds: a principle model study with TEM and XPS. RSC Advances. 7 (21), 12897-12907 (2017).
- Otero-Irurueta, G., et al. Adsorption and coupling of 4-aminophenol on Pt(111) surfaces. Surface Science. 646, 5-12 (2015).
- Erley, W., Xu, R., Hemminger, J. C. Thermal decomposition of trimethylamine on Pt(111): spectroscopic identification of surface intermediates. Surface Science. 389 (1-3), 272-286 (1997).
- Bridge, M. E., Somers, J. The adsorption of methylamine on Pt(111). Vacuum. 38 (4-5), 317-320 (1988).
- Chen, X., Mao, S. S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications. Chemical Reviews. 107 (7), 2891-2959 (2007).
- Madon, R. J., O’Connell, J. P., Boudart, M. Catalytic hydrogenation of cyclohexene: Part II. Liquid phase reaction on supported platinum in a gradientless slurry reactor. American Institute of Chemical Engineers Journal. 24 (5), 904-911 (1978).
- Pan, C. -. J., et al. Tuning/exploiting Strong Metal-Support Interaction (SMSI) in heterogeneous catalysis. Journal of the Taiwan Institute of Chemical Engineers. 74, 154-186 (2017).
- Lewera, A., Timperman, L., Roguska, A., Alonso-Vante, N. Metal–support interactions between nanosized Pt and metal oxides (WO 3 and TiO 2 ) studied using X-ray photoelectron spectroscopy. The Journal of Physical Chemistry C. 115 (41), 20153-20159 (2011).
- Ohyama, J., Yamamoto, A., Teramura, K., Shishido, T., Tanaka, T. Modification of metal nanoparticles with TiO2 and metal−support interaction in photodeposition. ACS Catalysis. 1 (3), 187-192 (2011).
- Zhong, J. -. Q., et al. Synchrotron-based ambient pressure X-ray photoelectron spectroscopy of hydrogen and helium. Applied Physics Letters. 112 (9), 91602 (2018).
- Günzler, H., Gremlich, H. -. U. . IR-Spektroskopie: Eine Einführung. , (2003).
- Hesse, M., Meier, H., Zeeh, B. . Spektroskopische Methoden in der organischen Chemie: 114 Tabellen. , (2012).
- Ripmeester, M., Duford, D. A., Yuan, S. Understanding the behaviour of dodecylamine as a model cationic collector in oil sands tailings dewatering applications using a novel FTIR based method. The Canadian Journal of Chemical Engineering. 98 (7), 1471-1482 (2020).
- Erdogdu, Y., Sertbakan, T. R., Güllüoğlu, M. T., Yurdakul, &. #. 3. 5. 0. ;., Güvenir, A. FT-IR and Raman spectroscopy and computation of 5-Methylfurfural. Journal of Applied Spectroscopy. 85 (3), 517-525 (2018).
- Kiss, &. #. 1. 9. 3. ;. I., Machytka, D., Bánki, J., Gál, M. Spectroscopic study of the conformational isomerism of 2-formylfuran derivatives. Journal of Molecular Structure. 197, 193-202 (1989).
- Allen, G., Bernstein, H. J. Internal rotation: VIII. The infrared and Raman spectra of furfural. Canadian Journal of Chemistry. 33 (6), 1055-1061 (1955).
- Thanh, N. T. K., Maclean, N., Mahiddine, S. Mechanisms of nucleation and growth of nanoparticles in solution. Chemical Reviews. 114 (15), 7610-7630 (2014).
- Tauster, S. J., Fung, S. C., Garten, R. L. Strong metal-support interactions. Group 8 noble metals supported on titanium dioxide. Journal of the American Chemical Society. 100 (1), 170-175 (1978).
- Beck, A., et al. The dynamics of overlayer formation on catalyst nanoparticles and strong metal-support interaction. Nature Communications. 11 (1), 3220 (2020).
- Sobota, M., et al. Ligand effects in SCILL model systems: site-specific interactions with Pt and Pd nanoparticles. Advanced Materials. 23 (2223), 2617-2621 (2011).
- Altmann, L., et al. Impact of organic ligands on the structure and hydrogenation performance of colloidally prepared bimetallic PtSn nanoparticles. ChemCatChem. 5 (7), 1803-1810 (2013).
- Modisha, P. M., Ouma, C. N. M., Garidzirai, R., Wasserscheid, P., Bessarabov, D. The prospect of hydrogen storage using liquid organic hydrogen carriers. Energy & Fuels. 33 (4), 2778-2796 (2019).
- Baker, L. R., et al. Furfuraldehyde hydrogenation on titanium oxide-supported platinum nanoparticles studied by sum frequency generation vibrational spectroscopy: acid-base catalysis explains the molecular origin of strong metal-support interactions. Journal of the American Chemical Society. 134 (34), 14208-14216 (2012).
- Kijeński, J., Winiarek, P., Paryjczak, T., Lewicki, A., Mikołajska, A. Platinum deposited on monolayer supports in selective hydrogenation of furfural to furfuryl alcohol. Applied Catalysis A: General. 233 (1-2), 171-182 (2002).
- Kijeński, J., Winiarek, P. Selective hydrogenation of α,β-unsaturated aldehydes over Pt catalysts deposited on monolayer supports. Applied Catalysis A: General. 193 (1-2), 1-4 (2000).
- Taylor, M. J., et al. Highly selective hydrogenation of furfural over supported Pt nanoparticles under mild conditions. Applied Catalysis B. 180, 580-585 (2016).

