التفاعلات الحفازة في جسيمات البلاتين النانوية المستقرة في الأمين والخالية من الليغاند المدعومة على تيتانيا أثناء هدرجة الألكينات والألدهيدات
Summary
يوضح هذا البروتوكول طريقة ملائمة لمقارنة الخصائص الحفازة لمحفزات البلاتين المدعومة ، التي يتم تصنيعها عن طريق ترسب الغرويات النانوية الحجم أو عن طريق التشريب. تعمل هدرجة السيكلوهيكسين كتفاعل نموذجي لتحديد النشاط الحفاز للمحفزات.
Abstract
تستخدم الليكاندات مثل الأمينات في نهج التوليف الغروي لحماية جسيمات البلاتين النانوية (Pt NP’s) من التكتل. عادة ، تتم إزالة الأربطة مثل الأمينات من خلال إجراءات ما قبل المعالجة المتنوعة قبل استخدامها في التحفيز غير المتجانس حيث تعتبر الأمينات سما محفزا. ومع ذلك ، غالبا ما يتم إهمال التأثير المفيد المحتمل لهذه المعدلات السطحية على تفاعلات الهدرجة ، وهو معروف من أنواع المتفرجين على الأسطح المعدنية.
لذلك ، تم استخدام جسيمات Pt النانوية Pt المثبتة بالأمين والتي تدعمها تيتانيا (P25) دون أي معالجة مسبقة من أجل توضيح التأثير المحتمل للرباط في تفاعلات هدرجة الطور السائل. تم التحقيق في النشاط الحفاز لجسيمات Pt النانوية Pt المثبتة في الأمين من حجمين مختلفين في مفاعل خزان تحريك مزدوج الجدران عند 69 درجة مئوية إلى 130 درجة مئوية وضغط هيدروجين 1 ATM. تم تحديد تحويل السيكلوهكسين إلى سيكلوهكسان بواسطة كروماتوغرافيا الغاز (GC) وتمت مقارنته بجسيمات Pt الخالية من الليغاند. تم فحص جميع المحفزات قبل وبعد التفاعل عن طريق التحليل الطيفي الإلكتروني للإرسال (TEM) والتحليل الطيفي للإلكترون الضوئي بالأشعة السينية (XPS) بحثا عن التغيرات المحتملة في الحجم والشكل والغلاف الليغاندي. كشفت هدرجة السيكلوهيكسين في الطور السائل عن تحويل أعلى لجسيمات Pt النانوية المثبتة في الأمين على تيتانيا مقارنة بالجسيمات الخالية من الليغاند. تم اختيار هدرجة 5-methylfurfural (5-MF) لتفاعل اختبار آخر ، لأن هدرجة α ، β ألدهيدات غير مشبعة أكثر تعقيدا وتظهر مسارات تفاعل مختلفة. ومع ذلك ، أثبت XPS والتحليل الطيفي بالأشعة تحت الحمراء (IR) أن 5-MF يعمل كسم محفز في ظروف التفاعل المحددة.
Introduction
المحفزات في حجم بضع ذرات مفردة تصل إلى جسيمات نانوية أكبر ذات نسب عالية من السطح إلى الحجم وأحجام محددة هي مواد واعدة لمجموعة واسعة من التفاعلات المحفزة غير المتجانسة ، مثل الهدرجة وإزالة الهيدروجين والتفاعلات المحفزة ضوئيا1. تستخدم جسيمات البلاتين النانوية على نطاق واسع في العمليات الصناعية ، بسبب النشاط العالي لهدرجة الأوليفينات. إلى جانب ذلك ، تعد جسيمات البلاتين النانوية محفزات واعدة للهدرجة الانتقائية α ، β الكيتونات غير المشبعة والألدهيدات1،2،3،4. هنا ، العديد من المعلمات مثل الحجم والشكل والدعم قادرة على التأثير على الخصائص التحفيزية1،5،6.
يؤثر الحجم على مورفولوجيا الجسيمات النانوية ، خاصة في حدود 1 إلى 5 نانومتر7. على وجه التحديد ، يؤثر الحجم على مواقع الامتزاز المتاحة (على سبيل المثال: الحواف أو الخطوات أو المدرجات) وبالتالي على السطح النشط بشكل محفز ، مما يؤثر بشكل أكبر على النشاط الحفاز7،8،9. علاوة على ذلك ، فإن الدعم قادر على التفاعل مع المعدن. تختلف هذه التفاعلات وتتراوح من عمليات نقل الشحنة أو الامتداد إلى تغيير في مورفولوجيا أو تغليف الجسيمات النانوية 6,10. في حين أن تأثير الحجم والشكل والدعم على الخصائص الحفازة معروف جيدا ، فإن التأثير المحتمل للممتزات غير المشاركة مباشرة في التفاعل ، ما يسمى جزيئات المتفرج أو معدلات السطح ، أقل تطورا1،5،6،11. في حالة اتباع نهج غرواني لإعداد المحفز ، باستخدام الجسيمات النانوية المعدنية الغروية التي يتم ترسيبها لاحقا على الدعم ، تعمل الأربطة على استقرار الجسيمات النانوية وبالتالي قد تؤثر على التفاعل.
الميزة الكبيرة للتخليق الغروي هي أنه يمكن إنتاج جسيمات نانوية ذات حجم وشكل معينين بطريقة مستهدفة تساعد على التحكم في الأداء الحفاز عبر طريق التوليف12،13،14. وظيفة الليكاند هي التحكم في حجم وشكل ومورفولوجيا الجسيمات النانوية. ومع ذلك ، غالبا ما تعتبر الليكاندات المشابهة للأمينات سما محفزا ، حيث تمنع الليكاندات مواقع الامتزاز المتاحة15,16. لذلك ، لزيادة النشاط الحفاز للمحفزات ، تتم إزالة الأربطة عادة عن طريق المعالجة المسبقة ، على سبيل المثال ، التكلس أو التحلل الناجم عن الأشعة فوق البنفسجية17,18.
هذا يقف على النقيض من التحفيز المتجانس ، حيث تكون الروابط ضرورية لتحقيق الاستقرار في مجمعات المعادن الانتقالية وضبط تفاعلها15,19. يتيح التفاعل بين الليغاند والمتفاعل التحكم في الانتقائية الكيميائية والانتقائية الانتقائية والنمطية للتفاعل المحفز المتجانس. نظرا لأن فصل المحفزات المتجانسة عن المنتجات ليس تافها ، فإن المحفزات غير المتجانسة أكثر شيوعا على الرغم من أنها أقل انتقائية والسؤال الذي يطرح نفسه هو ما إذا كان للروابط أيضا تأثير إيجابي على التحفيز غير المتجانس.
ومن النهج الواعد للروابط في الحفز غير المتجانس استخدام الطبقات الأحادية ذاتية التجميع التي تحتوي على ثيولات عطرية وأليفاتية لتحسين انتقائية هدرجة α β ألدهيدات غير مشبعة وأحماض دهنية متعددة غير مشبعة على الجسيمات النانوية Pt و Pd. يعتمد تعزيز الانتقائية على العديد من الآثار. تلعب التفاعلات المحددة بين المتفاعل والمعدل ، والحظر الانتقائي لبعض المواقع النشطة غير المرغوب فيها بالإضافة إلى التأثيرات الستيرية والإلكترونية دورا في تعزيز الانتقائية20،21،22،23. يتم التمييز بين الليغاند والمتفرجين. لا يشارك المتفرجون ، لكنهم يؤثرون على رد الفعل من خلال التأثيرات الستيرية ، بينما تشارك الأربطة في ردود الفعل24,25. يمكن تشكيل المتفرج أثناء التفاعل الحفاز أو عن طريق العمليات الكيميائية السابقة11,26.
يعد اختيار الرباط والمذيب المناسبين لهدرجة الطور السائل الناجح مهمة صعبة. يجب أن يكون للمذيب قابلية ذوبان عالية للهيدروجين وكذلك للمادة المتفاعلة. علاوة على ذلك ، لا ينبغي أن يكون هناك أي تفاعلات جانبية أو جانبية مع المذيب ، والتي يمكن أن تقلل من انتقائية التفاعل. يجب أن يكون للرباط المناسب امتزاز قوي في مواقع امتزاز مختارة بحيث يتم منع امتزاز الليجند في ظل ظروف التفاعل ، ولكن النشاط الحفاز لا يزال موجودا. من الناحية المثالية ، يمنع الليغاند مواقع الامتزاز ، التي تفضل التفاعلات الجانبية أو توجه انتقائية التفاعل من خلال المطالب الستيرية للرباط والتفاعلات مع المادة المتفاعلة15,21.
يوضح هذا العمل ما إذا كانت التأثيرات الستيريكية والإلكترونية لأمين دوديسيل (DDA) تؤثر على هدرجة السيكلوهيكسين و 5-methylfurfural (5-MF) أم لا. 5-MF ، وهو مشتق غير سام من furfural ، تم استخدامه كمتفاعل أكثر تعقيدا وإثارة للاهتمام تجاريا ، مقارنة بهدرجة السيكلوهيكسين. الهدرجة الانتقائية للفورفورال ، وهو منتج جانبي من إنتاج البترول الحيوي ، ومشتقات الفورفورال ذات أهمية صناعية حيث يمكن الحصول على هذه المركبات من الكتلة الحيوية وتمثل مكونات بداية واعدة لإنتاج العديد من المواد الكيميائية الدقيقة27,28.
ومع ذلك ، فإن الهدرجة الانتقائية تمثل تحديا ، لأن هدرجة الروابط المزدوجة للكربون ، ومجموعة الكربونيل تتنافس. من الناحية الديناميكية الحرارية ، يفضل هدرجة الروابط المزدوجة الكربونية ضد هدرجة مجموعة الكربونيل29.
Protocol
Representative Results
Discussion
تم تصنيع الجسيمات النانوية Pt المغطاة ب DDA بنجاح في حجمين وشكلين مختلفين12,14. تظهر الجسيمات النانوية الصغيرة Pt (1.6 نانومتر) شكلا شبه كروي في حين أن الجسيمات الأكبر (2.4 نانومتر) أكثر غير متماثلة تظهر جزئيا هياكل ثلاثية القوائم أو إهليلجية. تقتصر الاحتمالات على الحصول على جسيمات نانوية بلاتينية شبه كروية أكبر ، حيث يحدث تكوين هياكل ممدودة عن طريق زيادة حجم الجسيمات عن طريق النمو البذري14. يمكن أيضا أن يتأثر حجم وشكل الجسيمات بالرباط ووقت التفاعل ودرجة الحرارة. إلى جانب DDA ، يمكن استخدام روابط أخرى في التوليف ، لكن عامل السد يؤثر على النمو ، وبالتالي على حجم وشكل الجسيمات النانوية ، كما هو موضح بالفعل لتخليق جسيمات الذهب النانوية39. بعد إضافة محلول الاختزال إلى محلول الملح المعدني ، يتم تحريك المحلول لمدة 60 دقيقة (90 دقيقة لتخليق الجسيمات الأكبر) لضمان اكتمال عملية نمو الجسيمات النانوية Pt. يمكن أن يكون نقل المونومرات إلى سطح الجسيمات عاملا مقيدا. علاوة على ذلك ، يمكن أن تؤثر درجة الحرارة على نصف القطر الحرج ، والذي يصف الحد الأدنى من حجم الجسيمات المطلوبة ، حيث تكون البذور مستقرة في المحلول. عن طريق زيادة درجة الحرارة ، ينخفض نصف القطر الحرج ، مما يؤدي إلى تكوين أسرع للبذور وبالتالي انخفاض أسرع في تركيز المونومر55. بعد التوليف ، لا يزال من الممكن ملاحظة شوائب الأمونيوم والبروميد في XPS والتي يمكن القضاء عليها عن طريق إجراء تبادل الليغاند مع DDA. علاوة على ذلك ، تم ترسيب جميع الجسيمات النانوية المركبة على مساحيق P25 دون أي تغييرات في شكل أو حجم أو فقدان الليكاند. وللمقارنة، تم إنشاء محفز Pt خال من الليغاند باستخدام طريقة التشريب، التي تظهر حجم جسيمات نانوية Pt يبلغ 2.1 نانومتر وشكل شبه كروي. يكشف XPS كذلك أنه لم تكن أنواع Pt المعدنية موجودة على السطح فحسب ، بل كانت أيضا الأنواع المؤكسدة. هذا يشير إلى أنه في حالة عدم وجود روابط أمين ، تتفاعل جزيئات البلاتين النانوية مع الدعم ، مما قد يؤدي إلى تغليف جزئي للمعدن في الدعم10. ونتيجة لذلك، تفقد الجسيمات جزئيا قدرتها على تقسيم الهيدروجين56. ومع ذلك ، يفضل هذا التغليف عن طريق خفض درجة الحرارة العالية لسلائف الملح المعدنية. درجة الحرارة المستخدمة هنا للاختزال (180 درجة مئوية) أقل بكثير من تلك المذكورة في الأدبيات الخاصة بالتغليف (600 درجة مئوية)57. وهناك تفسير آخر أكثر ترجيحا يتمثل في التخفيض غير الكامل لمصدر Pt المستخدم. ومع ذلك ، فإن كلا التفسيرين يؤديان إلى تعطيل جزئي للمحفز.
في الأدب ، غالبا ما تعتبر الأربطة مثل الأمينات أو الأمونيا سما محفزا في الفهم الكلاسيكي للتحفيز غير المتجانس15,16. ومع ذلك ، فإن التحقيقات في هدرجة الطور السائل للسيكلوهكسين تظهر أن Pt / DDA / P25 لا يزال نشطا بشكل محفز وأظهر تحويلا أعلى مقارنة بالمحفز الخالي من الأمين. من المعروف أن الأمينات تمنع بشكل منهجي مواقع امتزاز التراس على Pt(111)11,58. وقد أظهرت النتائج في الأدبيات بالفعل ، أن هذا التأثير الواعد لاختيار الموقع النشط للروابط يمكن استخدامه لتحسين انتقائية هدرجة الأسيتيلين في تيارات غنية بالإيثيلين عن طريق تخفيف مواقع الامتزاز59. وقد لوحظ أيضا تأثير اختيار الموقع النشط هذا لارتباط الثيولات على Pd(111)22,23. بالنسبة لهدرجة السيكلوهكسين ، يتم حظر هذه المواقع بالفعل بواسطة الأمينات ، ومع ذلك ، لا تزال مراكز التفاعل غير المنسقة النشطة للغاية متاحة. بالإضافة إلى تأثير اختيار الموقع للرابطة ، ينبغي أيضا إيلاء الاهتمام للخصائص الأخرى للرابط. عند اختيار الليغاند ، يجب توخي الحذر للتأكد من أن الليغاند يستقر الجسيمات أثناء التوليف ويحميها من التكتل. علاوة على ذلك ، يجب أن يظهر الليغاند امتزازا قويا على سطح المعدن واستقرارا حراريا عاليا بما فيه الكفاية بحيث لا يتم امتصاص الليغاند أو تحلله في ظل ظروف التفاعل. تظهر النتائج أن DDA يبدو عموما مناسبا لهذا النهج الحفاز. لا يمكن ملاحظة أي تأثير للحجم في تفاعل النموذج. ومن المثير للاهتمام أن المحفز الذي يحتوي على جسيمات Pt النانوية التي لم تخضع لتبادل الليغاند أظهر تحويلا أقل (50٪) من جزيئات Pt المودعة على P25 بعد تبادل الليغاند (72٪). لذلك ، قد يتعين النظر في حجب المواقع النشطة بواسطة المركبات الأيونية في ظل هذه الظروف. يعد إجراء تبادل الليغاند أمرا بالغ الأهمية لزيادة نشاط جسيمات البلاتين النانوية عن طريق إزالة المركبات الأيونية الممتزة مثل البروميد والأمونيوم ، كما يظهر XPS قبل وبعد تبادل الليغاند.
بالإضافة إلى ذلك ، لا يزال تأثير الأنواع السطحية الإضافية على النشاط الحفاز لجسيمات البلاتين النانوية غامضا ، حيث يمكن أن يكون هذا النوع بمثابة مصدر هيدروجين إضافي موضعي. يبدو أن أطياف XP وأطياف FT-IR تشير إلى تجريد الهيدروجين لمجموعة الأمين بواسطة البلاتين مما يؤدي إلى أنواع إضافية من سطح الأمين. هذا يوفر الفرصة لخدمة الهيدروجين بالإضافة إلى الهيدروجين المذاب في التولوين ، والذي يمكن أن يؤثر على النشاط الحفاز. يمكن استبعاد تأثير مانح الهيدروجين من التولوين هنا لأن التولوين غير معروف بنزع الهيدروجين تحت ضغط الهيدروجين المنخفض ودرجة الحرارة60. ومع ذلك ، لا يزال تأثير استخراج الهيدروجين على النشاط الحفاز بحاجة إلى مزيد من التحقيق. وقد أظهرت هدرجة الأسيتوفينون على جسيمات البلاتين النانوية المعدلة بالبرولين L-proline بالفعل أن مجموعة الأمين يمكنها تسريع الهدرجة عن طريق نقل الهيدروجين من الأمين إلى المادة15 المتفاعلة. لذلك ، ينبغي النظر في التأثير المحتمل للأمين والأنواع السطحية على الهدرجة.
على الرغم من الاستخدام الناجح للجسيمات النانوية Pt/DDA لهدرجة الألكينات البسيطة، لا يمكن ملاحظة أي دوران للمادة المتفاعلة 5-MF الأكثر تطلبا. لذلك ، يمكن مناقشة الاحتمالات المختلفة لذلك في ما يلي: أحد التفسيرات هو أنه لا يحدث أي تفاعل بسبب انخفاض درجة حرارة التفاعل وضغط الهيدروجين. اقتصرت درجة حرارة التفاعل على 160 درجة مئوية. كما أظهر التحليل الحراري الوزني أن امتزاز وتحلل الجسيمات النانوية Pt / DDA ذات الأحجام المماثلة يحدث في درجات الحرارة هذه13. بسبب المفاعل المستخدم ، لا يمكن استخدام ضغوط أعلى من 1 atm من الهيدروجين. قد يكون انخفاض ضغط الهيدروجين على النقيض من التجارب الأدبية هو السبب في أن هدرجة مركبات الكربونيل ، مثل 5-MF ، لم تكن مجدية. وقد أظهرت العديد من الدراسات أيضا أن تفاعلات دعم المعادن القوية (SMSI) ضرورية لانتقائية هدرجة الطور الغازي للفورفورال61،62،63. يؤدي SMSI إلى تكوين وظائف شاغرة O ، مما يتيح امتزاز الفورفورال عبر مجموعة الكربونيل على سطح تيتانيا. يتم تشكيل فورفوريل أوكسي وسيط يمكن هجرته. ومع ذلك ، فإن هذه الفرضية تقابلها حقيقة أنه ، على عكس تجارب الطور الغازي ، لا يمكن العثور على أي دليل على تأثير SMSI لهدرجة الطور السائل للفورفورال في الميثانول. أظهرت جزيئات البلاتين على أكاسيد مختلفة (MgO و CeO 2 و Al2O3) خصائص حفازة مماثلة64. وهذا يشير إلى أن الهدرجة يمكن أن تحدث بآليات مختلفة في مرحلة السائل والغاز، الأمر الذي يحتاج إلى مزيد من التحقيق. لوحظ تأثير SMSI لجسيمات Pt والدعم فقط للمحفز الخالي من الليغاند ، والذي لا يظهر أيضا أي تحويل ل 5-MF في ظل ظروف التفاعل المستخدمة. لذلك يبدو تأثير تأثير SMSI غير مرجح. نظرا لأن تسمم المحفز بواسطة 5-MF أو سطح وسيط يبدو أكثر احتمالا في ظل ظروف التفاعل المطبقة ، فقد تم تحليل المحفزات بشكل أكبر قبل وبعد تبادل الليغاند مع 5-MF تحت ظروف التفاعل بواسطة XPS و FT-IR. أكدت هذه القياسات فرضية التسمم بالمحفز بواسطة 5-MF حيث تظهر كلتا الطريقتين انخفاضا في القمم المقابلة للأمين على سطح Pt. كما يلمح التحليل الطيفي FT-IR إلى أن 5-MF يعمل كسم محفز لأن النطاقات تظهر في منطقة الرقم الموجي أقل من 1200 سم-1 ، والتي تتوافق مع النطاقات المخصصة ل 5-MF. يقترح إجراء هندسة امتزاز مسطحة تقريبا مع مراعاة قواعد تحديد السطح. ويبين الشكل 8 رسما تخطيطيا لإعادة الهيكلة السطحية المقترحة.
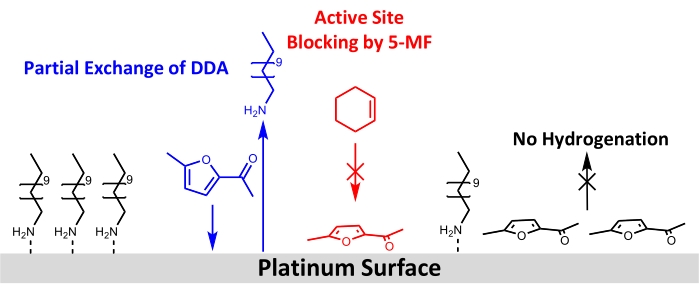
الشكل 8: رسم تخطيطي للتغيرات الهيكلية بإضافة 5-MF إلى هدرجة السيكلوهيكسين على سطح الجسيمات النانوية البلاتينية المستقرة أمين. تظهر النتائج من FT-IR و XPS تبادلا جزئيا ل DDA بواسطة 5-MF على سطح البلاتين وحجب المواقع النشطة لهدرجة السيكلوهيكسين. تشير نتائج بيانات FT-IR إلى امتزاز حلقة 5-MF موازية تقريبا للسطح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
في الختام ، تعد جسيمات Pt النانوية المغطاة بالأمين على P25 مرشحة واعدة لمحفزات الهدرجة الجديدة حيث تظهر الجسيمات النانوية Pt تحويلا أعلى من المحفز الخالي من الليغاند في تفاعل النموذج. ومع ذلك ، لم يلاحظ أي تحويل ل 5-MF على أي من المحفزين. ينتج هذا عن تسمم Pt بواسطة المادة المتفاعلة وليس بواسطة الرباط كما هو موضح في الأدبيات في ظل ظروف التفاعل التي تم التحقيق فيها. بالنسبة للتطبيقات المستقبلية ، هناك حاجة إلى مزيد من الفهم لتأثير الأربطة على سلوك الامتزاز للمواد المتفاعلة وتفاعلها مع الجسيمات النانوية المعدنية. التوليف الغروي هو نهج واعد إلى جانب طرق التشريب والتكلس لتصنيع المحفزات غير المتجانسة ، لأن هذا يسمح بتخليق الجسيمات النانوية في حجم وشكل محددين. نظرا لأن نهج التوليف الغروي يسمح باستخدام أربطة مختلفة ، على سبيل المثال ، الأمينات أو الأميدات أو الثيولات أو الكحول ، يجب التحقيق في الجسيمات النانوية Pt مع الأربطة الأخرى ومقارنتها. وهذا يوفر إمكانية استخدام الليكاندات ، التي تظهر تفاعلا محددا بين الليغاند وتفاعل ، مثل التفاعلات π-π للتحكم في هندسة الامتزاز وبالتالي أيضا انتقائية التفاعل. يمكن استخدام هذا النهج للهدرجة الانتقائية للكيتونات α β غير المشبعة والألدهيدات ، كما هو موضح بالفعل لهدرجة سينامالدهيد21. وعلاوة على ذلك، فإن السيطرة على الانتقائية النمطية في التفاعلات المحفزة غير المتجانسة لا تزال مهمة صعبة؛ ومع ذلك ، يمكن استخدام رباط دائري مناسب للتحكم في دوران المنتج كما هو الحال في التفاعلات المحفزة المتجانسة. إلى جانب التفاعلات بين الليغاند والمادة المتفاعلة، يمكن استخدام تأثير الاستقرار للروابط لحماية الجسيمات النانوية المعدنية من تفاعل دعم المعادن القوي. من شأن تفاعل دعم المعادن القوي أن يقلل من الامتصاص الكيميائي للهيدروجين عن طريق تغليف الجسيمات بطبقة أكسيد. لفهم أفضل لتأثير الأربطة ، يمكن أن يوفر XPS و FT-IR معلومات مفيدة حول تأثير التسمم الانتقائي وطرق ربط الأربطة. وعلاوة على ذلك، يعتبر ثاني أكسيد الكربون جزيء استشعار لتحديد المواقع السطحية المتاحة للجسيم النانوي Pt. بالإضافة إلى ذلك ، يمكن التحقيق في سلوك الامتزاز والتفاعلات السطحية المحتملة للروابط والمواد المتفاعلة على بلورات Pt المفردة تحت ظروف فراغ عالية للغاية للحصول على فهم أساسي للعمليات السطحية. بشكل عام ، يمكن أن تقدم الروابط في التحفيز غير المتجانس نهجا حفازا جديدا ، والذي يمكن استخدامه للتحكم في نشاط وانتقائية التفاعل المحفز إلى جانب حجم الجسيمات وتأثيرات الدعم. لذلك ، ينبغي إعادة النظر في طريقة التفكير التقليدية للتحفيز غير المتجانس للروابط كسم محفز.
Disclosures
The authors have nothing to disclose.
Acknowledgements
نتوجه بالشكر إلى إديث كيسيلهورست وإرهارد رايل على الدعم في TEM وإلى كارستن دوشه على الدعم في XPS. شكرا لستيفان بيتراش على دعمه مع كروماتوغراف الغاز. يتم الاعتراف بتمويل جهاز XPS من قبل DFG (INST: 184/144-1FUGG) والتمويل من DFG-RTG 2226.
Materials
| 2-propanol | Sigma Aldrich | 59300-2.5L | puriss. p. a., ACS reagent, >99.8% |
| 4-methyl-2-pentanol | Carl Roth | 4371.2 | purity: >99%, for synthesis |
| 5-methylfurfural | Sigma Aldrich | 137316-100G | ReagentPlus, 99 % |
| acetone | Sigma Aldrich | 32201-2,5L-M | puriss. p. a., ACS reagent, >99.5% |
| cannula | B Braun | 4665643 | diameter: 0.80 mm, length: 120 mm |
| CasaXPS | Casa Software | software, version 2.3.15 | |
| centrifuge | Heraeus | model: Multifuge 1s | |
| centrifuge tube | Schott Duran | 163-9315026 | volume: 80 mL, diameter: 44 mm, length: 100 mm |
| chloroplatinic acid hexahydrate | Merck | 8073400001 | amount of platinum: 40 % |
| column | Agilent Technologies | 19091 S-001 | model: HP-PONA, film: dimethyl polysiloxane, film thickness: 0.2 µm, length: 50 m |
| CRYSTAL 17 | CRYSTAL Theoretical Chemistry Group Torino | software, version: v1.0.2 | |
| crystallizing dish | volume: 50 mL | ||
| cyclohexene | Acros Organics | 154840010 | purity: 99 % |
| desposable syringe | Henke Sass Wolff | Norm-Ject, volume: 1, 2, 5 mL | |
| didodecyldimethylammonium bromide | Acros Organics | 407120250 | purity: 99 % |
| diisopropyl ether | Carl Roth | T899.1 | purity: 98%, for synthesis |
| dodecyl amine | Sigma Aldrich | D222208-500ML | purity: 98 % |
| double walled tank reactor | processed by glass blower | Standard ground glass joint sleeves: 2 x 14/23, 1 x 19/26, 1 x 29/32, reactor volume: 150 mL, material: quartz glas, with outer heating jacket | |
| Fourier-transform infrared spectrometer | Bruker | model: Equinox 55 | |
| rubber balloon | Deutsch & Neumann | 163-7652667 | volume: 4 L, material: latex, |
| gaschromatograph | Agilent Technologies | model: 7820A | |
| HP-PONA-column | Agilent Technologies | 19091S-001 | length: 50 m, film thickness: 0.5 µm, inner diameter: 0.2 mm |
| hydrogen | Air Liquide | P0231L50R2A001 | purity: 5.0 |
| ImageJ | Wayne Rasband | software, version 1.52 | |
| methanol | Sigma Aldrich | 32213-2,5L-M | puriss. p. a., ACS reagent, >99.8% |
| n-hexane | VWR Chemicals | 24577298 | purity: 99 % |
| Opus | Bruker | software, version 5.5 | |
| pasteur pipette | Brand | 747715 | material: glass, length: 145 mm, inside diameter: 1 mm |
| pipette ball | Technikplaza | 89005517 | diameter: 94 mm, material: PVC |
| platinum(IV) chloride | Acros Organics | 195400010 | purity: 99 % |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 005 | volume: 100-1000 µL |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 001 | volume: 0.5-10 µL |
| potassium bromide | Carl Roth | 9252.1 | purity: >98% |
| reflux condenser | neoLab | LZ-1197 | length: 160 mm, NS 14/23 |
| rolled rim glass | VWR Chemicals | 548-0625 | volume: 10 mL |
| round neck flask | Carl Roth | HY50.1 | volume: 10 mL, NS 14/23 |
| rubber septum | Carl Roth | EE04.1 | material: silicone, NS 14/23 |
| syringe filter | Agilent Technologies | 5190-5267 | Captiva Econofilter, pore size 0.2 µm, PTFE menbrane |
| syringe pump | Landgraf Laborsysteme HLL | 106720180 | model: LA180A |
| TEM grid | Plano | diameter: 3.05 mm, 300 mesh, covered with formvar and coal | |
| temperature programmed oven | Nabertherm | model: L5, voltage: 230 V, power: 2.4 kW, controler: C6 | |
| tetrabutylammonium borohydride | Sigma Aldrich | 230170-10G | purity: 98 % |
| three neck round bottom flask | Carl Roth | KY19.1 | volume: 100 mL, NS 14/23, 14/23 |
| Titania P25 | Acros Organics | 384292500 | purity: 99 % |
| toluene | VWR Chemicals | 32249-1L-M | puriss. p. a., ACS reagent, >99.7% |
| transition piece | Carl Roth | with core and stop cock, straight tubing olive, 29/32 | |
| transmission electron microscope | Zeiss | model: 900N | |
| ultrasonic bath | Bandelin | 305 | model: RK 156, volume: 6 L |
| volumetric pipette | Brand | 29718 | volume: 50 mL |
| X-ray photoelectron spectrometer | Thermo Fisher | model: ESCALAB 250 xi |
References
- Liu, L., Corma, A. Metal catalysts for heterogeneous catalysis: From single atoms to nanoclusters and nanoparticles. Chemical Reviews. 118 (10), 4981-5079 (2018).
- Zakarina, N., Bekturov, E. Platinum nanoparticles stabilized by polyvinylpyrrolidone for hydrogenation. Chinese Journal of Catalysis. 29 (11), 1165-1168 (2008).
- Rioux, R. M., et al. Monodisperse platinum nanoparticles of well-defined shape: synthesis, characterization, catalytic properties and future prospects. Topics in Catalysis. 39 (3-4), 167-174 (2006).
- Ikeda, S., et al. Ligand-free platinum nanoparticles encapsulated in a hollow porous carbon shell as a highly active heterogeneous hydrogenation catalyst. Angewandte Chemie. 118 (42), 7221-7224 (2006).
- Mostafa, S., et al. Shape-dependent catalytic properties of Pt nanoparticles. Journal of the American Chemical Society. 132 (44), 15714-15719 (2010).
- van Deelen, T. W., Hernández Mejía, C., de Jong, K. P. Control of metal-support interactions in heterogeneous catalysts to enhance activity and selectivity. Nature Catalysis. 2 (11), 955-970 (2019).
- Rioux, R. M., Hsu, B. B., Grass, M. E., Song, H., Somorjai, G. A. Influence of particle size on reaction selectivity in cyclohexene hydrogenation and dehydrogenation over silica-supported monodisperse Pt particles. Catalysis Letters. 126 (1-2), 10-19 (2008).
- Somorjai, G. A., Carrazza, J. Structure sensitivity of catalytic reactions. Industrial & Engineering Chemistry Fundamentals. 25 (1), 63-69 (1986).
- Somorjai, G. A. Surface science. Science. 201 (4355), 489-497 (1978).
- Fu, Q., Wagner, T. Interaction of nanostructured metal overlayers with oxide surfaces. Surface Science Reports. 62 (11), 431-498 (2007).
- Siemer, M., Tomaschun, G., Klüner, T., Christopher, P., Al-Shamery, K. Insights into spectator-directed catalysis: CO adsorption on amine-capped platinum nanoparticles on oxide supports. ACS Applied Materials & Interfaces. 12 (24), 27765-27776 (2020).
- Jana, N. R., Peng, X. Single-phase and gram-scale routes toward nearly monodisperse Au and other noble metal nanocrystals. Journal of the American Chemical Society. 125 (47), 14280-14281 (2003).
- Fenske, D., et al. Colloidal synthesis of pt nanoparticles: on the formation and stability of nanowires. Langmuir. 24 (16), 9011-9016 (2008).
- Osmić, M., Kolny-Olesiak, J., Al-Shamery, K. Size control and shape evolution of single-twinned platinum nanocrystals in a room temperature colloidal synthesis. CrystEngComm. 16 (42), 9907-9914 (2014).
- Schrader, I., Warneke, J., Backenköhler, J., Kunz, S. Functionalization of platinum nanoparticles with L-proline: simultaneous enhancements of catalytic activity and selectivity. Journal of the American Chemical Society. 137 (2), 905-912 (2015).
- Maxted, E. B., Biggs, M. S. The catalytic toxicity of nitrogen compounds. Toxicity of ammonia and of amines. Journal of the Chemical Society. , 3844-3847 (1957).
- Aliaga, C., et al. Sum frequency generation and catalytic reaction studies of the removal of organic capping agents from Pt nanoparticles by UV−Ozone treatment. The Journal of Physical Chemistry C. 113 (15), 6150-6155 (2009).
- Comotti, M., Li, W. -. C., Spliethoff, B., Schüth, F. Support effect in high activity gold catalysts for CO oxidation. Journal of the American Chemical Society. 128 (3), 917-924 (2006).
- Gorin, D. J., Sherry, B. D., Toste, F. D. Ligand effects in homogeneous Au catalysis. Chemical Reviews. 108 (8), 3351-3378 (2008).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Selective hydrogenation of polyunsaturated fatty acids using alkanethiol self-assembled monolayer-coated Pd/Al2O3 catalysts. ACS Catalysis. 3 (9), 2041-2044 (2013).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Control of metal catalyst selectivity through specific noncovalent molecular interactions. Journal of the American Chemical Society. 136 (1), 520-526 (2014).
- Pang, S. H., Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Directing reaction pathways by catalyst active-site selection using self-assembled monolayers. Nature Communications. 4, 2448 (2013).
- Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Controlling the surface environment of heterogeneous catalysts using self-assembled monolayers. Accounts of Chemical Research. 47 (4), 1438-1445 (2014).
- Grimes, R. N. Small carborane ligands as spectators and as players. Journal of Organometallic Chemistry. 581 (1-2), 1-12 (1999).
- Crabtree, R. H. Multifunctional ligands in transition metal catalysis. New Journal of Chemistry. 35 (1), 18-23 (2011).
- Dostert, K. -. H., O’Brien, C. P., Ivars-Barceló, F., Schauermann, S., Freund, H. -. J. Spectators control selectivity in surface chemistry: Acrolein partial hydrogenation over Pd. Journal of the American Chemical Society. 137 (42), 13496-13502 (2015).
- Hu, L., et al. Catalytic conversion of biomass-derived carbohydrates into fuels and chemicals via furanic aldehydes. RSC Advances. 2 (30), 11184 (2012).
- Pushkarev, V. V., Musselwhite, N., An, K., Alayoglu, S., Somorjai, G. A. High structure sensitivity of vapor-phase furfural decarbonylation/hydrogenation reaction network as a function of size and shape of Pt nanoparticles. Nano Letters. 12 (10), 5196-5201 (2012).
- Liao, X. -. M., Pitchon, V., Cuong, P. -. H., Chu, W., Caps, V. Hydrogenation of cinnamaldehyde over bimetallic Au–Cu/CeO2 catalyst under a mild condition. Chinese Chemical Letters. 28 (2), 293-296 (2017).
- Fang, D., He, F., Xie, J., Xue, L. Calibration of binding energy positions with C1s for XPS results. Journal of Wuhan University of Technology-Materials Science Edition. 35 (4), 711-718 (2020).
- Heiz, U., Landman, U. . Nanocatalysis: With 14 tables. , (2008).
- Nyholm, R., Berndtsson, A., Martensson, N. Core level binding energies for the elements Hf to Bi (Z=72-83). Journal of Physics C: Solid State Physics. 13 (36), 1091-1096 (1980).
- Fu, X., Wang, Y., Wu, N., Gui, L., Tang, Y. Surface modification of small platinum nanoclusters with alkylamine and alkylthiol: An XPS study on the influence of organic ligands on the Pt 4f binding energies of small platinum nanoclusters. Journal of Colloid and Interface Science. 243 (2), 326-330 (2001).
- Ono, L. K., Yuan, B., Heinrich, H., Cuenya, B. R. Formation and thermal stability of platinum oxides on size-selected platinum nanoparticles: Support effects. The Journal of Physical Chemistry C. 114 (50), 22119 (2010).
- Bachmann, P., et al. Dehydrogenation of the Liquid Organic Hydrogen Carrier System Indole/Indoline/Octahydroindole on Pt(111). The Journal of Physical Chemistry C. 122 (8), 4470-4479 (2018).
- Mudiyanselage, K., Trenary, M. Adsorption and thermal decomposition of N-methylaniline on Pt(111). Surface Science. 603 (21), 3215-3221 (2009).
- Briggs, D., Beamson, G. Primary and secondary oxygen-induced C1s binding energy shifts in x-ray photoelectron spectroscopy of polymers. Analytical Chemistry. 64 (15), 1729-1736 (1992).
- Huang, M., Adnot, A., Suppiah, S., Kaliaguine, S. XPS observation of surface interaction between H2 and CO2 on platinum foil. Journal of Molecular Catalysis A: Chemical. 104 (2), 131-137 (1995).
- Mohrhusen, L., Osmić, M. Sterical ligand stabilization of nanocrystals versus electrostatic shielding by ionic compounds: a principle model study with TEM and XPS. RSC Advances. 7 (21), 12897-12907 (2017).
- Otero-Irurueta, G., et al. Adsorption and coupling of 4-aminophenol on Pt(111) surfaces. Surface Science. 646, 5-12 (2015).
- Erley, W., Xu, R., Hemminger, J. C. Thermal decomposition of trimethylamine on Pt(111): spectroscopic identification of surface intermediates. Surface Science. 389 (1-3), 272-286 (1997).
- Bridge, M. E., Somers, J. The adsorption of methylamine on Pt(111). Vacuum. 38 (4-5), 317-320 (1988).
- Chen, X., Mao, S. S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications. Chemical Reviews. 107 (7), 2891-2959 (2007).
- Madon, R. J., O’Connell, J. P., Boudart, M. Catalytic hydrogenation of cyclohexene: Part II. Liquid phase reaction on supported platinum in a gradientless slurry reactor. American Institute of Chemical Engineers Journal. 24 (5), 904-911 (1978).
- Pan, C. -. J., et al. Tuning/exploiting Strong Metal-Support Interaction (SMSI) in heterogeneous catalysis. Journal of the Taiwan Institute of Chemical Engineers. 74, 154-186 (2017).
- Lewera, A., Timperman, L., Roguska, A., Alonso-Vante, N. Metal–support interactions between nanosized Pt and metal oxides (WO 3 and TiO 2 ) studied using X-ray photoelectron spectroscopy. The Journal of Physical Chemistry C. 115 (41), 20153-20159 (2011).
- Ohyama, J., Yamamoto, A., Teramura, K., Shishido, T., Tanaka, T. Modification of metal nanoparticles with TiO2 and metal−support interaction in photodeposition. ACS Catalysis. 1 (3), 187-192 (2011).
- Zhong, J. -. Q., et al. Synchrotron-based ambient pressure X-ray photoelectron spectroscopy of hydrogen and helium. Applied Physics Letters. 112 (9), 91602 (2018).
- Günzler, H., Gremlich, H. -. U. . IR-Spektroskopie: Eine Einführung. , (2003).
- Hesse, M., Meier, H., Zeeh, B. . Spektroskopische Methoden in der organischen Chemie: 114 Tabellen. , (2012).
- Ripmeester, M., Duford, D. A., Yuan, S. Understanding the behaviour of dodecylamine as a model cationic collector in oil sands tailings dewatering applications using a novel FTIR based method. The Canadian Journal of Chemical Engineering. 98 (7), 1471-1482 (2020).
- Erdogdu, Y., Sertbakan, T. R., Güllüoğlu, M. T., Yurdakul, &. #. 3. 5. 0. ;., Güvenir, A. FT-IR and Raman spectroscopy and computation of 5-Methylfurfural. Journal of Applied Spectroscopy. 85 (3), 517-525 (2018).
- Kiss, &. #. 1. 9. 3. ;. I., Machytka, D., Bánki, J., Gál, M. Spectroscopic study of the conformational isomerism of 2-formylfuran derivatives. Journal of Molecular Structure. 197, 193-202 (1989).
- Allen, G., Bernstein, H. J. Internal rotation: VIII. The infrared and Raman spectra of furfural. Canadian Journal of Chemistry. 33 (6), 1055-1061 (1955).
- Thanh, N. T. K., Maclean, N., Mahiddine, S. Mechanisms of nucleation and growth of nanoparticles in solution. Chemical Reviews. 114 (15), 7610-7630 (2014).
- Tauster, S. J., Fung, S. C., Garten, R. L. Strong metal-support interactions. Group 8 noble metals supported on titanium dioxide. Journal of the American Chemical Society. 100 (1), 170-175 (1978).
- Beck, A., et al. The dynamics of overlayer formation on catalyst nanoparticles and strong metal-support interaction. Nature Communications. 11 (1), 3220 (2020).
- Sobota, M., et al. Ligand effects in SCILL model systems: site-specific interactions with Pt and Pd nanoparticles. Advanced Materials. 23 (2223), 2617-2621 (2011).
- Altmann, L., et al. Impact of organic ligands on the structure and hydrogenation performance of colloidally prepared bimetallic PtSn nanoparticles. ChemCatChem. 5 (7), 1803-1810 (2013).
- Modisha, P. M., Ouma, C. N. M., Garidzirai, R., Wasserscheid, P., Bessarabov, D. The prospect of hydrogen storage using liquid organic hydrogen carriers. Energy & Fuels. 33 (4), 2778-2796 (2019).
- Baker, L. R., et al. Furfuraldehyde hydrogenation on titanium oxide-supported platinum nanoparticles studied by sum frequency generation vibrational spectroscopy: acid-base catalysis explains the molecular origin of strong metal-support interactions. Journal of the American Chemical Society. 134 (34), 14208-14216 (2012).
- Kijeński, J., Winiarek, P., Paryjczak, T., Lewicki, A., Mikołajska, A. Platinum deposited on monolayer supports in selective hydrogenation of furfural to furfuryl alcohol. Applied Catalysis A: General. 233 (1-2), 171-182 (2002).
- Kijeński, J., Winiarek, P. Selective hydrogenation of α,β-unsaturated aldehydes over Pt catalysts deposited on monolayer supports. Applied Catalysis A: General. 193 (1-2), 1-4 (2000).
- Taylor, M. J., et al. Highly selective hydrogenation of furfural over supported Pt nanoparticles under mild conditions. Applied Catalysis B. 180, 580-585 (2016).

