Réactions catalytiques sur des nanoparticules de platine stabilisées aux amines et sans ligands soutenues sur Titania pendant l’hydrogénation d’alcènes et d’aldéhydes
Summary
Ce protocole montre une méthode pratique pour comparer les propriétés catalytiques des catalyseurs de platine supportés, synthétisés par dépôt de colloïdes de taille nanométrique ou par imprégnation. L’hydrogénation du cyclohexène sert de réaction modèle pour déterminer l’activité catalytique des catalyseurs.
Abstract
Les ligands comme les amines sont utilisés dans l’approche de synthèse colloïdale pour protéger les nanoparticules de platine (Pt NP) de l’agglomération. Normalement, les ligands comme les amines sont éliminés par diverses procédures de prétraitement avant d’être utilisés en catalyse hétérogène, car les amines sont considérées comme un poison catalyseur. Cependant, une influence bénéfique possible de ces modificateurs de surface sur les réactions d’hydrogénation, qui est connue des espèces spectatrices sur les surfaces métalliques, est souvent négligée.
Par conséquent, des nanoparticules de Pt stabilisées aux amines soutenues par le titane (P25) ont été utilisées sans aucun prétraitement afin d’élucider une influence possible du ligand dans les réactions d’hydrogénation en phase liquide. L’activité catalytique de nanoparticules de Pt stabilisées aux amines de deux tailles différentes a été étudiée dans un réacteur à double paroi à cuve d’agitation à 69 °C à 130 °C et à une pression d’hydrogène de 1 atm. La conversion du cyclohexène en cyclohexane a été déterminée par chromatographie en phase gazeuse (CG) et a été comparée à des particules de Pt sans ligand. Tous les catalyseurs ont été vérifiés avant et après la réaction par spectroscopie électronique à transmission (MET) et spectroscopie photoélectronique à rayons X (XPS) pour détecter d’éventuels changements de taille, de forme et de couche de ligand. L’hydrogénation du cyclohexène en phase liquide a révélé une conversion plus élevée des nanoparticules de Pt stabilisées aux amines sur le titane que des particules sans ligand. L’hydrogénation du 5-méthylfurfural (5-MF) a été choisie pour une réaction d’essai supplémentaire, car l’hydrogénation des aldéhydes α β-insaturés est plus complexe et présente diverses voies de réaction. Cependant, le XPS et la spectroscopie infrarouge (IR) ont prouvé que le 5-MF agit comme poison catalyseur dans les conditions de réaction données.
Introduction
Des catalyseurs de la taille de quelques atomes simples jusqu’à des nanoparticules plus grosses avec des rapports surface/volume élevés et des tailles définies sont des matériaux prometteurs pour un large éventail de réactions catalysées hétérogènes, telles que l’hydrogénation, la déshydrogénation et les réactions photocatalytiques1. Les nanoparticules de platine sont largement utilisées dans les procédés industriels, en raison de leur forte activité d’hydrogénation des oléfines. En outre, les nanoparticules de platine sont des catalyseurs prometteurs pour l’hydrogénation sélective des α,β-cétones insaturées et des aldéhydes 1,2,3,4. Ici, plusieurs paramètres tels que la taille, la forme et le support sont capables d’affecter les propriétés catalytiques 1,5,6.
La taille influence la morphologie des nanoparticules, en particulier dans la gamme de 1 à 5 nm7. Plus précisément, la taille influence les sites d’adsorption disponibles (par exemple: bords, marches ou terrasses) et donc la surface catalytiquement active, ce qui influence davantage l’activité catalytique 7,8,9. De plus, le support est capable d’interagir avec le métal. Ces interactions varient et vont des processus de transfert de charge ou de débordement à une modification de la morphologie ou de l’encapsulation des nanoparticules 6,10. Alors que l’effet de la taille, de la forme et du support sur les propriétés catalytiques est bien connu, un effet possible des adsorbats non directement impliqués dans la réaction, appelés molécules spectatrices ou modificateurs de surface, est moins évolué 1,5,6,11. Dans le cas d’une approche colloïdale pour la préparation du catalyseur, en utilisant des nanoparticules métalliques colloïdales qui sont ensuite déposées sur le support, les ligands stabilisent les nanoparticules et peuvent donc potentiellement influencer la réaction.
Le grand avantage de la synthèse colloïdale est que des nanoparticules d’une certaine taille et forme peuvent être produites de manière ciblée en aidant à contrôler les performances catalytiques via la voie de synthèse12,13,14. La fonction du ligand est de contrôler la taille, la forme et la morphologie des nanoparticules. Cependant, les ligands similaires aux amines sont souvent considérés comme un poison catalyseur, car les ligands bloquent les sites d’adsorption disponibles15,16. Par conséquent, pour augmenter l’activité catalytique des catalyseurs, les ligands sont généralement éliminés par prétraitement, par exemple la calcination ou la décomposition induite par la lumière UV17,18.
Cela contraste avec la catalyse homogène, où les ligands sont essentiels pour stabiliser les complexes de métaux de transition et ajuster leur réactivité15,19. L’interaction entre le ligand et le réactif permet de contrôler la chimiosélectivité, la régiosélectivité et la stéréosélectivité de la réaction catalysée de manière homogène. Comme la séparation des catalyseurs homogènes des produits n’est pas triviale, les catalyseurs hétérogènes sont plus courants bien qu’ils soient moins sélectifs et la question se pose alors de savoir si les ligands ont également un effet positif sur la catalyse hétérogène.
Une approche prometteuse pour les ligands en catalyse hétérogène est l’utilisation de monocouches auto-assemblées contenant des thiols aromatiques et aliphatiques pour améliorer la sélectivité pour l’hydrogénation des aldéhydes α,β-insaturés et des acides gras polyinsaturés sur les nanoparticules Pt et. L’amélioration de la sélectivité repose sur plusieurs effets. Les interactions spécifiques entre le réactif et le modificateur, le blocage sélectif de certains sites actifs indésirables ainsi que les effets stériques et électroniques jouent un rôle dans l’amélioration de la sélectivité20,21,22,23. Une distinction est faite entre les ligands et les spectateurs. Les spectateurs ne participent pas, mais influencent la réaction par des effets stériques, tandis que les ligands sont impliqués dans les réactions24,25. Un spectateur peut se former lors d’une réaction catalytique ou par des procédés chimiques préalables11,26.
Le choix d’un ligand et d’un solvant appropriés pour une hydrogénation en phase liquide réussie est une tâche difficile. Le solvant doit avoir une solubilité élevée pour l’hydrogène ainsi que pour le réactif. En outre, il ne devrait pas y avoir de réactions suivantes ou secondaires avec le solvant, ce qui peut réduire la sélectivité de la réaction. Un ligand approprié doit avoir une forte adsorption sur des sites d’adsorption sélectionnés afin d’empêcher la désorption du ligand dans des conditions de réaction, mais une activité catalytique est toujours présente. Idéalement, le ligand bloque les sites d’adsorption, qui favorisent les réactions secondaires ou orientent la sélectivité de la réaction par les demandes stériques du ligand et par les interactions avec le réactif15,21.
Ce travail explique si les effets stériques et électroniques de la dodécylamine (DDA) influencent ou non l’hydrogénation du cyclohexène et du 5-méthylfurfural (5-MF). Le DDA n’interagit pas directement avec les réactifs, ce qui implique une hydrogénation dirigée par le spectateur. Le 5-MF, un dérivé non toxique du furfural, a été utilisé comme réactif plus complexe et commercialement intéressant, par rapport à l’hydrogénation du cyclohexène. L’hydrogénation sélective du furfural, un produit secondaire de la production de biopétrole, et des dérivés du furfural présentent un intérêt industriel car ces composés peuvent être obtenus à partir de la biomasse et représentent des composants de départ prometteurs pour la production de plusieurs produits chimiques fins27,28.
Cependant, l’hydrogénation sélective est difficile, car l’hydrogénation des doubles liaisons carbonées et du groupe carbonyle sont en concurrence. Thermodynamiquement, l’hydrogénation des doubles liaisons carbonées est favorisée par rapport à l’hydrogénation du groupe carbonyle29.
Protocol
Representative Results
Discussion
Les nanoparticules de Pt coiffées de DDA ont été synthétisées avec succès dans deux tailles et formes différentes12,14. Les petites nanoparticules de Pt (1,6 nm) présentent une forme quasi-sphérique tandis que les plus grosses particules (2,4 nm) sont plus asymétriques présentant des structures partiellement tripodales ou ellipsoïdales. Les possibilités sont limitées pour obtenir de plus grosses nanoparticules de platine quasi-sphériques, car une formation de structures allongées se produit en augmentant encore la taille des particules par croissance ensemencée14. La taille et la forme des particules peuvent également être influencées par le ligand, le temps de réaction et la température. Outre le DDA, d’autres ligands peuvent être utilisés dans la synthèse, mais l’agent de coiffage influence la croissance et, par conséquent, la taille et la forme des nanoparticules, comme cela a déjà été démontré pour la synthèse de nanoparticules d’or39. Après avoir ajouté la solution de réduction à la solution de sel métallique, la solution est agitée pendant 60 min (90 min pour la synthèse de particules plus grosses) pour s’assurer que le processus de croissance des nanoparticules Pt est terminé. Le transport des monomères à la surface des particules peut être un facteur limitant. De plus, la température peut influencer le rayon critique, qui décrit la taille minimale requise des particules, à laquelle les graines sont stables en solution. En augmentant la température, le rayon critique diminue, ce qui entraîne une formation plus rapide des graines et par conséquent une diminution plus rapide de la concentration en monomère55. Après synthèse, des impuretés d’ammonium et de bromure peuvent encore être observées dans XPS qui peuvent être éliminées en effectuant un échange de ligand avec DDA. De plus, toutes les nanoparticules synthétisées ont été déposées sur des poudres P25 sans aucun changement de forme, de taille ou de perte du ligand. À titre de comparaison, un catalyseur Pt sans ligand a été généré en utilisant la méthode d’imprégnation, qui présente une taille de nanoparticules Pt de 2,1 nm et une forme quasi-sphérique. XPS révèle en outre que non seulement des espèces métalliques de Pt étaient présentes à la surface, mais aussi des espèces oxydées. Cela indique qu’en l’absence de ligands amine, les nanoparticules de platine interagissent avec le support, ce qui peut entraîner une encapsulation partielle du métal dans le support10. En conséquence, les particules perdent partiellement leur capacité à diviser l’hydrogène56. Cependant, une telle encapsulation est favorisée par une réduction à haute température du précurseur de sel métallique. La température utilisée ici pour la réduction (180 °C) est très inférieure à celles mentionnées dans la littérature pour l’encapsulation (600 °C)57. Une autre explication plus probable serait une réduction incomplète de la source de Pt utilisée. Cependant, les deux explications entraînent une désactivation partielle du catalyseur.
Dans la littérature, les ligands tels que les amines ou l’ammoniac sont souvent considérés comme un poison catalyseur dans la compréhension classique de la catalyse hétérogène15,16. Cependant, les études sur l’hydrogénation en phase liquide du cyclohexène démontrent que Pt/DDA/P25 est toujours actif catalytiquement et a montré une conversion encore plus élevée par rapport au catalyseur sans amine. Les amines sont connues pour bloquer systématiquement les sites d’adsorption en terrasse sur Pt(111)11,58. Les résultats de la littérature ont déjà montré que cet effet prometteur de sélection de sites actifs des ligands peut être utilisé pour améliorer la sélectivité pour l’hydrogénation de l’acétylène dans les flux riches en éthylène en diluant les sites d’adsorption59. Cet effet de sélection active du site a également été observé pour les thiols se liant sur(111)22,23. Pour l’hydrogénation du cyclohexène, ces sites sont donc déjà bloqués par les amines, mais des centres de réaction sous-coordonnés très actifs sont encore disponibles. En plus de l’effet de sélection de site du ligand, une attention particulière doit également être accordée à d’autres propriétés du ligand. Lors de la sélection du ligand, il faut veiller à ce que le ligand stabilise les particules pendant la synthèse et les protège de l’agglomération. De plus, le ligand doit présenter une forte adsorption sur la surface métallique et une stabilité thermique suffisamment élevée pour que le ligand ne soit pas désorbé ou décomposé dans des conditions de réaction. Les résultats montrent que le PDD semble généralement convenir à cette approche catalytique. Aucun effet de taille n’a pu être observé dans la réaction du modèle. Fait intéressant, le catalyseur contenant des nanoparticules de Pt qui n’ont pas subi d’échange de ligand a présenté une conversion plus faible (50%) que les particules Pt déposées sur P25 après échange de ligand (72%). Par conséquent, un blocage des sites actifs par des composés ioniques peut être envisagé dans ces conditions. La réalisation d’un échange de ligand est cruciale pour augmenter l’activité des nanoparticules de platine en éliminant les composés ioniques co-adsorbés tels que le bromure et l’ammonium, comme le montre XPS avant et après l’échange de ligands.
De plus, l’influence des espèces de surface d’amines supplémentaires sur l’activité catalytique des nanoparticules de platine reste ambiguë, car cette espèce peut potentiellement servir de source d’hydrogène supplémentaire et localisée. Les spectres XP et FT-IR semblent indiquer une abstraction d’hydrogène du groupe amine par le platine conduisant à une espèce de surface amine supplémentaire. Cela offre la possibilité de servir de l’hydrogène en plus de l’hydrogène dissous dans le toluène, ce qui peut affecter l’activité catalytique. Un effet donneur d’hydrogène du toluène peut être exclu ici puisque le toluène n’est pas connu pour se déshydrogéner sous une pression d’hydrogène basse et à une température60. Cependant, l’influence de l’extraction d’hydrogène sur l’activité catalytique doit encore être étudiée plus avant. L’hydrogénation de l’acétophénone sur des nanoparticules de platine modifiées par la l-proline a déjà montré que le groupe amine peut accélérer l’hydrogénation par un transfert d’hydrogène de l’amine au réactif15. Par conséquent, une influence possible de l’amine et des espèces de surface sur l’hydrogénation doit être envisagée.
Malgré l’utilisation réussie de nanoparticules Pt/DDA pour l’hydrogénation d’alcènes simples, aucun renouvellement pour le réactif 5-MF plus exigeant n’a pu être observé. Par conséquent, différentes possibilités pour cela peuvent être discutées dans ce qui suit: une explication serait qu’aucune réaction n’a lieu en raison de la faible température de réaction et de la pression d’hydrogène. La température de réaction a été limitée à 160 °C. Comme l’analyse thermogravimétrique a montré que la désorption des ligands et la décomposition des nanoparticules Pt/DDA de tailles comparables ont lieu à ces températures13. En raison du réacteur utilisé, aucune pression supérieure à 1 atm d’hydrogène ne pouvait être utilisée. La pression d’hydrogène plus faible contrairement aux expériences de la littérature pourrait être la raison pour laquelle l’hydrogénation des composés carbonyles, tels que le 5-MF, n’était pas réalisable. Plusieurs études ont en outre montré que les interactions de support métallique fort (SMSI) sont cruciales pour la sélectivité de l’hydrogénation en phase gazeuse du furfural61,62,63. Le SMSI conduit à la formation de vides O, ce qui permet l’adsorption du furfural via le groupe carbonyle à la surface du titane. Un furfuryl-oxy-intermédiaire est formé qui peut être hydrogéné. Cependant, cette hypothèse est contrée par le fait que, contrairement aux expériences en phase gazeuse, aucune preuve d’une influence du SMSI n’a pu être trouvée pour l’hydrogénation en phase liquide du furfural dans le méthanol. Des particules de platine sur différents oxydes (MgO,CeO2 etAl2O3) avaient montré des propriétés catalytiques comparables64. Cela indique que l’hydrogénation pourrait avoir lieu en subissant différents mécanismes dans la phase liquide et la phase gazeuse, ce qui doit être étudié plus avant. L’effet SMSI des particules Pt et du support n’a été observé que pour le catalyseur sans ligand, qui ne montre pas non plus de conversion de 5-MF dans les conditions de réaction utilisées. Par conséquent, un impact de l’effet SMSI semble peu probable. Comme l’empoisonnement du catalyseur par le 5-MF ou un intermédiaire de surface semble plus probable dans les conditions de réaction appliquées, les catalyseurs ont été analysés avant et après l’échange de ligand avec le 5-MF dans des conditions de réaction par XPS et FT-IR. Ces mesures ont confirmé l’hypothèse d’un empoisonnement catalytique par 5-MF car les deux méthodes montrent une diminution des pics correspondant à l’amine à la surface du Pt. La spectroscopie FT-IR suggère en outre que la 5-MF agit comme un poison catalytique puisque des bandes apparaissent dans la région du nombre d’onde en dessous de 1 200 cm-1, ce qui correspond aux bandes attribuées à la 5-MF. Une géométrie d’adsorption presque plate est suggérée en tenant compte des règles de sélection de surface. Un schéma de la restructuration de surface proposée est présenté à la figure 8.
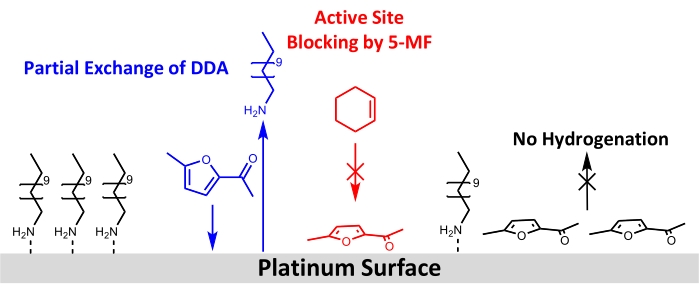
Figure 8 : Schéma des changements structuraux par addition de 5-MF à l’hydrogénation du cyclohexène à la surface des nanoparticules de platine stabilisées aux amines. Les résultats du FT-IR et du XPS montrent un échange partiel de DDA par 5-MF à la surface du platine et un blocage des sites actifs pour l’hydrogénation du cyclohexène. Les résultats des données FT-IR suggèrent une adsorption de l’anneau de 5-MF presque parallèle à la surface. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour conclure, les nanoparticules de Pt coiffées d’amine sur P25 sont des candidats prometteurs pour de nouveaux catalyseurs d’hydrogénation, car les nanoparticules de Pt présentent une conversion plus élevée que le catalyseur sans ligand dans la réaction modèle. Cependant, aucune conversion de 5-MF n’a été observée sur l’un ou l’autre catalyseur. Cela résulte d’un empoisonnement du Pt par le réactif et non par le ligand comme souvent considéré dans la littérature dans les conditions de réaction étudiées. Pour les applications futures, une meilleure compréhension de l’influence des ligands sur le comportement d’adsorption des réactifs et leur interaction avec les nanoparticules métalliques est nécessaire. Une synthèse colloïdale est une approche prometteuse en plus des méthodes d’imprégnation et de calcination pour la fabrication de catalyseurs hétérogènes, car elle permet la synthèse de nanoparticules dans une taille et une forme définies. Étant donné que l’approche de synthèse colloïdale permet l’utilisation de différents ligands, par exemple des amines, des amides, des thiols ou des alcools, les nanoparticules de Pt avec d’autres ligands doivent être étudiées et comparées. Cela offre la possibilité d’utiliser des ligands, qui montrent une interaction ligand-réactif spécifique, comme les interactions π-π pour contrôler la géométrie d’adsorption et donc aussi la sélectivité de la réaction. Cette approche pourrait être utilisée pour l’hydrogénation sélective des α,β-cétones insaturées et des aldéhydes, comme cela a déjà été démontré pour l’hydrogénation du cinnamaldéhyde21. En outre, le contrôle de la stéréosélectivité dans les réactions catalysées hétérogènes reste une tâche difficile; Cependant, un ligand chiral approprié pourrait être utilisé pour contrôler la chiralité du produit comme dans les réactions catalysées homogènes. Outre les interactions ligand-réactif, l’effet stabilisateur des ligands pourrait être utilisé pour protéger les nanoparticules métalliques de l’interaction de support métallique fort. L’interaction de support métallique fort réduirait la chimisorption de l’hydrogène par encapsulation des particules avec une couche d’oxyde. Pour une meilleure compréhension de l’influence des ligands, XPS et FT-IR peuvent fournir des informations utiles sur l’effet d’empoisonnement sélectif et les modes de liaison des ligands. En outre, le CO doit être considéré comme une molécule de capteur permettant d’identifier les sites de surface disponibles de la nanoparticule de Pt. De plus, le comportement d’adsorption et les réactions de surface possibles des ligands et des réactifs peuvent être étudiés sur des monocristaux Pt dans des conditions de vide ultra-poussé pour obtenir une compréhension fondamentale des processus de surface. Dans l’ensemble, les ligands en catalyse hétérogène peuvent offrir une nouvelle approche catalytique, qui peut être utilisée pour contrôler l’activité et la sélectivité d’une réaction catalysée en plus de la taille des particules et des effets de soutien. Par conséquent, la façon traditionnelle de penser la catalyse hétérogène des ligands comme poison catalyseur devrait être reconsidérée.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Merci à Edith Kieselhorst et Erhard Rhiel pour leur soutien au TEM et à Carsten Dosche pour le soutien au XPS. Merci à Stefan Petrasz pour son soutien avec le chromatographe en phase gazeuse. Le financement du dispositif XPS par DFG (INST: 184/144-1FUGG) et le financement de DFG-RTG 2226 sont reconnus.
Materials
| 2-propanol | Sigma Aldrich | 59300-2.5L | puriss. p. a., ACS reagent, >99.8% |
| 4-methyl-2-pentanol | Carl Roth | 4371.2 | purity: >99%, for synthesis |
| 5-methylfurfural | Sigma Aldrich | 137316-100G | ReagentPlus, 99 % |
| acetone | Sigma Aldrich | 32201-2,5L-M | puriss. p. a., ACS reagent, >99.5% |
| cannula | B Braun | 4665643 | diameter: 0.80 mm, length: 120 mm |
| CasaXPS | Casa Software | software, version 2.3.15 | |
| centrifuge | Heraeus | model: Multifuge 1s | |
| centrifuge tube | Schott Duran | 163-9315026 | volume: 80 mL, diameter: 44 mm, length: 100 mm |
| chloroplatinic acid hexahydrate | Merck | 8073400001 | amount of platinum: 40 % |
| column | Agilent Technologies | 19091 S-001 | model: HP-PONA, film: dimethyl polysiloxane, film thickness: 0.2 µm, length: 50 m |
| CRYSTAL 17 | CRYSTAL Theoretical Chemistry Group Torino | software, version: v1.0.2 | |
| crystallizing dish | volume: 50 mL | ||
| cyclohexene | Acros Organics | 154840010 | purity: 99 % |
| desposable syringe | Henke Sass Wolff | Norm-Ject, volume: 1, 2, 5 mL | |
| didodecyldimethylammonium bromide | Acros Organics | 407120250 | purity: 99 % |
| diisopropyl ether | Carl Roth | T899.1 | purity: 98%, for synthesis |
| dodecyl amine | Sigma Aldrich | D222208-500ML | purity: 98 % |
| double walled tank reactor | processed by glass blower | Standard ground glass joint sleeves: 2 x 14/23, 1 x 19/26, 1 x 29/32, reactor volume: 150 mL, material: quartz glas, with outer heating jacket | |
| Fourier-transform infrared spectrometer | Bruker | model: Equinox 55 | |
| rubber balloon | Deutsch & Neumann | 163-7652667 | volume: 4 L, material: latex, |
| gaschromatograph | Agilent Technologies | model: 7820A | |
| HP-PONA-column | Agilent Technologies | 19091S-001 | length: 50 m, film thickness: 0.5 µm, inner diameter: 0.2 mm |
| hydrogen | Air Liquide | P0231L50R2A001 | purity: 5.0 |
| ImageJ | Wayne Rasband | software, version 1.52 | |
| methanol | Sigma Aldrich | 32213-2,5L-M | puriss. p. a., ACS reagent, >99.8% |
| n-hexane | VWR Chemicals | 24577298 | purity: 99 % |
| Opus | Bruker | software, version 5.5 | |
| pasteur pipette | Brand | 747715 | material: glass, length: 145 mm, inside diameter: 1 mm |
| pipette ball | Technikplaza | 89005517 | diameter: 94 mm, material: PVC |
| platinum(IV) chloride | Acros Organics | 195400010 | purity: 99 % |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 005 | volume: 100-1000 µL |
| plunge operated pipette | LLG Lab Logistics Group | 9.280 001 | volume: 0.5-10 µL |
| potassium bromide | Carl Roth | 9252.1 | purity: >98% |
| reflux condenser | neoLab | LZ-1197 | length: 160 mm, NS 14/23 |
| rolled rim glass | VWR Chemicals | 548-0625 | volume: 10 mL |
| round neck flask | Carl Roth | HY50.1 | volume: 10 mL, NS 14/23 |
| rubber septum | Carl Roth | EE04.1 | material: silicone, NS 14/23 |
| syringe filter | Agilent Technologies | 5190-5267 | Captiva Econofilter, pore size 0.2 µm, PTFE menbrane |
| syringe pump | Landgraf Laborsysteme HLL | 106720180 | model: LA180A |
| TEM grid | Plano | diameter: 3.05 mm, 300 mesh, covered with formvar and coal | |
| temperature programmed oven | Nabertherm | model: L5, voltage: 230 V, power: 2.4 kW, controler: C6 | |
| tetrabutylammonium borohydride | Sigma Aldrich | 230170-10G | purity: 98 % |
| three neck round bottom flask | Carl Roth | KY19.1 | volume: 100 mL, NS 14/23, 14/23 |
| Titania P25 | Acros Organics | 384292500 | purity: 99 % |
| toluene | VWR Chemicals | 32249-1L-M | puriss. p. a., ACS reagent, >99.7% |
| transition piece | Carl Roth | with core and stop cock, straight tubing olive, 29/32 | |
| transmission electron microscope | Zeiss | model: 900N | |
| ultrasonic bath | Bandelin | 305 | model: RK 156, volume: 6 L |
| volumetric pipette | Brand | 29718 | volume: 50 mL |
| X-ray photoelectron spectrometer | Thermo Fisher | model: ESCALAB 250 xi |
References
- Liu, L., Corma, A. Metal catalysts for heterogeneous catalysis: From single atoms to nanoclusters and nanoparticles. Chemical Reviews. 118 (10), 4981-5079 (2018).
- Zakarina, N., Bekturov, E. Platinum nanoparticles stabilized by polyvinylpyrrolidone for hydrogenation. Chinese Journal of Catalysis. 29 (11), 1165-1168 (2008).
- Rioux, R. M., et al. Monodisperse platinum nanoparticles of well-defined shape: synthesis, characterization, catalytic properties and future prospects. Topics in Catalysis. 39 (3-4), 167-174 (2006).
- Ikeda, S., et al. Ligand-free platinum nanoparticles encapsulated in a hollow porous carbon shell as a highly active heterogeneous hydrogenation catalyst. Angewandte Chemie. 118 (42), 7221-7224 (2006).
- Mostafa, S., et al. Shape-dependent catalytic properties of Pt nanoparticles. Journal of the American Chemical Society. 132 (44), 15714-15719 (2010).
- van Deelen, T. W., Hernández Mejía, C., de Jong, K. P. Control of metal-support interactions in heterogeneous catalysts to enhance activity and selectivity. Nature Catalysis. 2 (11), 955-970 (2019).
- Rioux, R. M., Hsu, B. B., Grass, M. E., Song, H., Somorjai, G. A. Influence of particle size on reaction selectivity in cyclohexene hydrogenation and dehydrogenation over silica-supported monodisperse Pt particles. Catalysis Letters. 126 (1-2), 10-19 (2008).
- Somorjai, G. A., Carrazza, J. Structure sensitivity of catalytic reactions. Industrial & Engineering Chemistry Fundamentals. 25 (1), 63-69 (1986).
- Somorjai, G. A. Surface science. Science. 201 (4355), 489-497 (1978).
- Fu, Q., Wagner, T. Interaction of nanostructured metal overlayers with oxide surfaces. Surface Science Reports. 62 (11), 431-498 (2007).
- Siemer, M., Tomaschun, G., Klüner, T., Christopher, P., Al-Shamery, K. Insights into spectator-directed catalysis: CO adsorption on amine-capped platinum nanoparticles on oxide supports. ACS Applied Materials & Interfaces. 12 (24), 27765-27776 (2020).
- Jana, N. R., Peng, X. Single-phase and gram-scale routes toward nearly monodisperse Au and other noble metal nanocrystals. Journal of the American Chemical Society. 125 (47), 14280-14281 (2003).
- Fenske, D., et al. Colloidal synthesis of pt nanoparticles: on the formation and stability of nanowires. Langmuir. 24 (16), 9011-9016 (2008).
- Osmić, M., Kolny-Olesiak, J., Al-Shamery, K. Size control and shape evolution of single-twinned platinum nanocrystals in a room temperature colloidal synthesis. CrystEngComm. 16 (42), 9907-9914 (2014).
- Schrader, I., Warneke, J., Backenköhler, J., Kunz, S. Functionalization of platinum nanoparticles with L-proline: simultaneous enhancements of catalytic activity and selectivity. Journal of the American Chemical Society. 137 (2), 905-912 (2015).
- Maxted, E. B., Biggs, M. S. The catalytic toxicity of nitrogen compounds. Toxicity of ammonia and of amines. Journal of the Chemical Society. , 3844-3847 (1957).
- Aliaga, C., et al. Sum frequency generation and catalytic reaction studies of the removal of organic capping agents from Pt nanoparticles by UV−Ozone treatment. The Journal of Physical Chemistry C. 113 (15), 6150-6155 (2009).
- Comotti, M., Li, W. -. C., Spliethoff, B., Schüth, F. Support effect in high activity gold catalysts for CO oxidation. Journal of the American Chemical Society. 128 (3), 917-924 (2006).
- Gorin, D. J., Sherry, B. D., Toste, F. D. Ligand effects in homogeneous Au catalysis. Chemical Reviews. 108 (8), 3351-3378 (2008).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Selective hydrogenation of polyunsaturated fatty acids using alkanethiol self-assembled monolayer-coated Pd/Al2O3 catalysts. ACS Catalysis. 3 (9), 2041-2044 (2013).
- Kahsar, K. R., Schwartz, D. K., Medlin, J. W. Control of metal catalyst selectivity through specific noncovalent molecular interactions. Journal of the American Chemical Society. 136 (1), 520-526 (2014).
- Pang, S. H., Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Directing reaction pathways by catalyst active-site selection using self-assembled monolayers. Nature Communications. 4, 2448 (2013).
- Schoenbaum, C. A., Schwartz, D. K., Medlin, J. W. Controlling the surface environment of heterogeneous catalysts using self-assembled monolayers. Accounts of Chemical Research. 47 (4), 1438-1445 (2014).
- Grimes, R. N. Small carborane ligands as spectators and as players. Journal of Organometallic Chemistry. 581 (1-2), 1-12 (1999).
- Crabtree, R. H. Multifunctional ligands in transition metal catalysis. New Journal of Chemistry. 35 (1), 18-23 (2011).
- Dostert, K. -. H., O’Brien, C. P., Ivars-Barceló, F., Schauermann, S., Freund, H. -. J. Spectators control selectivity in surface chemistry: Acrolein partial hydrogenation over Pd. Journal of the American Chemical Society. 137 (42), 13496-13502 (2015).
- Hu, L., et al. Catalytic conversion of biomass-derived carbohydrates into fuels and chemicals via furanic aldehydes. RSC Advances. 2 (30), 11184 (2012).
- Pushkarev, V. V., Musselwhite, N., An, K., Alayoglu, S., Somorjai, G. A. High structure sensitivity of vapor-phase furfural decarbonylation/hydrogenation reaction network as a function of size and shape of Pt nanoparticles. Nano Letters. 12 (10), 5196-5201 (2012).
- Liao, X. -. M., Pitchon, V., Cuong, P. -. H., Chu, W., Caps, V. Hydrogenation of cinnamaldehyde over bimetallic Au–Cu/CeO2 catalyst under a mild condition. Chinese Chemical Letters. 28 (2), 293-296 (2017).
- Fang, D., He, F., Xie, J., Xue, L. Calibration of binding energy positions with C1s for XPS results. Journal of Wuhan University of Technology-Materials Science Edition. 35 (4), 711-718 (2020).
- Heiz, U., Landman, U. . Nanocatalysis: With 14 tables. , (2008).
- Nyholm, R., Berndtsson, A., Martensson, N. Core level binding energies for the elements Hf to Bi (Z=72-83). Journal of Physics C: Solid State Physics. 13 (36), 1091-1096 (1980).
- Fu, X., Wang, Y., Wu, N., Gui, L., Tang, Y. Surface modification of small platinum nanoclusters with alkylamine and alkylthiol: An XPS study on the influence of organic ligands on the Pt 4f binding energies of small platinum nanoclusters. Journal of Colloid and Interface Science. 243 (2), 326-330 (2001).
- Ono, L. K., Yuan, B., Heinrich, H., Cuenya, B. R. Formation and thermal stability of platinum oxides on size-selected platinum nanoparticles: Support effects. The Journal of Physical Chemistry C. 114 (50), 22119 (2010).
- Bachmann, P., et al. Dehydrogenation of the Liquid Organic Hydrogen Carrier System Indole/Indoline/Octahydroindole on Pt(111). The Journal of Physical Chemistry C. 122 (8), 4470-4479 (2018).
- Mudiyanselage, K., Trenary, M. Adsorption and thermal decomposition of N-methylaniline on Pt(111). Surface Science. 603 (21), 3215-3221 (2009).
- Briggs, D., Beamson, G. Primary and secondary oxygen-induced C1s binding energy shifts in x-ray photoelectron spectroscopy of polymers. Analytical Chemistry. 64 (15), 1729-1736 (1992).
- Huang, M., Adnot, A., Suppiah, S., Kaliaguine, S. XPS observation of surface interaction between H2 and CO2 on platinum foil. Journal of Molecular Catalysis A: Chemical. 104 (2), 131-137 (1995).
- Mohrhusen, L., Osmić, M. Sterical ligand stabilization of nanocrystals versus electrostatic shielding by ionic compounds: a principle model study with TEM and XPS. RSC Advances. 7 (21), 12897-12907 (2017).
- Otero-Irurueta, G., et al. Adsorption and coupling of 4-aminophenol on Pt(111) surfaces. Surface Science. 646, 5-12 (2015).
- Erley, W., Xu, R., Hemminger, J. C. Thermal decomposition of trimethylamine on Pt(111): spectroscopic identification of surface intermediates. Surface Science. 389 (1-3), 272-286 (1997).
- Bridge, M. E., Somers, J. The adsorption of methylamine on Pt(111). Vacuum. 38 (4-5), 317-320 (1988).
- Chen, X., Mao, S. S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications. Chemical Reviews. 107 (7), 2891-2959 (2007).
- Madon, R. J., O’Connell, J. P., Boudart, M. Catalytic hydrogenation of cyclohexene: Part II. Liquid phase reaction on supported platinum in a gradientless slurry reactor. American Institute of Chemical Engineers Journal. 24 (5), 904-911 (1978).
- Pan, C. -. J., et al. Tuning/exploiting Strong Metal-Support Interaction (SMSI) in heterogeneous catalysis. Journal of the Taiwan Institute of Chemical Engineers. 74, 154-186 (2017).
- Lewera, A., Timperman, L., Roguska, A., Alonso-Vante, N. Metal–support interactions between nanosized Pt and metal oxides (WO 3 and TiO 2 ) studied using X-ray photoelectron spectroscopy. The Journal of Physical Chemistry C. 115 (41), 20153-20159 (2011).
- Ohyama, J., Yamamoto, A., Teramura, K., Shishido, T., Tanaka, T. Modification of metal nanoparticles with TiO2 and metal−support interaction in photodeposition. ACS Catalysis. 1 (3), 187-192 (2011).
- Zhong, J. -. Q., et al. Synchrotron-based ambient pressure X-ray photoelectron spectroscopy of hydrogen and helium. Applied Physics Letters. 112 (9), 91602 (2018).
- Günzler, H., Gremlich, H. -. U. . IR-Spektroskopie: Eine Einführung. , (2003).
- Hesse, M., Meier, H., Zeeh, B. . Spektroskopische Methoden in der organischen Chemie: 114 Tabellen. , (2012).
- Ripmeester, M., Duford, D. A., Yuan, S. Understanding the behaviour of dodecylamine as a model cationic collector in oil sands tailings dewatering applications using a novel FTIR based method. The Canadian Journal of Chemical Engineering. 98 (7), 1471-1482 (2020).
- Erdogdu, Y., Sertbakan, T. R., Güllüoğlu, M. T., Yurdakul, &. #. 3. 5. 0. ;., Güvenir, A. FT-IR and Raman spectroscopy and computation of 5-Methylfurfural. Journal of Applied Spectroscopy. 85 (3), 517-525 (2018).
- Kiss, &. #. 1. 9. 3. ;. I., Machytka, D., Bánki, J., Gál, M. Spectroscopic study of the conformational isomerism of 2-formylfuran derivatives. Journal of Molecular Structure. 197, 193-202 (1989).
- Allen, G., Bernstein, H. J. Internal rotation: VIII. The infrared and Raman spectra of furfural. Canadian Journal of Chemistry. 33 (6), 1055-1061 (1955).
- Thanh, N. T. K., Maclean, N., Mahiddine, S. Mechanisms of nucleation and growth of nanoparticles in solution. Chemical Reviews. 114 (15), 7610-7630 (2014).
- Tauster, S. J., Fung, S. C., Garten, R. L. Strong metal-support interactions. Group 8 noble metals supported on titanium dioxide. Journal of the American Chemical Society. 100 (1), 170-175 (1978).
- Beck, A., et al. The dynamics of overlayer formation on catalyst nanoparticles and strong metal-support interaction. Nature Communications. 11 (1), 3220 (2020).
- Sobota, M., et al. Ligand effects in SCILL model systems: site-specific interactions with Pt and Pd nanoparticles. Advanced Materials. 23 (2223), 2617-2621 (2011).
- Altmann, L., et al. Impact of organic ligands on the structure and hydrogenation performance of colloidally prepared bimetallic PtSn nanoparticles. ChemCatChem. 5 (7), 1803-1810 (2013).
- Modisha, P. M., Ouma, C. N. M., Garidzirai, R., Wasserscheid, P., Bessarabov, D. The prospect of hydrogen storage using liquid organic hydrogen carriers. Energy & Fuels. 33 (4), 2778-2796 (2019).
- Baker, L. R., et al. Furfuraldehyde hydrogenation on titanium oxide-supported platinum nanoparticles studied by sum frequency generation vibrational spectroscopy: acid-base catalysis explains the molecular origin of strong metal-support interactions. Journal of the American Chemical Society. 134 (34), 14208-14216 (2012).
- Kijeński, J., Winiarek, P., Paryjczak, T., Lewicki, A., Mikołajska, A. Platinum deposited on monolayer supports in selective hydrogenation of furfural to furfuryl alcohol. Applied Catalysis A: General. 233 (1-2), 171-182 (2002).
- Kijeński, J., Winiarek, P. Selective hydrogenation of α,β-unsaturated aldehydes over Pt catalysts deposited on monolayer supports. Applied Catalysis A: General. 193 (1-2), 1-4 (2000).
- Taylor, M. J., et al. Highly selective hydrogenation of furfural over supported Pt nanoparticles under mild conditions. Applied Catalysis B. 180, 580-585 (2016).

