La plate-forme immersive d’achat en réalité virtuelle de la Cleveland Clinic pour l’évaluation des activités instrumentales de la vie quotidienne
Summary
La réalité virtuelle (RV) est une approche puissante mais sous-utilisée pour faire progresser le diagnostic et le traitement des maladies neurologiques. La plate-forme d’achat en réalité virtuelle de la Cleveland Clinic combine un contenu VR de pointe avec un tapis roulant omnidirectionnel pour quantifier les activités instrumentales de la vie quotidienne – un marqueur prodromique proposé de maladie neurologique.
Abstract
Une baisse de la performance des activités instrumentales de la vie quotidienne (IADL) a été proposée comme marqueur prodromique de la maladie neurologique. Les évaluations cliniques et IADL basées sur la performance existantes ne sont pas réalisables pour l’intégration dans la médecine clinique. La réalité virtuelle (RV) est un outil puissant mais sous-utilisé qui pourrait faire progresser le diagnostic et le traitement des maladies neurologiques. Un obstacle à l’adoption et à la mise à l’échelle de la RV en neurologie clinique est la maladie liée à la RV résultant d’incohérences sensorielles entre les systèmes visuel et vestibulaire (c.-à-d. problème de locomotion).
La plate-forme CC-VRS (Cleveland Clinic Virtual Reality Shopping) tente de résoudre le problème de locomotion en couplant un tapis roulant omnidirectionnel avec du contenu VR haute résolution, permettant à l’utilisateur de naviguer physiquement dans une épicerie virtuelle pour simuler ses achats. Le CC-VRS se compose d’expériences d’achat de base et complexes; les deux nécessitent de marcher 150 m et de récupérer cinq objets. L’expérience Complexe a des scénarios supplémentaires qui augmentent les exigences cognitives et motrices de la tâche pour mieux représenter le continuum d’activités associées aux achats dans le monde réel. La plateforme CC-VRS fournit des résultats biomécaniques et cognitifs objectifs et quantitatifs liés à la performance IADL de l’utilisateur. Les données initiales indiquent que le CC-VRS entraîne une maladie vr minimale et est faisable et tolérable pour les personnes âgées et les patients atteints de la maladie de Parkinson (MP). Les considérations qui sous-tendent le développement, la conception et la technologie matérielle et logicielle sont examinées, et les modèles initiaux d’intégration dans les soins primaires et la neurologie sont fournis.
Introduction
En 2008, la National Academy of Engineering a identifié 14 grands défis pour l’ingénierie au21e siècle1. L’un d’eux était l’intégration de la réalité virtuelle (RV) dans la médecine. Des progrès ont été réalisés dans l’utilisation de la RV pour la formation des étudiants en médecine 2,3, la planification chirurgicale3, la réduction de l’anxiété associée aux interactionsmédicales 4, l’aide à la prise en charge de la douleur aiguë5 et liée au cancer6, et l’augmentation de la récupération motrice après un AVC7. Malgré ces applications prometteuses, l’utilité de la RV en médecine n’a pas été pleinement réalisée, en particulier dans le domaine de l’évaluation et du traitement des maladies neurologiques. Alors que les progrès de la technologie VR ont minimisé les obstacles tels que le coût, le confort du casque et les fonctionnalités d’utilisation intuitives, la maladie VR continue d’entraver l’intégration de la VR dans la médecine8.
La maladie de la réalité virtuelle fait référence à des sentiments semblables au mal des transports (par exemple, nausées, vomissements, vertiges)9,10,11 qui surviennent pendant les expériences de RV. Bien qu’aucune théorie unique ne soit convenue pour expliquer la maladie de rv, la théorie du conflit sensoriel est une explication principale12. En bref, la théorie du conflit sensoriel suggère que la maladie de rv provient de disparités sensorielles; L’information visuelle sur le flux indique le mouvement vers l’avant du corps dans l’espace tandis que le système vestibulaire indique que le corps est stationnaire13. Cette divergence dans l’information sensorielle entraîne un mauvais équilibre, une désorientation spatiale et des mouvements posturaux incontrôlables qui sont des précurseurs de la maladie de rv. Bien que le mécanisme précis sous-jacent à la maladie de rv soit débattu, la réduction de l’inadéquation entre les sources d’information sensorielle est susceptible de réduire la maladie derv 14 et de faciliter l’adoption de la RV dans un cadre médical.
La locomotion couplée à la RV a longtemps été proposée comme une approche pour réduire l’inadéquation sensorielle en immergeant physiquement et visuellement l’utilisateur dans l’environnement virtuel15,16. Plusieurs études chez des personnes âgées avec et sans maladie neurologique ont réussi à associer des systèmes de RV immersifs et non immersifs à des tapis roulants unidirectionnels traditionnels 17,18,19. Ces études démontrent qu’une intervention sur tapis roulant VR et unidirectionnelle est généralement bien tolérée18 et que l’intervention peut réduire la fréquence de chute17,19. Ces résultats fournissent une base prometteuse pour l’intégration réussie de la locomotion et de la RV. Cependant, la stimulation du moteur externe d’un tapis roulant unidirectionnel ne permet pas à l’utilisateur de changer de vitesse ou d’exécuter des virages pour interagir avec des environnements virtuels réalistes plus complexes.
Au cours des deux dernières décennies, les progrès du matériel et des logiciels de suivi des mouvements ont facilité le développement d’environnements virtuels plus immersifs et interactifs. Une avancée majeure a été le développement du tapis roulant omnidirectionnel20. En bref, un tapis roulant omnidirectionnel utilise simultanément des mouvements linéaires et rotatifs pour permettre à l’utilisateur de se déplacer dans n’importe quelle direction à un rythme auto-sélectionné. Généralement utilisés dans l’industrie du jeu, les tapis roulants omnidirectionnels élargissent les possibilités de tirer parti des environnements de RV dans le cadre clinique en s’attaquant à la fois au problème de la maladie de rv et en facilitant la création d’environnements réalistes qui remettent mieux en question les capacités physiques de l’utilisateur, telles que tourner ou changer de direction. En particulier, les réplications virtuelles d’environnements quotidiens à grande échelle peuvent faciliter l’évaluation du fonctionnement cognitif et moteur lors de l’exécution d’activités instrumentales de la vie quotidienne (IADL).
Les activités instrumentales de la vie quotidienne (IADL) sont des tâches fonctionnelles (p. ex., magasinage, prise de médicaments, préparation des aliments) qui sont essentielles au maintien d’une vie autonome21. La capacité d’accomplir des IADL courants a été proposée comme marqueur prodromique des maladies neurologiques. Des données récentes provenant d’études prospectives à long terme indiquent que les baisses des IADL précèdent probablement un diagnostic de maladie de Parkinson (MP) de 5 à 7 ans22,23 et un diagnostic de maladie d’Alzheimer24,25. Contrairement aux activités de base de la vie quotidienne (BADL)26, les IADL nécessitent généralement l’exécution simultanée de deux tâches exigeantes en attention (par exemple, moteur-cognitif, moteur-moteur ou cognitif-cognitif)27. La grande majorité des activités quotidiennes du ménage et de la communauté sont effectuées dans des conditions de double tâche28,29.
Bien que les déclins à double tâche aient clairement un impact sur les performances de l’IADL, les évaluations motrices cliniques traditionnelles 30,31,32 et les tests neuropsychologiques 33,34 sont insuffisants pour évaluer les IADL, car ces évaluations séparent la fonction en composants discrets sans tenir compte de leur interdépendance. Les méthodes actuelles d’évaluation directe de l’IADL reposent sur des questionnaires d’auto-évaluation sujets aux biais35 ou sur des évaluations longues et lourdes fondées sur le rendement36. Aucune des deux approches ne fournit d’informations objectives et quantitatives sur le niveau de fonction IADL d’un individu dans le cadre communautaire.
Les progrès de la technologie VR, associés aux avancées techniques sous-jacentes aux tapis roulants omnidirectionnels, offrent la possibilité de créer un environnement interactif et immersif. Une épicerie virtuelle et une tâche d’achat ont été créées pour évaluer simultanément les performances motrices, cognitives, cognitives motrices et IADL. La plate-forme d’achat en réalité virtuelle de la Cleveland Clinic (CC-VRS) a été développée en collaboration par une équipe d’ingénieurs biomédicaux, de développeurs de logiciels, de physiothérapeutes, d’ergothérapeutes et de neurologues.
Une tâche d’épicerie a été sélectionnée pour quantifier la performance de l’IADL sur la base des recommandations de l’American Occupational Therapy Association26. Le Virtual Multiple Errands Task (VMET)37, l’échelle ADL instrumentale chronométrée38 et le Penn Parkinson’s Daily Activities Questionnaire-15 (PDAQ-15)39 reconnaissent le magasinage comme un indicateur important de la performance motrice et non motrice associée aux maladies neurologiques. D’autres ont utilisé un casque VR immersif pour créer un environnement d’épicerie dans le but d’estimer les performances IADL 37,40,41. Cependant, ils n’ont pas réussi à évaluer une composante majeure de l’épicerie: la locomotion. Généralement, les paradigmes actuels de l’épicerie VR exigent que le participant utilise un contrôleur portatif pour se téléporter ou naviguer dans un avatar dans toute l’épicerie. Nous avons cherché à intégrer la locomotion dans l’expérience d’achat virtuelle de l’utilisateur. Le processus de développement cc-VRS a commencé par une analyse formelle des tâches d’une expérience typique d’épicerie. Comme l’indique la figure 1, neuf composantes fondamentales de la tâche reflètent un mélange d’éléments qui peuvent être caractérisés comme des activités motrices, cognitives ou cognitivo-motrices nécessaires à une performance réussie, comme c’est le cas de tous les IADL.
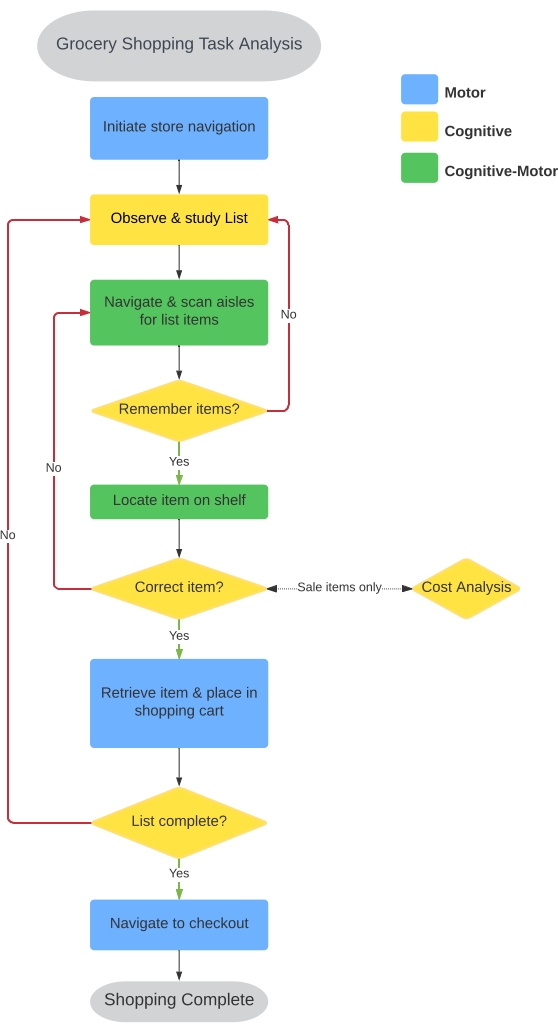
Figure 1 : Analyse des tâches d’épicerie. Une analyse des tâches a été effectuée pour identifier la séquence d’actions et la nature de ces actions pour réussir l’épicerie dans le monde réel. Neuf séquences primaires ont été identifiées et ont été utilisées pour éclairer le développement des tâches d’achat de base et complexes. Les séquences ont été classées comme motrices (bleu), cognitives (jaune) et cognitives-motrices (vertes); des détails concernant les résultats correspondants sont fournis dans le tableau 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La plate-forme CC-VRS reproduit une épicerie réaliste de taille moyenne via un casque VR immersif. Lorsqu’il marche sur un tapis roulant omnidirectionnel, l’utilisateur suit un itinéraire continu et désigné à travers le magasin, localise les articles sur une liste de courses et place les articles dans un panier virtuel. La fourniture d’un itinéraire désigné standardise la distance parcourue dans le magasin virtuel, réduit le nombre d’erreurs de navigation et facilite une plus grande précision dans la dissociation des modifications potentielles des performances IADL des erreurs de navigation ou des stratégies de recherche sous-optimales employées par l’utilisateur. Le parcours de 150 m nécessite plusieurs virages, ce qui augmente la complexité motrice42,43 et la probabilité de déclencher le gel de la démarche dans les populations de patients neurologiques, car les gels sont plus fréquemment observés pendant les virages que la marche en ligne droite44,45. La distance du chemin de navigation et le nombre d’éléments de la liste de courses peuvent être configurés par le clinicien pour correspondre aux capacités de l’utilisateur ou aux objectifs de la session d’évaluation.
Chaque utilisateur effectue un scénario d’achat de base et un scénario d’achat complexe. Le scénario de base nécessite simplement de suivre l’itinéraire et de sélectionner des articles dans la liste de courses. Dans le scénario complexe, l’utilisateur reçoit une liste de différents articles d’épicerie tout en suivant le même itinéraire dans le magasin, mais des exigences cognitives et motrices supplémentaires sont introduites (rappel verbal retardé, comparaison des prix et tâches d’évitement d’obstacles décrites dans la section de protocole ci-dessous). Le bruit ambiant de l’épicerie dans les scénarios de base et complexes complète l’expérience immersive. Des données récapitulatives et détaillées sur les performances de l’utilisateur, y compris les éléments corrects et incorrects collectés, le nombre et la fréquence des activations de la liste de courses, la durée des arrêts et les mesures de marche, sont automatiquement générées et disponibles pour examen par le clinicien.
L’objectif du CC-VRS est de quantifier objectivement la performance des IADL chez les personnes âgées et les personnes à risque ou diagnostiquées avec une maladie neurologique. Le CC-VRS offre une expérience immersive et réaliste à l’utilisateur, et il produit des résultats précis et biomécaniques de la fonction cognitive et motrice qui ont le potentiel de servir de marqueurs prodromiques de la maladie neurologique ou de mesures objectives de la progression de la maladie. Le CC-VRS est actuellement utilisé dans trois projets connexes visant à : (1) comprendre les effets du vieillissement en bonne santé et des maladies neurologiques sur la performance de l’IADL, (2) déterminer la faisabilité de l’intégration clinique dans les soins primaires et une clinique de troubles du mouvement, et (3) identifier la signature neuronale sous-jacente à la congélation de la démarche chez les patients atteints de MP avancés avec des systèmes de stimulation cérébrale profonde (SCP). Collectivement, ces projets utiliseront la plateforme CC-VRS et les résultats associés pour mieux comprendre l’impact du vieillissement et des maladies neurologiques sur certains aspects de la performance de l’IADL. Ce manuscrit détaille le développement, la conception et la technologie matérielle et logicielle du CC-VRS et ses nouveaux résultats qui peuvent faciliter l’intégration dans les soins de santé.
Protocol
Representative Results
Discussion
La plate-forme CC-VRS, à ce jour, semble résoudre le problème de locomotion en VR en combinant un contenu VR de pointe avec un tapis roulant omnidirectionnel. Un aspect essentiel de l’environnement immersif et transparent du CC-VRS est d’assurer une communication appropriée entre le tapis roulant et le logiciel VR. Une configuration correcte de tous les aspects du système VR, y compris les stations de base, les trackers des pieds et de la taille et les contrôleurs manuels, est impérative. Si le suivi est incohérent ou peu fiable, il est nécessaire d’ajuster l’orientation et l’emplacement des stations de base ou d’ajouter une autre unité de station de base. Une couverture adéquate de l’espace physique assure une synchronisation stable entre le matériel VR et le tapis roulant omnidirectionnel et garantit que les données de position et d’orientation des appareils VR sont complètes, précises et précises52. L’étalonnage du tapis roulant omnidirectionnel est recommandé au début de chaque session de collecte de données afin d’assurer une réceptivité optimale lors de la navigation dans l’environnement virtuel.
La familiarisation du patient avec le tapis roulant est essentielle avant d’administrer le CC-VRS. Bien qu’intuitif et simple à utiliser, le tapis roulant omnidirectionnel nécessite une familiarisation de l’utilisateur qui est préférable avant l’introduction du casque VR et les défis d’orientation spatiale qui en résultent. Pour répondre aux besoins de l’utilisateur individuel et aux objectifs de la présente évaluation, les fonctionnalités suivantes sont configurables pour chaque scénario CC-VRS : 1) tapis roulant à vitesse maximale faible ou élevée, 2) répétition du module didacticiel, 3) longueur de l’itinéraire à travers le magasin et 4) nombre d’articles sur la liste de courses. Ces modifications optimisent l’évaluation des capacités cognitives, motrices et à double tâche d’un large éventail fonctionnel de patients.
L’absence de technologie à plate-forme unique capable de normaliser la performance de l’IADL en utilisant des résultats objectifs et quantitatifs qui caractérisent le fonctionnement cognitif et moteur représente un obstacle critique à l’identification précoce et au traitement efficace des maladies neurologiques liées à l’âge telles que la MP ou la maladie d’Alzheimer. Les méthodes actuelles d’estimation de la fonction IADL à l’aide de questionnaires d’auto-évaluation, bien que faciles à administrer, sont susceptibles d’être biaisées. Au cours de l’auto-déclaration, les personnes âgées ont tendance à surestimer ou à sous-estimer les capacités de l’IADL53. De même, les informateurs qui répondent aux requêtes de l’IADL évaluent souvent mal les capacités en raison des perceptions erronées des observateurs ou des lacunes dans les connaissances35.
Une solution de rechange aux questionnaires d’auto-évaluation et d’évaluation par les informateurs est l’évaluation de l’IADL fondée sur le rendement. Les évaluations axées sur le rendement sont généralement effectuées par un ergothérapeute ou un physiothérapeute qualifié. Bien qu’un certain nombre de tests de rendement et de guides soient disponibles, ils ne sont pas propices à l’intégration dans les soins cliniques, nécessitant souvent suffisamment de temps et d’espace et d’équipement spécialisés que l’on ne trouve généralement pas dans le bureau d’un fournisseur de soins primaires ou de neurologie. L’une des évaluations basées sur les performances les plus largement utilisées, l’évaluation directe de l’état fonctionnel (DAFS), nécessite environ 40 minutes à administrer, et sa notation est largement basée sur l’opinion d’experts de l’administrateur du test. Bien que le DAFS soit utile dans la stadification de la maladie d’Alzheimer, il manque de sensibilité et ne détecte pas les déclins de l’IADL au stade24 de la déficience cognitive légère. Fusionner les mondes virtuel et réel en combinant la RV avec un tapis roulant omnidirectionnel offre la possibilité de capturer les performances IADL dans des conditions cognitives complexes qui reproduisent mieux les environnements du monde réel, ce qui peut entraîner des diagnostics plus précoces de maladie neurologique54.
La plateforme CC-VRS comble l’écart clinique en fournissant une approche standardisée, systématique, objective et quantitative pour caractériser les capacités IADL chez les personnes âgées et celles atteintes de maladies neurologiques. Sur la base de tests d’utilisabilité préliminaires et de données, les scénarios CC-VRS de base et complexes peuvent être complétés en moins de 30 minutes. Semblable à d’autres études immersives de RV avec18, la majorité des personnes atteintes de MP présentent des symptômes bénins du mal des transports. Du point de vue de la convivialité, le CC-SRV a reçu une cote globale de SUS de 75,7, ce qui correspond à une note de lettre « B » et se situe entre les catégories de descripteurs « bon » et « excellent »55. À titre de comparaison, une évaluation récente des applications populaires pour téléphones et tablettes fait état d’un score SUS moyen de 77,7 pour les 10 meilleures applications sur toutes les plates-formes56, y compris les applications mobiles telles que The Weather Channel et YouTube. Les commentaires des participants ont indiqué que la plupart des utilisateurs appréciaient le réalisme et la capacité d’interagir avec la plateforme CC-SRV. Il est important de noter que les participants se sont sentis mis au défi d’un point de vue physique et cognitif, ce qui indique que la conception a atteint son objectif de créer une plate-forme dynamique qui a recréé une expérience IADL complexe.
Nous avons déjà démontré que la technologie peut être intégrée avec succès dans les flux de travail cliniques dans l’évaluation des patients atteints de commotion cérébrale57 et dans un service neurologique occupé pour les patients atteints de sclérose en plaques (SEP)58. De plus, l’utilisation de la technologie dans la prise en charge des commotions cérébrales a amélioré les résultats et réduit les coûts59, tandis que son utilisation dans le traitement de la SP a permis de réaliser une économie de 27 % du temps consacré à la documentation dans le dossier de santé électronique dechaque patient de 60 ans. Compte tenu de l’objectif continu de réduire le coût de la prestation des soins61 et du temps consacré à la documentation dans le dossier de santé électronique qui est fréquemment cité pour l’épuisement professionnel des médecins62, l’intégration de la plateforme CC-VRS dans les soins cliniques est susceptible d’apporter une valeur ajoutée substantielle aux systèmes hospitaliers. Deux projets sont en cours dans lesquels la plateforme CC-VRS est intégrée 1) à un centre régional de soins primaires de santé familiale qui traite principalement les personnes âgées en bonne santé et 2) à une clinique spécialisée dans les troubles du mouvement à la Cleveland Clinic.
L’absence d’un biomarqueur physiologique ou numérique précis et fiable pour la MP et la maladie d’Alzheimer entraîne de grandes difficultés dans le diagnostic précoce et dans la mesure de la progression de la maladie63,64. La plateforme CC-VRS a le potentiel de fournir un biomarqueur numérique sous une seule plateforme technologique qui améliorera les soins cliniques et pourrait entraîner des essais cliniques plus courts et plus efficaces en réduisant la dépendance à l’égard de résultats cliniques subjectifs et très variables (p. ex., Movement Disorder Society – Unified Parkinson’s disease Rating Scale motor portion (MDS-UPDRS III)). L’évaluation des fonctions motrices et cognitives dans le domaine de la neurologie clinique n’a pas progressé de façon spectaculaire au cours des trois dernières décennies en termes d’évaluation des personnes atteintes de la MP et des symptômes moteurs cardinaux associés, sans parler des problèmes cognitifs ou à double tâche. L’avancée la plus célèbre dans l’évaluation des personnes atteintes de MP est la révision de l’échelle d’évaluation clinique subjective (MDS-UPDRS III). Il est important de noter que nous ne croyons pas que le CC-VRS supplantera le MDS-UPDRS III. Nous croyons plutôt que sa plus grande valeur peut être réalisée dans les pratiques de soins primaires en fournissant une approche normalisée et objective de la quantification des IADL. Bien qu’il soit prématuré de croire que le CC-VRS dans sa forme actuelle est un marqueur prodromique de la maladie neurologique, les résultats pourraient être utilisés pour hisser un drapeau « rouge » ou « jaune » en termes de fonctionnement neurologique pouvant déclencher une consultation par un spécialiste des troubles du mouvement, de la neuropsychologie ou de la gériatrie. En ce qui concerne son utilisation dans les soins cliniques de la MP, on s’attend à ce que le CC-VRS puisse être utilisé dans le titrage des médicaments ou dans la programmation éventuelle de dispositifs de stimulation cérébrale profonde. Les cas d’utilisation spécifiques aux soins primaires et à la DP sont actuellement en phase pilote. En immergeant véritablement l’utilisateur dans un environnement réaliste et en mesurant des aspects significatifs et importants de la fonction cognitive et motrice, le CC-VRS représente une première étape dans la création d’un biomarqueur numérique potentiellement efficace et évolutif pour les maladies neurologiques.
Le domaine de la neurologie clinique, en particulier les troubles du mouvement, est rempli d’exemples de technologies développées pour quantifier un seul symptôme isolé de la MP via un accéléromètre ou d’autres technologies decapteurs 65,66,67,68,69. À notre connaissance, aucune de ces approches, à l’exception de notre bilan 70,71,72,73 et des applications detremblements 74, n’a été intégrée aux soins cliniques de routine de la MP. La technologie antérieure est souvent valide et fiable; toutefois, l’accent a été mis sur le développement technologique, sans tenir compte de la faisabilité de l’intégration clinique75,76. Les patients, les fournisseurs, les hôpitaux et les organismes de réglementation s’intéressent de plus en plus aux mesures des résultats qui quantifient les changements dans les actions quotidiennes significatives 77,78,79,80. L’intégration clinique de mesures précises et significatives des symptômes neurologiques et de la performance de l’IADL est nécessaire pour évaluer systématiquement l’efficacité globale d’une intervention ou déterminer le potentiel d’une intervention à ralentir la progression de la maladie. L’élaboration d’une approche normalisée de l’évaluation de l’IADL adaptée à une utilisation clinique de routine est attrayante pour faciliter la compréhension et le traitement complets des maladies neurologiques sur des activités significatives.
L’approche CC-VRS de l’évaluation de la performance de l’IADL pour aider au diagnostic et à la prise en charge des maladies neurologiques a le potentiel de transformer les soins de santé grâce à un diagnostic précoce et à un suivi plus précis de la progression de la maladie. Cependant, il est pleinement reconnu que le système n’est pas sans limitation. Le coût du tapis roulant omnidirectionnel est considérable et peut constituer un obstacle à une adoption généralisée sans études systématiques d’économie de la santé afin d’identifier le seuil de rentabilité potentiel entre le coût de l’évaluation par rapport à la valeur d’un diagnostic précoce ou d’un suivi plus précis de la progression de la maladie. Notamment, les lacunes dans l’acquisition de résultats centrés sur le patient avec la technologie ont été mises en évidence par le National Institute of Neurological Disorders and Stroke Conference78, le MDS Task Force on Technology77 et la FDA. Ils ont appelé à une technologie qui mesure les activités significatives de DP et l’intégration de ces résultats dans les soins cliniques. Nous évaluons actuellement l’intégration du CC-VRS dans un cadre de soins primaires et un centre de troubles du mouvement à la Cleveland Clinic; ces déploiements utiliseront des tapis roulants omnidirectionnels plus abordables. Une collecte réussie de données nécessite un investissement initial de temps de la part du clinicien pour apprendre à configurer et à utiliser le système. Les projets pilotes cliniques en cours permettront de mieux déterminer la quantité de formation requise pour devenir un utilisateur compétent. On pourrait imaginer un modèle dans lequel un technicien est employé pour faire fonctionner le système, et les patients terminent les tâches d’achat plutôt que de s’asseoir dans une salle d’attente avant un rendez-vous. Ces données pourraient ensuite être intégrées instantanément dans le dossier de santé électronique avant de voir leur fournisseur. Ces types d’applications ont le potentiel de devenir la salle d’attente de l’avenir pour les patients.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cette étude a été parrainée par la Fondation Michael J. Fox pour la recherche sur la maladie de Parkinson (MJFF-020020) et la Chaire de la famille Edward et Barbara Bell. Nous remercions Elm Park Labs (Detroit, MI) pour son aide dans la construction de l’environnement VR et la liaison avec le tapis roulant omnidirectionnel. Nous remercions également Evelyn Thoman et Brittney Moser pour leur aide dans le développement et l’exécution de projets.
Materials
| Cleanbox | Cleanbox | UV hygienic cleaning system used for disenfecting the VR headset | |
| Desktop PC | Dell | High-end gaming desktop | |
| Infinadeck Omnidirectional Treadmill | Infinadeck | Omnidirectional treadmill allows you walk in any direction | |
| Safety Harness | Ymachray | Standard saftey harness to prevent the patient from falling | |
| Valve Index Base Stations x3 | Valve | Tracking of the headset/controllers and trackers | |
| Valve Index Controllers (one set of 2) | Valve | Hand controllers to interact with the digital content | |
| Valve Index VR headset | Valve | VR headset | |
| Vive tracker 3.0 x3 | HTC | Placed on feet and waist to track position and control movement of treadmill | |
| Vive tracker straps | Skywin VR | Secures the Vive tracker around the waist | |
| Zip ties | Used to affix Vive trackers to shoelaces |
References
- Grand Challenges for Engineering. National Academy of Sciences Available from: https://16mhpx3atvadrnpip2kwi9or-wpengine.netdna-ssl.com/wp-content/uploads/2016/12/GrandChallenges.pdf (2008)
- Turso-Finnich, T., Jensen, R. O., Jensen, L. X., Konge, L., Thinggaard, E. Virtual reality head-mounted displays in medical education-a systematic review. Simulation in Healthcare. , (2022).
- Chen, T., et al. Virtual reality as a learning tool in spinal anatomy and surgical techniques. North American Spine Society Journal. 6, 100063 (2021).
- Gold, J. I., SooHoo, M., Laikin, A. M., Lane, A. S., Klein, M. J. Effect of an immersive virtual reality intervention on pain and anxiety associated with peripheral intravenous catheter placement in the pediatric setting: a randomized clinical trial. JAMA Network Open. 4 (8), 2122569 (2021).
- Huang, Q., Lin, J., Han, R., Peng, C., Huang, A. Using virtual reality exposure therapy in pain management: a systematic review and meta-analysis of randomized controlled trials. Value Health. 25 (2), 288-301 (2022).
- Groninger, H., Stewart, D., Wesley, D., Cowgill, J., Mete, M. Virtual reality for management of cancer pain: Study rationale and design. Contemporary Clinical Trials Communications. 26, 100895 (2022).
- Zhang, B., Li, D., Liu, Y., Wang, J., Xiao, Q. Virtual reality for limb motor function, balance, gait, cognition and daily function of stroke patients: A systematic review and meta-analysis. Journal of Advanced Nursing. 77 (8), 3255-3273 (2021).
- Saredakis, D., et al. Factors Associated with virtual reality sickness in head-mounted displays: a systematic review and meta-analysis. Frontiers in Human Neuroscience. 14, 96 (2020).
- Kim, H. K., Park, J., Choi, Y., Choe, M. Virtual reality sickness questionnaire (VRSQ): Motion sickness measurement index in a virtual reality environment. Applied Ergonomics. 69, 66-73 (2018).
- Cobb, S. V. G., Nichols, S., Ramsey, A., Wilson, J. R. Virtual reality-induced symptoms and effects (VRISE). Presence-Teleoperators and Virtual Environments. 8, 169-186 (1999).
- Kennedy, R., Lane, N., Lilienthal, M., Berbaum, K., Hettinger, L. Profile analysis of simulator sickness symptoms: application to virtual environment systems. Presence-Teleoperators and Virtual Environments. 1 (3), 295-301 (1992).
- Duzmanska, N., Strojny, P., Strojny, A. Can simulator sickness be avoided? a review on temporal aspects of simulator sickness. Frontiers in Psychology. 9, 2132 (2018).
- Reason, J. T. Motion sickness adaptation: a neural mismatch model. Journal of the Royal Society of Medicine. 71 (11), 819-829 (1978).
- Chance, S. S., Gaunet, F., Beall, A. C., Loomis, J. M. Locomotion mode affects the updating of objects encountered during travel: the contribution of vestibular and proprioceptive inputs to path integration. Presence Teleoperators & Virtual Environments. 7 (2), 168-178 (1998).
- Waller, D., Bachmann, E., Hodgson, E., Beall, A. C. The HIVE: a huge immersive virtual environment for research in spatial cognition. Behavior Research Methods. 39 (4), 835-843 (2007).
- Loomis, J. M., Blascovich, J. J., Beall, A. C. Immersive virtual environment technology as a basic research tool in psychology. Behavior Research Methods, Instruments, & Computers. 31 (4), 557-564 (1999).
- Mirelman, A., et al. Addition of a non-immersive virtual reality component to treadmill training to reduce fall risk in older adults (V-TIME): a randomised controlled trial. Lancet. 388 (10050), 1170-1182 (2016).
- Kim, A., Darakjian, N., Finley, J. M. Walking in fully immersive virtual environments: an evaluation of potential adverse effects in older adults and individuals with Parkinson’s disease. Journal of NeuroEngineering and Rehabilitation. 14 (1), 16 (2017).
- Pelosin, E., et al. Motor-cognitive treadmill training with virtual reality in Parkinson’s disease: the effect of training duration. Frontiers in Aging Neuroscience. 13, 753381 (2021).
- Darken, R. P., Cockayne, W. R., Carmein, D. The omni-directional treadmill: A locomotion device for virtual worlds. Proceedings of the 10th Annual ACM Symposium on User Interface Software and Technology. , 213-221 (1997).
- Guo, H. J., Sapra, A. . Instrumental Activity of Daily Living. , (2021).
- Darweesh, S. K., et al. Trajectories of prediagnostic functioning in Parkinson’s disease. Brain. 140 (2), 429-441 (2017).
- Foubert-Samier, A., et al. Cognitive and functional changes in prediagnostic phase of Parkinson disease: A population-based study. Parkinsonism & Related Disorders. 79, 40-46 (2020).
- Marshall, G. A., Amariglio, R. E., Sperling, R. A., Rentz, D. M. Activities of daily living: where do they fit in the diagnosis of Alzheimer’s disease. Neurodegenerative Disease Management. 2 (5), 483-491 (2012).
- Sikkes, S. A., et al. Assessment of instrumental activities of daily living in dementia: diagnostic value of the Amsterdam Instrumental Activities of Daily Living Questionnaire. Journal of Geriatric Psychiatry and Neurology. 26 (4), 244-250 (2013).
- American Occupational Therapy Association. Occupational therapy practice framework: domain and process. American Journal of Occupational Therapy. 56 (6), 609-639 (2002).
- MacPherson, S. E. Definition: Dual-tasking and multitasking. Cortex. 106, 313-314 (2018).
- O’Shea, S., Morris, M. E., Iansek, R. Dual task interference during gait in people with Parkinson disease: effects of motor versus cognitive secondary tasks. Physical Therapy. 82 (9), 888-897 (2002).
- Romero-Ayuso, D., et al. Assessment of cognitive instrumental activities of daily living: a systematic review. Disability and Rehabilitation. 43 (10), 1342-1358 (2019).
- Goetz, C. G., et al. Movement Disorder Society-sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Movement Disorders. 23 (15), 2129-2170 (2008).
- Perlmutter, J. S. Assessment of Parkinson disease manifestations. Current Protocols in Neuroscience. , 1382-1387 (2009).
- Palmer, J. L., et al. Unified Parkinson’s Disease Rating Scale-Motor Exam: inter-rater reliability of advanced practice nurse and neurologist assessments). Journal of Advanced Nursing. 66 (6), 1382-1387 (2010).
- Neisser, U. On "Social Knowing". Personality and Social Psychology Bulletin. 6 (4), 601-604 (1980).
- Neisser, U. . Memory Observed: Remembering in Natural Contexts. , (1982).
- Jekel, K., et al. Mild cognitive impairment and deficits in instrumental activities of daily living: a systematic review. Alzheimer’s Research & Therapy. 7 (1), 17 (2015).
- Chisholm, D., Toto, P., Raina, K., Holm, M., Rogers, J. Evaluating capacity to live independently and safely in the community: Performance assessment of self-care skills. British Journal of Occupational Therapy. 77 (2), 59-63 (2014).
- Cipresso, P., et al. Virtual multiple errands test (VMET): a virtual reality-based tool to detect early executive functions deficit in Parkinson’s disease. Frontiers in Behavioral Neuroscience. 8, 405 (2014).
- Owsley, C., Sloane, M., McGwin, G., Ball, K. Timed instrumental activities of daily living tasks: relationship to cognitive function and everyday performance assessments in older adults. Gerontology. 48 (4), 254-265 (2002).
- Brennan, L., et al. The Penn Parkinson’s Daily Activities Questionnaire-15: Psychometric properties of a brief assessment of cognitive instrumental activities of daily living in Parkinson’s disease. Parkinsonism & Related Disorders. 25, 21-26 (2016).
- Arlati, S., et al. Acceptance and usability of immersive virtual reality in older adults with objective and subjective cognitive decline. Journal of Alzheimer’s Disease. 80 (3), 1025-1038 (2021).
- Porffy, L. A., et al. A novel virtual reality assessment of functional cognition: validation study. Journal of Medical Internet Research. 24 (1), 27641 (2022).
- Swanson, C. W., Fling, B. W. Discriminative mobility characteristics between neurotypical young, middle-aged, and older adults using wireless inertial sensors. Sensors. 21 (19), 6644 (2021).
- Yeh, T. T., Liang, P. J., Lee, S. C. Differences in walking-to-turning characteristics between older adult fallers and nonfallers: a prospective and observational study using wearable inertial sensors. International Journal of Rehabilitation Research. 45 (1), 53-57 (2022).
- Zach, H., et al. Identifying freezing of gait in Parkinson’s disease during freezing provoking tasks using waist-mounted accelerometry. Parkinsonism & Related Disorders. 21 (11), 1362-1366 (2015).
- Bhatt, H., Pieruccini-Faria, F., Almeida, Q. J. Dynamics of turning sharpness influences freezing of gait in Parkinson’s disease. Parkinsonism & Related Disorders. 19 (2), 181-185 (2013).
- Hoops, S., et al. Validity of the MoCA and MMSE in the detection of MCI and dementia in Parkinson disease. Neurology. 73 (21), 1738-1745 (2009).
- Bruck, S., Watters, P. A. Estimating cybersickness of simulated motion using the simulator sickness questionnaire (SSQ): A controlled study. Proceedings of the 2009 Sixth International Conference on Computer Graphics, Imaging and Visualization; Institute of Electrical and Electronics Engineers (IEEE). , 486-488 (2009).
- Kennedy, R. S., Lane, N. E., Berbaum, K. S., Lilienthal, M. G. Simulator sickness questionnaire: An enhanced method for quantifying simulator sickness. The International Journal of Aviation Psychology. 3 (3), 203-220 (1993).
- Brooke, S. . Usability Evaluation in Industry. , 189-194 (1996).
- Lewis, J. R., Sauro, J. The factor structure of the system usability scale. Human Centered Design. , 94-103 (2009).
- Sauro, J., Lewis, J. R. . Quantifying the User Experience: Practical Statistics for User Research. 2nd ed. , (2016).
- Niehorster, D. C., Li, L., Lappe, M. The accuracy and precision of position and orientation tracking in the HTC Vive virtual reality system for scientific research. i-Perception. 8 (3), 2041669517708205 (2017).
- Suchy, Y., Kraybill, M. L., Franchow, E. Instrumental activities of daily living among community-dwelling older adults: discrepancies between self-report and performance are mediated by cognitive reserve. Journal of Clinical and Experimental Neuropsychology. 33 (1), 92-100 (2011).
- Reppermund, S., et al. Impairment in instrumental activities of daily living with high cognitive demand is an early marker of mild cognitive impairment: the Sydney memory and ageing study. Psychological Medicine. 43 (11), 2437-2445 (2013).
- Bangor, A., Kortum, P. T., Miller, J. T. An empirical evaluation of the system usability scale. International Journal of Human-Computer Interaction. 24 (6), 574-594 (2008).
- Kortum, P., Sorber, M. Measuring the usability of mobile applications for phones and tablets. International Journal of Human-Computer Interaction. 31 (8), 518-529 (2015).
- Alberts, J. L., et al. Development and implementation of a multi-disciplinary technology enhanced care pathway for youth and adults with concussion. Journal of Visualized Experiments. (143), e58962 (2019).
- Rhodes, J. K., et al. Multiple Sclerosis performance test: technical development and usability. Advances in Therapy. 36 (7), 1741-1755 (2019).
- Alberts, J. L., et al. A technology-enabled concussion care pathway reduces costs and enhances care. Physical Therapy. 100 (1), 136-148 (2020).
- Macaron, G., et al. Technology-enabled assessments to enhance multiple sclerosis clinical care and research. Neurology Clinical Practice. 10 (3), 222-231 (2020).
- Porter, M. E. What is value in health care. The New England Journal of Medicine. 363 (26), 2477-2481 (2010).
- Sutton, J. M., Ash, S. R., Al Makki, A., Kalakeche, R. A. A daily hospital progress note that increases physician usability of the electronic health record by facilitating a problem-oriented approach to the patient and reducing physician clerical burden. The Permanente Journal. 23, (2019).
- Maetzler, W., et al. Modernizing daily function assessment in Parkinson’s disease using capacity, perception, and performance measures. Movement Disorders. 36 (1), 76-82 (2021).
- Stephenson, D., Badawy, R., Mathur, S., Tome, M., Rochester, L. Digital progression biomarkers as novel endpoints in clinical trials: a multistakeholder perspective. Journal of Parkinson’s Disease. 11, 103-109 (2021).
- Lu, M., et al. Vision-based estimation of MDS-UPDRS Gait scores for assessing Parkinson’s Disease motor severity. Medical Image Computing and Computer-Assisted Intervention. 12263, 637-647 (2020).
- Hobert, M. A., et al. Progressive gait deficits in Parkinson’s disease: a wearable-based biannual 5-year prospective study. Frontiers in Aging Neuroscience. 11, 22 (2019).
- Thorp, J. E., Adamczyk, P. G., Ploeg, H. L., Pickett, K. A. Monitoring motor symptoms during activities of daily living in individuals with Parkinson’s disease. Frontiers in Neurology. 9, 1036 (2018).
- Shawen, N., et al. Role of data measurement characteristics in the accurate detection of Parkinson’s disease symptoms using wearable sensors. Journal of NeuroEngineering and Rehabilitation. 17 (1), 52 (2020).
- Lu, R., et al. Evaluation of wearable sensor devices in Parkinson’s disease: a review of current status and future prospects. Parkinsons Disease. 2020, 4693019 (2020).
- Ozinga, S. J., Alberts, J. L. Quantification of postural stability in older adults using mobile technology. Experimental Brain Research. 232 (12), 3861-3872 (2014).
- Ozinga, S. J., et al. Three-dimensional evaluation of postural stability in Parkinson’s disease with mobile technology. NeuroRehabilitation. 41 (1), 211-218 (2017).
- Ozinga, S. J., Linder, S. M., Alberts, J. L. Use of mobile device accelerometry to enhance evaluation of postural instability in Parkinson disease. Archives of Physical Medicine and Rehabilitation. 98 (4), 649-658 (2017).
- Ozinga, S. J., Machado, A. G., Miller Koop, M., Rosenfeldt, A. B., Alberts, J. L. Objective assessment of postural stability in Parkinson’s disease using mobile technology. Movement Disorders. 30 (9), 1214-1221 (2015).
- Maldonado-Naranjo, A., Koop, M. M., Hogue, O., Alberts, J., Machado, A. Kinematic metrics from a wireless stylus quantify tremor and bradykinesia in Parkinson’s disease. Parkinson’s Disease. 2019, 6850478 (2019).
- Lingaiah, A., et al. Improving anxiety in Parkinson’s disease: A cautionary tale about mobile health technologies. Parkinsonism & Related Disorders. 73, 50-51 (2020).
- di Biase, L., et al. Quantitative analysis of bradykinesia and rigidity in Parkinson’s disease. Frontiers in Neurology. 9, 121 (2018).
- Espay, A. J., et al. Technology in Parkinson’s disease: Challenges and opportunities. Movement Disorders. 31 (9), 1272-1282 (2016).
- Sieber, B. A., et al. Prioritized research recommendations from the National Institute of Neurological Disorders and Stroke Parkinson’s Disease 2014 conference. Annals of Neurology. 76 (4), 469-472 (2014).
- van Uem, J. M., et al. Health-related quality of life in patients with Parkinson’s disease–A systematic review based on the ICF model. Neuroscience & Biobehavioral Reviews. 61, 26-34 (2016).
- Papadopoulos, E., Buracchio, T. Drug Development Tool (DDT) COA #000142. U.S. Food & Drug Administration. , (2021).

