Transfert de chaleur oesophagienne pour le contrôle de la température du Patient et de la gestion de la température ciblée
Summary
Cette étude présente une nouvelle méthode pour contrôler la température du patient efficace pour le refroidissement ou le réchauffement des patients. Une seule utilisation, dispositif triple lumen est placé dans le œsophage, analogue à un tube orogastrique standard et se connecte à existants échangeurs de chaleur pour effectuer la gestion de la température automatique du patient.
Abstract
Il est important pour une grande variété d’affections cliniques de contrôler la température du patient. Refroidissement normal ou inférieure à la température normale du corps est souvent réalisée pour la neuroprotection après accident ischémique (accident vasculaire cérébral hémorragique, hémorragie méningée, un arrêt cardiaque ou autre hypoxémique). Refroidissement des États fébriles traite la fièvre et réduit les effets négatifs de l’hyperthermie sur les neurones lésés. Les patients sont réchauffées au bloc opératoire pour éviter l’hypothermie périopératoire par inadvertance, qui est connu pour causer la perte de sang accru, infections de plaies et lésions myocardiques, tout en également prolonger le temps de récupération. Il existe de nombreuses approches signalées pour la gestion de la température, y compris les méthodes improvisées que norme réaffecter fournitures de bureau (p. ex., glace, saline réfrigérée, ventilateurs, couvertures), mais sont de technologies plus sophistiquées conçues pour la gestion de la température généralement plus de succès dans la réalisation d’un protocole optimisé. Durant la dernière décennie, les technologies de pointe ont développé autour de deux méthodes de transfert de chaleur : dispositifs de surface (eau, couvertures, réchauffeurs d’air forcé) ou dispositifs intravasculaires (cathéters stériles exigeant le placement vasculaire). Récemment, un nouveau dispositif est devenu disponible qui est placé dans le œsophage, analogue à un tube orogastrique standard, qui fournit le transfert de chaleur efficace autour du noyau du patient. L’appareil se connecte pour les échangeurs de chaleur pour permettre la gestion automatique de la température patient via un mécanisme servo, à l’aide de la température du patient de capteurs de température standard (température rectale, Foley, ou autre core thermosondes) tant que la variable d’entrée. Cette approche élimine les complications vasculaires placement (thrombose veineuse profonde, infection sanguine ligne centrale associé), réduit les obstacles à l’accès des patients et entraîne moins de frissons par rapport aux approches de surface. Les données publiées ont également montré un degré élevé de précision et de maintien de la température de la cible en utilisant l’approche oesophagienne à la gestion de la température. Par conséquent, le but de cette méthode est de fournir une méthode alternative de faible risque pour contrôler la température du patient en soins intensifs.
Introduction
Il y a un besoin important pour la gestion de la température du patient lors du traitement d’un large éventail de conditions, y compris un arrêt cardiaque réfractaire ou fièvre récurrente, fièvre neurogène et une intervention chirurgicale majeure. Aux États-Unis, un demi-million de cardiaques chaque année sont créés dans l’ hôpital (par exemple, chez les patients qui subissent des soins pour des conditions médicales ou chirurgicales générales)1 ou sorti de l’hôpital (par exemple, à la maison ou dans des lieux publics, qui est ensuite présentée au service des urgences)2. Dans les deux scénarios, des patients sont significativement améliorées quand la gestion température active est administrée3 et gestion température ciblée (TTM) est une norme de diligence pour arrêt cardiaque depuis 2005. Plus 5 millions de patients sont hospitalisés aux soins intensifs annuellement dans les Etats-Unis4 . Parmi ceux-ci, la fièvre apparaît jusqu’à 45 % des patients blessés non-neurologiquement5 et jusqu’à 70 % des patients blessés neurologiquement6. Contrôle de fièvre dans l’unité de soins intensifs est associée de l’amélioration des résultats et de la réduction du risque de mort, car une température élevée augmente les besoins métaboliques, aggrave l’ischémie cérébrale et augmente la perte neuronale7. Au moins 10 millions chirurgies effectuées chaque année aux États-Unis exigent un réchauffement patient actif afin d’éviter d’hypothermie périopératoire par inadvertance8. Dans la salle d’opération, les patients subissant une chirurgie doivent maintenir une température corporelle supérieure à 36 ° C afin d’éviter un grand nombre d’effets indésirables. Imprévus de diminutions de température corporelle avant, pendant ou après chirurgie augmentation sang perte, les infections et l’hôpital durée de séjour, qui ajoute $ 7 000 ou plus par patient en hospitalisation frais9,10,11 ,,12.
Malgré le grand besoin de clinique, les protocoles de gestion de température plus largement administré démontrent un rendement médiocre ou présentent un risque important pour le patient. Dispositifs de surface (par exemple eau couvertures, matelas de conduction et air pulsé couvertures) sont lourdes, ont limité la capacité de transfert de chaleur et doivent être enlevés pour permettre l’accès au patient pour les soins aux patients et des procédures. Les dispositifs intravasculaires sont envahissantes, difficiles à placer et à prédisposer les patients aux infections et les caillots de sang. Approches existantes pour éviter l’hypothermie périopératoire par inadvertance ne parviennent pas à maintenir la normothermie jusqu’à 70 % de l’heure12,13,14,15,16 et une analyse rétrospective d’arrêt cardiaque après refroidissement trouvé qu’en général, 30 % des patients n’ont pas atteint la température de consigne au sein de 6 h17.
L’approche oesophagienne à la gestion de la température du patient offre des avantages substantiels pour les technologies18. Le dispositif de gestion de température oesophagienne maintient la fonctionnalité du tube gastrique généralement placé dans les soins intensifs et les populations de patients chirurgicale. Il permet une aspiration gastrique continue et la décompression des gaz et des liquides tout en y ajoutant la possibilité de contrôler la température du patient en toute sécurité et efficacement en s’appuyant sur l’environnement d’échange thermique favorable de l’oesophage (Figure 1). Modulation de la température est obtenue en reliant le dispositif de gestion de température oesophagienne à l’une de plusieurs échangeurs thermiques externes (également appelés réfrigérants) qui utilisent l’eau comme liquide de refroidissement. Plusieurs vendeurs produisent des échangeurs de chaleur compatibles qui sont disponibles dans les hôpitaux pour alimenter les produits existants de contrôle de température (le plus souvent l’eau couvertures). Infirmières, médecins ou infirmières praticiennes généralement placer un dispositif de gestion de température oesophagienne, mais il peut également être inséré par n’importe quel fournisseur formé pour placer un tube orogastrique standard. Le dispositif de gestion de température oesophagienne ne restreint pas l’accès au patient, ne doivent pas être stérile, évite le risque de blessures par piqûre d’aiguille entre fournisseurs et évite les risques de complications de la peau, bactériémies et les caillots de sang chez le patient. Par conséquent, le but de cette méthode est de fournir une méthode alternative de faible risque pour contrôler la température du patient dans les milieux de soins et de la salle d’opération critique.
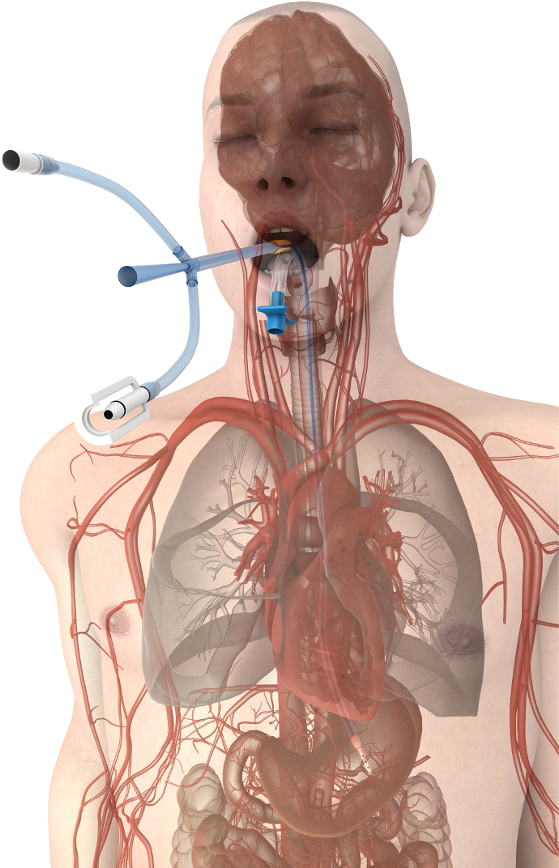
Figure 1. Emplacement d’appareil gestion température œsophagienne. Proximité de périphérique avec les gros vaisseaux et le cœur promouvoir le transfert de chaleur efficace au cœur du patient. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Modification et dépannage requis pour que ce protocole est généralement limités à celui présenté ci-dessus et implique la surveillance typique des soins aux patients en soins intensifs. Modulant la température centrale est essentielle pour des patients dans une gamme croissante de scénarios cliniques. Il s’agit de l’induction intentionnelle d’hypothermie de normothermie, réchauffement d’hypothermie accidentelle ou intentionnelle, et activement maintenir une température corporelle normale (c’est-à-dire normothermie) au cours de la conjoncture dans laquelle hypothermie accidentelle sont commune, comme dans la salle d’opération. Comme exemples cliniques spécifiques, les patients qui souffrent d’ischémie-reperfusion, comme se produit au cours d’un arrêt cardiaque, bénéficier de refroidissement (généralement à des températures inférieures à la température normale du corps), suivie de la prévention du réchauffement et de la fièvre douce pour jusqu’à 3 jours après réanimation28,29,30. Nouveau-nés souffrant de l’encéphalopathie hypoxique ischémique obtenir meilleurs résultats si refroidi en dessous de la température corporelle normale31. Le refroidissement des donneurs de reins après décès neurologique, avant la greffe d’organe, s’est avéré réduire le taux de greffon retardée fonction32. Contrôle de fièvres chez les patients de choc septique peut réduire les besoins de vasopresseurs et contribuer à la réduction de la mortalité précoce33. Maintien de normothermie chez les patients qui subissent des procédures chirurgicales réduit les infections de plaie opératoire, complications myocardiques, perte de sang et exigences de transfusion, tout en raccourcissant la durée du séjour et en réduisant les risques de mort10 , 11 , 16.
Limites de la technique concernent les défis rencontrés dans la gestion des patients de soins intensifs. Tandis que gestion ciblée de température favorise de bons résultats, techniques de modulation de température les plus courantes introduisent des risques aux patients et aux problèmes logistiques aux fournisseurs (y compris les difficultés de placement, de septicémies, de caillots de sang, dommages à la peau et le coût). Gestion de la température oesophagienne est conçue pour surmonter ces insuffisances34,35,36. Quand gérés de manière appropriée, le dispositif de gestion de température oesophagienne ne vient pas en contact avec le système vasculaire (comme la température intravasculaire périphériques de modulation) ou la peau (comme la température de surface des dispositifs de modulation), évitant ainsi les caillots de sang, bactériémie et la dégradation de la peau. L’appareil peut être placé rapidement par une variété de fournisseurs de soins de santé, généralement en quelques minutes,21,37. La technique d’insertion imite orogastrique standard mise en place, ce qui minimise les interruptions de flux de travail qui pourraient retarder l’initiation de la thérapie. En utilisant une approche de base semble aussi poser le fardeau sensiblement moins frissonnement de surface s’approche27,38,39,40 . Cela a l’avantage de réduire les sédatifs et les médicaments anti-frissons coûte, qui puis raccourcissent la patiente durée du séjour par l’intermédiaire de réveil plus rapide du plus bas degré de sédation nécessaire. Ces caractéristiques, considérées de concert avec les performances cliniques décrits ci-dessus, appuient la gestion de la température œsophagienne comme une option viable pour les fournisseurs dans le service des urgences, soins intensifs et bloc opératoire. De même, un ensemble croissant de données publiées sur le périphérique prend en charge cette nouvelle approche21,22,23,24,27,41.
Étapes critiques au sein du protocole comprennent initiant le débit dans l’appareil avant l’insertion, fournissant une lubrification adéquate à l’appareil afin d’assurer la mise en place facile, exécution d’aspiration gastrique et la décompression pour permettre un contact maximal entre dispositif et patient et s’adressant à tout patient frissons qui peuvent se développer. Suite à ce protocole fournira des résultats optimaux et permettent un haut degré de performance et de sécurité dans les soins de cette population de patients importante.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Aucun.
Materials
| EnsoETM | Attune Medical | ECD01 | Device compatible with Gaymar/Stryker Medi-Therm III and Stryker Altrix Precision Temperature Management System |
| EnsoETM | Attune Medical | ECD02 | Device compatible with Cincinnati SubZero Blanketrol II and Cincinnati SubZero Blanketrol III |
| Gaymar/Stryker Medi-Therm III | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Cincinnati SubZero Blanketrol II | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Cincinnati SubZero Blanketrol III | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Stryker Altrix Precision Temperature Management System | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Water-soluble lubricant | Various | n/a | Standard water-soluble lubricant used to ease insertion of tubes, catheters, and digits |
| Securement device | Various | n/a | E.g., Guard360 by PrimeGuard Medical |
References
- Chan, P. S., Krumholz, H. M., Nichol, G., Nallamothu, B. K. Delayed time to defibrillation after in-hospital cardiac arrest. N Engl J Med. 358 (1), 9-17 (2008).
- Callans, D. J. Out-of-Hospital Cardiac Arrest — The Solution Is Shocking. N Engl J Med. 351 (7), 632-634 (2004).
- Kochanek, P. M., Jackson, T. C. The Brain and Hypothermia-From Aristotle to Targeted Temperature Management. Crit Care Med. 45 (2), 305-310 (2017).
- Laupland, K. B., et al. Occurrence and outcome of fever in critically ill adults. Crit Care Med. 36 (5), 1531-1535 (2008).
- Diringer, M. N., Reaven, N. L., Funk, S. E., Uman, G. C. Elevated body temperature independently contributes to increased length of stay in neurologic intensive care unit patients. Critical Care Medicine. 32 (7), 1489-1495 (2004).
- Laupland, K. B. Fever in the critically ill medical patient. Critical care medicine. 37 (Suppl 7), S273-S278 (2009).
- Mathias, J. M. Hospitals to report on normothermia. OR manager. 25 (9), 22-24 (2009).
- Rajagopalan, S., Mascha, E., Na, J., Sessler, D. I. The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 108 (1), 71-77 (2008).
- Kurz, A., Sessler, D. I., Lenhardt, R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med. 334 (19), 1209-1215 (1996).
- Sessler, D. I. New surgical thermal management guidelines. Lancet. 374 (9695), 1049-1050 (2009).
- Young, V. L., Watson, M. E. Prevention of perioperative hypothermia in plastic surgery. Aesthet Surg J. 26 (5), 551-571 (2006).
- Hedrick, T. L., et al. Efficacy of protocol implementation on incidence of wound infection in colorectal operations. J Am Coll Surg. 205 (3), 432-438 (2007).
- Forbes, S. S., et al. Implementation of evidence-based practices for surgical site infection prophylaxis: results of a pre- and postintervention study. J Am Coll Surg. 207 (3), 336-341 (2008).
- Sun, Z., et al. Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiology. 122 (2), 276-285 (2015).
- Leary, M., et al. The association of body mass index with time to target temperature and outcomes following post-arrest targeted temperature management. Resuscitation. 85 (2), 244-247 (2014).
- Naiman, M., Shanley, P., Garrett, F., Kulstad, E. Evaluation of advanced cooling therapy’s esophageal cooling device for core temperature control. Expert Rev Med Devices. 13 (5), 423-433 (2016).
- Naiman, M., Markota, A., Hegazy, A. F., Dingley, J., Kulstad, E. Temperature Management in Critical Care and Burn Patients using an Esophageal Heat Transfer Device. Military Medicine. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Althenayan, E. Temperature control in critically ill patients with a novel esophageal cooling device: a case series. BMC Anesthesiol. 15, 152 (2015).
- Bukovnik, N., Markota, A., Velnar, T., Rebol, J., Sinkovic, A. Therapeutic hypothermia and inhalation anesthesia in a patient with severe pneumococcal meningitis and secondary cardiac arrest. Am J Emerg Med. 35 (4), 665.e665-665.e666 (2017).
- Markota, A., Fluher, J., Kit, B., Balazic, P., Sinkovic, A. The introduction of an esophageal heat transfer device into a therapeutic hypothermia protocol: A prospective evaluation. Am J Emerg Med. 34 (4), 741-745 (2016).
- Markota, A., Kit, B., Fluher, J., Sinkovic, A. Use of an oesophageal heat transfer device in therapeutic hypothermia. Resuscitation. 89, e1-e2 (2015).
- Schroeder, D. C., et al. Oesophageal heat exchangers with a diameter of 11mm or 14.7mm are equally effective and safe for targeted temperature management. PLoS One. 12 (3), e0173229 (2017).
- Williams, D., et al. Use of an Esophageal Heat Exchanger to Maintain Core Temperature during Burn Excisions and to Attenuate Pyrexia on the Burns Intensive Care Unit. Case Reports in Anesthesiology. 2016, 6 (2016).
- Khan, I., et al. . 14th Annual Neurocritical Care Society Meeting. , (2016).
- HACA. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 346 (8), 549-556 (2002).
- Bernard, S. A., et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med. 346 (8), 557-563 (2002).
- Callaway, C. W., et al. Part 8: Post-Cardiac Arrest Care: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S465-S482 (2015).
- Wyckoff, M. H., et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S543-S560 (2015).
- Niemann, C. U., et al. Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. N Engl J Med. 373 (5), 405-414 (2015).
- Schortgen, F., et al. Fever control using external cooling in septic shock: a randomized controlled trial. Am J Respir Crit Care Med. 185 (10), 1088-1095 (2012).
- Reccius, A., Mercado, P., Vargas, P., Canals, C., Montes, J. Inferior Vena Cava Thrombosis Related to Hypothermia Catheter: Report of 20 Consecutive Cases. Neurocrit Care. 23 (1), 72-77 (2015).
- Maze, R., et al. Endovascular cooling catheter related thrombosis in patients undergoing therapeutic hypothermia for out of hospital cardiac arrest. Resuscitation. 85 (10), 1354-1358 (2014).
- Simosa, H. F., Petersen, D. J., Agarwal, S. K., Burke, P. A., Hirsch, E. F. Increased risk of deep venous thrombosis with endovascular cooling in patients with traumatic head injury. Am Surg. 73 (5), 461-464 (2007).
- Kulstad, E., et al. Induction, maintenance, and reversal of therapeutic hypothermia with an esophageal heat transfer device. Resuscitation. 84 (11), 1619-1624 (2013).
- van Zanten, A. R., Polderman, K. H. Blowing hot and cold? Skin counter warming to prevent shivering during therapeutic cooling. Crit Care Med. 37 (6), 2106-2108 (2009).
- Tommasi, E., et al. Cooling techniques in mild hypothermia after cardiac arrest. J Cardiovasc Med. , (2014).
- Diringer, M. N. Treatment of fever in the neurologic intensive care unit with a catheter-based heat exchange system. Crit Care Med. 32 (2), 559-564 (2004).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. 46 (3), 143-148 (2017).

