Methodology for Studying Interactions of Vitamin A Membrane Receptors and Opsin Protein with their Ligands in Generating the Retinylidene Protein
Summary
Here, we describe two quantitative methods for studying the protein-ligand interactions of vitamin A membrane receptors and photoreceptor opsin with their respective physiological ligands.
Abstract
Distribution of dietary vitamin A/all-trans retinol (ROL) throughout the body is critical for maintaining retinoid function in peripheral tissues and generating the retinylidene protein for visual function. RBP4-ROL is the complex of ROL with retinol-binding protein 4 (RBP4), which is present in the blood. Two membrane receptors, Retinol Binding Protein 4 Receptor 2 (RBPR2) in the liver and STimulated by Retinoic Acid 6 Retinol (STRA6) in the eye, bind circulatory RBP4 and this mechanism is critical for internalizing ROL into cells. Establishing methods to investigate receptor-ligand kinetics is essential in understanding the physiological function of vitamin A receptors for retinoid homeostasis. Using Surface Plasmon Resonance (SPR) assays, we can analyze the binding affinities and kinetic parameters of vitamin A membrane receptors with its physiological ligand RBP4.
These methodologies can reveal new structural and biochemical information of RBP4-binding motifs in RBPR2 and STRA6, which are critical for understanding pathological states of vitamin A deficiency. In the eye, internalized ROL is metabolized to 11-cis retinal, the visual chromophore that binds to opsin in photoreceptors to form the retinylidene protein, rhodopsin. The absorbance of light causes the cis-to-trans isomerization of 11-cis retinal, inducing conformational changes in rhodopsin and the subsequent activation of the phototransduction cascade. Decreased concentrations of serum and ocular ROL can impact retinylidene protein formation, which in turn can cause rhodopsin mislocalization, apoprotein opsin accumulation, night blindness, and photoreceptor outer segment degeneration, leading to Retinitis Pigmentosa or Leber Congenital Amaurosis.
Therefore, spectrophotometric methodologies to quantify the G protein-coupled receptor opsin-11-cis retinal complex in the retina are critical for understanding mechanisms of retinal cell degeneration in the above-mentioned pathological states. With these comprehensive methodologies, investigators will be able to better assess dietary vitamin A supply in maintaining systemic and ocular retinoid homeostasis, which is critical for generating and maintaining retinylidene protein concentrations in photoreceptors, which is critical for sustaining visual function in humans.
Introduction
Dietary obtained Vitamin A/all-trans retinol/ROL is an important component playing a role in visual function1,2. The chromophore 11-cis retinal, a metabolite of dietary vitamin A, binds to the G protein-coupled receptor (GPCR) opsin to generate the retinylidene protein, rhodopsin, in the photoreceptors. When light falls on the eye, the configuration of rhodopsin undergoes a fundamental change via the conversion of its 11-cis-retinal component to the all-trans-retinal. This configuration change triggers a phototransduction cascade within the rod photoreceptors, converting light into an electrical signal, which is transmitted to the visual cortex in the brain via the optic nerve3,4,5,6,7,8,9,10. Decreased concentrations of serum and ocular ROL can impact retinylidene protein formation, which in turn causes opsin mislocalization, apoprotein opsin accumulation, night blindness, and photoreceptor OS degeneration, leading to Retinitis Pigmentosa or Leber Congenital Amaurosis, which can cause blindness3,10.
All-trans retinol is the fundamental transport form of dietary vitamin A and it is the source from which all functional retinoids and dietary vitamin A metabolites are derived. The liver serves as the primary organ for dietary vitamin A storage. Hepatic retinol is transported via the serum as its complex with retinol-binding protein 4 (RBP4). RBP4, primarily expressed in the liver, forms a holo-complex with the retinol substrate and transthyretin (TTR), which enters the circulation11,12,13,14,15,16,17. The report of a cell surface receptor for RBP4 in the 1970s led to the hypothesis of membrane transport proteins aiding the transport of retinoids in and out of cells. The cell surface receptor for RBP4-bound retinol (RBP4-ROL) was identified as STimulated by Retinoic Acid 6 Retinol (STRA6) in the retinal pigment epithelium (RPE) of the eye. STRA6 binds to the circulatory holo-RBP4 complex and shuttles the RBP4-bound retinol across the RPE to be utilized by photoreceptors18,19. Mutations in STRA6 can lead to a myriad of diseases and phenotypes associated with reduced ocular ROL concentrations. STRA6 mutations during development can lead to anophthalmia, microphthalmia, and other non-ocular symptoms that overlap with phenotypes associated with Matthew-Wood syndrome20,21,22,23,24,25,26,27. STRA6 is expressed in different organs and tissues, such as the RPE in the eye, but not in all tissues26,27. Although the primary site of retinoid storage is the liver, STRA6 is not expressed in the liver.
Alapatt and colleagues discovered that the Retinol Binding Protein 4 Receptor 2 (RBPR2) bound RBP4 with high affinity and was responsible for the uptake of RBP4-bound retinol in the liver, similar to STRA6 in the RPE28. RBPR2 has been reported to share structural homology with STRA629,30,31. RBP4 is proposed to bind to residues S294, Y295, and L296 on RBPR2, an amino acid-binding domain partially conserved between RBPR2 and STRA6 as well29,30,31. From these studies, vitamin A membrane receptors such as STRA6 and RBPR2, which contain one or more extracellular binding residues/domains, are proposed to interact with circulatory RBP4-ROL. Membrane receptors, therefore, play an important role in receptor binding to circulatory RBP4 for ROL internalization into target tissues, such as the liver and eye.
In the first part of this study, we utilized Surface Plasmon Resonance (SPR) to investigate the interaction of two vitamin A membrane receptors (RBPR2 and STRA6) with their physiological ligand RBP431. The binding affinities and association/dissociation kinetics of protein to ligand complexes can be measured in real time by using SPR. This methodology aimed to provide critical kinetic, structural, and biochemical information on RBP4-binding motifs in RBPR2 and STRA6, which are critical for understanding pathological states of vitamin A deficiency31,32. As mentioned above, circulatory ROL is internalized into the RPE via STRA6 to generate the chromophore 11-cis retinal, which binds to opsin to generate the retinylidene protein, rhodopsin, in photoreceptors33. We used spectrophotometry methodologies to quantify the GPCR-opsin and its ligand 11-cis retinal complex in murine retinal lysates, which is critical for understanding mechanisms of reduced retinylidene protein, rhodopsin, in Retinitis Pigmentosa or Leber Congenital Amaurosis ocular pathological states34. In general, these protocols can be applied to study in vitro the physiological consequences of mutant RBP4, STRA6, or RBPR2 in influencing systemic and ocular vitamin A homeostasis or the impact of mutant rhodopsin or retinoid cycle proteins on visual function35,36.
Protocol
1. Surface plasmon resonance (SPR) methodology
- Preparation and purification of mouse RBP4 protein
- Design primers to generate full-length mouse RBP4 (msRBP4) cDNA (NCBI Reference Sequence: NM_001159487.1). Clone the msRBP4 cDNA into a pET28a His-tag Kanamycin-resistant expression vector and express in BL-21 DE3 cells (Table of Materials).
- Transform the BL-21 DE3 competent cells (according to the manufacturer's protocol) with ligated msRBP4-pET28a vector and then plate onto Luria-Bertani (LB) broth Agar plates containing Kanamycin 50 µg/mL30,37. Incubate the plates overnight at 37 °C in an incubator and screen for positive colonies the next day.
- Pick a single colony and incubate overnight at 37 °C in 5 mL of LB broth containing Kanamycin 50 µg/mL.
- For secondary culture in 500 mL of LB broth containing Kanamycin 50 µg/mL, use 1% volume of primary culture (from step 1.1.3.) and incubate at 37 °C for 3-4 h; check the optical density using a spectrophotometer. Ideally, proceed if the OD value is between 0.6 and 1 to induce protein expression with 0.5 mM IPTG at 24 °C overnight.
- Use multiple IPTG concentrations of 0.1-1 mM and 16-30 °C temperature range to optimize msRBP4 expression and stability.
- Centrifuge the culture (from step 1.1.5.) at 16,000 × g for 10 min, discard the supernatant, and keep the pellet on ice.
- Homogenize the pellet with lysis buffer (50 mM Tris-HCl, 150 mM NaCl, 0.1% (v/v) Triton X-100, 10% Glycerol, 0.5 mM PMSF, and Protease Inhibitors [pH 8.0]). Sonicate the lysate for 15 s ON and 30 s OFF cycle using a homogenizer with a 250 Watt output and 40-50% 20 kHz output frequency. Repeat 5x.
- Remove the cell debris and unlysed cells by centrifugation at 16,000 × g for 20 min. Pass the supernatant of the lysate through a buffer-equilibrated nickel NTA column.
- Wash the column with lysis buffer (from step 1.1.8) containing 30 mM imidazole.
- In fractions, elute the bound msRBP4 protein using buffer containing 250 mM imidazole. Run the eluted fractions and visually monitor the protein quantity with a 12% SDS polyacrylamide gel, stained with Coomassie Brilliant Blue R-250 in methanol:water:acetic acid (45:45:10) solution and de-stain with solution without Coomassie stain methanol:water:acetic acid (45:45:10).
- Pool the unused fractions and dialyze the pooled fractions with a 10K dialysis cassette of 10 kDa MWCO.
- Evaluate the quality of the dialyzed fraction on a 12% SDS-PAGE gel and quantify the protein concentration.
NOTE: Apo-RBP4 protein was used in the SPR analysis. For generating holo-RBP4 (RBP4-retinol), refer to detailed protocols published elsewhere36,37.
- Initial validation of RBPR2 and STRA6 peptides with RBP4 for structure and interaction by Tryptophan fluorescence assay and circular dichroism (CD) spectroscopy
- Tryptophan fluorescence assay
- Use the online protein composition analysis tool (https://web.expasy.org/protparam/) and paste the amino acid sequence in one-letter code to assess the structural composition of recombinant RBP4 protein and the individual peptides of RBPR2 and STRA6 to determine the tryptophan amino acid residues in the individual peptides and protein (Table of Materials).
- Click on the compute parameters button and evaluate the amino acid composition for tryptophan (Trp) residues.
NOTE: Tryptophan residues must be present in the individual peptides or proteins being analyzed. - Dilute the individual RBPR2 and STRA6 peptides in various micromolar concentrations and incubate individually with 3 µg msRBP4 in a 96-well plate at room temperature for 5 min. Excite the mix at 290 nm and scan the emission from 300 nm to 400 nm wavelength.
- Normalize the data with the Blank (buffer only, no peptide and no protein) and peptide control condition (no protein) and plot.
NOTE: The tryptophan fluorescence increment upon exposure to a low to high peptide concentration suggests a positive interaction between the two individual peptides and RBP4 protein.
- Circular dichroism (CD) spectroscopy
- Dilute the individual peptides and recombinant RBP4 protein in 1x PBS buffer, pH 7.0. Use various concentrations of RBPR2 and STRA6 peptides and RBP4 protein from 0.1 to 10 μg/mL for a quality check, as described below.
- Add individual diluted peptides and protein in a 0.1 cm path length cuvette and measure the CD absorbance/ellipticity using a CD spectrophotometer (195-250 nm). Use the below formula to calculate the mean residue ellipticity (θ).
[v] = (S × mRw)/(10cl)
S represents the CD signal in mθ; mRw represents the mean residue mass; c represents the concentration of the protein in mg/mL; and l represents the path length in cm. - Calculate the percent change in molecule structure using BeStSel Secondary Structure Analysis to Protein Fold Prediction by CD Spectroscopy (https://bestsel.elte.hu).
NOTE: The secondary structure indicates the proper folding and conserved confirmations crucial for the interaction study and the outcome of the interactions. Inspect the predicted structure of the domain and proceed further with the interaction study.
- Tryptophan fluorescence assay
2. SPR analysis to determine the binding affinities and kinetic parameters of vitamin A membrane receptors (RBPR2 and STRA6) with their physiological ligand RBP4
- For the immobilization of RBP4 on CM5 Chip surface setup, we use the SPR sensor chip, which carries a carboxymethyl dextran linker extended to a size of ~100 nm covalently attached on a gold surface. In the presence of 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride (EDC), N-hydroxysuccinimide (NHS) converts the carboxyl groups on the chip's surface to N-Hydroxysuccinimide esters, which spontaneously react with the amine groups of amino acids and proteins, forcing the ligand to bond covalently onto the chip's surface (Table of Materials).
- Immobilize the purified msRBP4 protein on the Sensor chip (Figure 1 and Figure 2). In the software Run menu, choose the Wizard and proceed with the immobilization option. Dilute the ligand (msRBP4 protein obtained from step 1.1) in immobilization buffer (10 mM Sodium acetate buffer, pH 5.0) to 10 µg/mL (4 µL of ligand + 396 µL of buffer) and aliquot the coupling reagents in vials. Open the Immobilization Setup wizard window from the software control, select CM5 Chip, and option Immobilize flow cell 2 and target level of 1,200 Response Unit (RU) for achieving Rmax of 30 RU in the kinetic study and Wash solution: Ethanolamine. Enter the name RBP4 and click Next.
NOTE: Optional: System Preparations dialog box for the Prime before run option is not required if priming with running buffer PBST (phosphate-buffered saline solution with a 0.05% Tween 20 detergent solution) was performed previously. - In the Rack position dialog box, click Eject Rack. Take the rack and place the vials with assigned volumes for each reagent: 156 µL of msRBP4, 177 µL of ethanolamine, 89 µL of EDC, 89 µL of NHS, and an empty vial. Insert the rack with sample vials and click OK and Next.
- In the Prepare Run Protocol dialog, click Start and Save.
- Immobilize the purified msRBP4 protein on the Sensor chip (Figure 1 and Figure 2). In the software Run menu, choose the Wizard and proceed with the immobilization option. Dilute the ligand (msRBP4 protein obtained from step 1.1) in immobilization buffer (10 mM Sodium acetate buffer, pH 5.0) to 10 µg/mL (4 µL of ligand + 396 µL of buffer) and aliquot the coupling reagents in vials. Open the Immobilization Setup wizard window from the software control, select CM5 Chip, and option Immobilize flow cell 2 and target level of 1,200 Response Unit (RU) for achieving Rmax of 30 RU in the kinetic study and Wash solution: Ethanolamine. Enter the name RBP4 and click Next.
- RBPR2 and STRA6 peptides kinetic assay setup
- Serially dilute the mouse RBPR2, mutant RBPR2, and STRA6 peptides (chemically synthesized previously31 and listed in Table of Materials) in running buffer in a range of 0.8-26.6 μM.
- Open the control software and select Kinetics/Affinity wizard. Click File | Open template and select Kinetics/Affinity. Input the injection sequence dialog flow path 2-1 (Flow cell 2 as active and Flow cell 1 as reference), check the Chip Type CM5, and click Next. In the setup dialog, check the Run startup cycles, enter Solution: buffer and cycles: and click Next.
- In the injection parameters dialog, enter the values for sample parameters: contact time: 120 s, flowrate 30 μL/min, Dissociation time 300 s; for regeneration parameters: enter the Regeneration solution name: Glycine-HCl (pH 2.5), contact time: 30 s, flowrate: 30 μL/min and click Next.
- In the samples dialog, enter the nom of the peptides, molecular weight, and concentrations and click next. In the Rack position dialog, assign the diluted peptides as individual ~120 µL samples of various concentrations 1 to 100 µM and ~230 µL of Buffer, ~120 µL of Buffer, and ~1,000 µL of Glycine, pH 2.5, to the positions on the Rack. Click Eject Rack and insert all the vials. Click Next, and in the Prepare Run Protocol dialog, click Start, enter a file name, and Save (Figure 2).
- In the software, click the Start menu and select Evaluation. Choose open the file in the software, and from the dropdown selection menu, choose Fc2-1 to analyze the Reference cell Blank-subtracted Active sensorgram for the association and dissociation phases of the msRBP4 and mutant msRBPR2 and msSTRA6 peptides.
- Click on the dropdown Kinetics/Affinity button and choose Surface bound; to open the Select Curves dialog, check include column in the table and click Next. Select Data dialog to show blank-subtracted sensorgrams; click Kinetics and Affinity, keep the default parameters, and click Fit option for curve fitting. Inspect the Report tab for equilibrium dissociation constant Kd and Ka or Kon association rate and Kd or Koff dissociation rate. Save the Kinetics data sensorgram in .txt tab delimited format and use the values to plot graphs (Figure 3).
- To determine the affinity kinetics constant Kd (ligand concentration that binds to half the receptors at equilibrium), copy and paste the data columns in the .txt format file generated from the Evaluation to XY plot used in the software. Click Analyze and Nonlinear regression (curve fit), check the data column, and click Ok. In the parameter dialog, click Binding saturation and One site Specific binding fitting model with the formula of:
Y= (Bmax*X)/(Kd + X)
Where Bmax is the maximum number of binding sites (Response Unit), X is the concentration of the peptides, and Y is the binding (Response unit) (Figure 3).
3. Spectrophotometry methodology to quantify the GPCR-11- cis retinal protein complex (retinylidene protein rhodopsin) in retinal lysates
- Transport the predetermined group of mice consisting of adult WT-C57BL/6J mice to the dark room.
- Dark adapt the mice overnight for 12-16 h, and under red light, place the mouse in a euthanasia chamber and open the CO2 gas valve on the regulator to 5 L/min for ~5 min. Ensure death by applying pressure on the neck and tail pulled backward (cervical dislocation).
- Enucleate the eye globes and homogenize the eyes in an ice-cold buffer containing 20 mM bis-tris propane (1,3-bis (tris(hydroxymethyl)methylamino)propane; BTP) pH 7.4, 150 mM NaCl, 1 mM EDTA and with protease inhibitor (Table of Materials).
- Centrifuge the homogenate for 15 min at 16000 x g at 4 °C, discard the supernatant containing water soluble cytosolic proteins. Re-suspend and solubilize the pelleted membrane and membrane proteins in buffer containing 20 mM n-dodecyl-β-d-maltoside (DDM), 20 mM bis-tris propane (BTP) pH 7.4, 100 mM NaCl, 1 mM EDTA and with protease inhibitor for 1 h at 4 °C on a rotating platform.
- Centrifuge the resolubilized membrane fraction for 1 h at 16000 x g, 4 °C. Mix the supernatant with 30 μL of Rho 1D4 antibody beads and incubate for 1 h at 4 °C on a rotating platform.
- Using a magnetic stand, separate the pulldown using beads, discard the supernatant, and wash the beads with buffer 20 mM bis-tris propane (BTP) pH 7.4, 500 mM NaCl, and 2 mM DDM.
- Elute the rhodopsin protein by incubating for 5-10 min at room temperature with buffer 20 mM bis-tris propane (BTP) pH 7.4, 100 mM NaCl, 2 mM DDM containing 0.2 mg/mL 1D4 peptide (-TETSQVAPA) (Figure 4 and Figure 5).
- Analyze the elute for absorbance from 200 nm to 800 nm using a rectangular, sub-micro, quartz, 2 mm aperture, 10 mm path length, 50 μL cuvette in a fast scan setting with aspectrophotometer.
NOTE: Use only high-quality Quartz cuvettes (Figure 4). - To validate and determine quality, check and expose the elute to bright light for 1 min, then repeat step 3.8.
- Subtract the Blank absorbance and calculate the ratio of the analyzed absorbance spectra with absorbance at 500 nm for 11-cis retinal bound opsin, 380 nm for light-exposed all-trans retinal bound opsin, and 280 nm for ligand-free Apo-Opsin protein (Figure 6). The free opsin with no ligand retinal gives a baseline absorbance at 500 nm.
- To quantify rhodopsin concentration, use Beer-Lambert's Law:
A=ε·C·l or C=A/ε·l
Where A is the absorbance, ε the molar extinction coefficient (rhodopsin ε500 = 40,600 M−1 cm−1 for free Apo Opsin ε280 = 81,200 M−1 cm−1), C is the concentration, and l path length. - For quantifying liganded-Opsin in percentage, use a ratio of A280/A500.
- Plot the Blank-subtracted absorbance spectra and calculate the free opsin value32.
- Calculate the concentration of rhodopsin using the extinction coefficient ε500 = 40600 M−1 cm−1. The concentration of ligand-free opsin is calculated with Beer-Lambert Law using the extinction coefficient ε280 = 81,200 M−1 cm−1.
Representative Results
Quantitative methods are described to study protein-ligand interactions of vitamin A membrane receptors and photoreceptor opsin with their respective physiological ligands. The recombinant mouse RBP4 should be expressed in E. coli and the purified protein used as a conjugated ligand on a SPR Chip. The chemically synthesized RBPR2, STRA6, and mutant S294A RBPR2 "SYL motif RBP4 interacting extracellular site" of a ~40 amino acid peptide is used as analyte at various concentrations to measure the kinetics of binding and equilibrium saturation Kd of interaction (Figure 1 and Figure 2).
Recombinant RBP4 protein, as a ligand for RBPR2 and STRA6, showed a binding affinity towards the interacting sites in these peptides, measured at Kd ~22.38 µM and ~26.73 µM, respectively. The amino acid motif "SYL" plays an essential role in stabilizing these interactions both in RBPR2 and STRA6, and as predicted, the mutant peptide S294A had increased Kd of ~114.9 µM, suggesting an increased copy number of mutant-RBPR2 peptide requirements for reaching binding saturation (Figure 3). Retinol uptake in the eye via STRA6 and conversion into various retinoids to the final conversion of 11-cis retinal as chromophore with binding to Lysine 296 residue of Rhodopsin makes a functional receptor for photon sensing and vision. The 11-cis retinal covalent binding to protein Opsin to form Rhodopsin exhibits certain characteristic absorbance features. Protein absorbance occurs at 280 nm, and free Retinol absorbance is at ~325 nm. However, the holo-Opsin with 11-cis Retinal or Rhodopsin absorbance occurs at 500 nm wavelength.
Any defect in this complex formation because of the low systemic retinol or defect in retinol uptake by a mutation in RBPR2 or STRA6 leads to the accumulation of Free Opsin or apoprotein opsin devoid of chromophore 11-cis retinal, changing the characteristic absorbance shifts to low absorbance at 500 nm. By quantifying the absorbance and using the ratio of absorbance 280 nm and 500 nm wavelength, it is possible to estimate the liganded Opsins or Rhodopsin. Through a brief exposure of light, it is possible to cross-check the photo-isomerization of 11-cis retinal bound Opsin absorbance at 500 nm to all-trans-retinal-bound Opsin (Meta II rhodopsin) absorbance at 380 nm (Figure 4, Figure 5, and Figure 6). In an experimental setup, the chance of artifacts and contaminants is high; the two major sources of artifacts found are unintentional light exposure from the instruments and low-concentration salt wash with failure to remove contaminant molecules from the RPE or lens (Figure 7).

Figure 1: Surface Plasmon Resonance workspace. Materials needed and overview of the SPR instrumentation. (A) SPR Chip loading dock. (A') CM5 Chip with carboxymethylated dextran covalently attached gold surface for immobilization via -NH2, -SH, -CHO, -OH, or -COOH groups. (B) Sample loading robotic injector rack. (B') type 3 rubber caps. (B'') 7 mm plastic vials for sample aliquots. (C,D) Equilibration/running buffer reservoir and waste collection tank. (E) Biacore software control panel. Please click here to view a larger version of this figure.
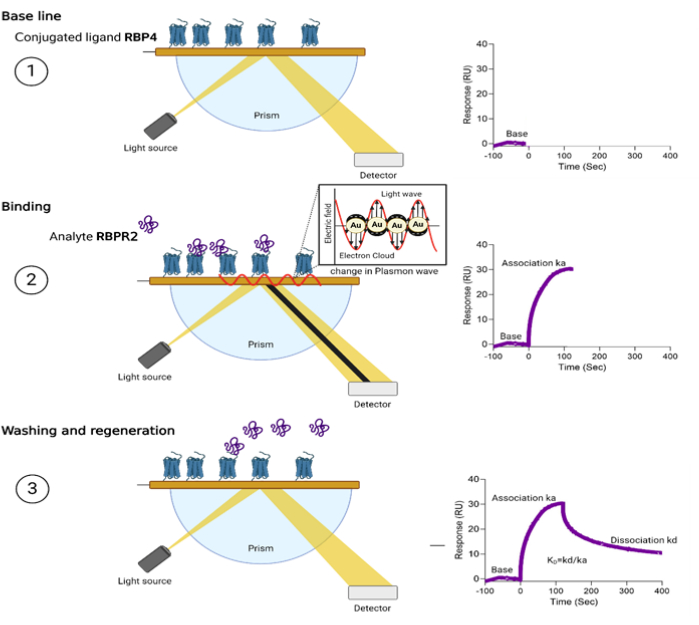
Figure 2: Schematic overview of Surface Plasmon Resonance and the steps of sensorgram acquisitions. Step 1: The CM5 Chip surface immobilized with RBP4 protein with a target of 1,200 response units. Step 2: Various concentrations of RBPR2 peptides are run as analytes, and this biomolecular interaction changes the electron charge density on the gold Chip surface, leading to the change/reduction in light reflection at a specific angle or a resonance angle. Step 3: The washing reverses the surface plasmon phenomenon, leading to the reversal of reflection intensity and the drop of the sensorgram to the baseline. The kinetics of these interactions were further used to determine the association dissociation constants and strength of interactions. Please click here to view a larger version of this figure.
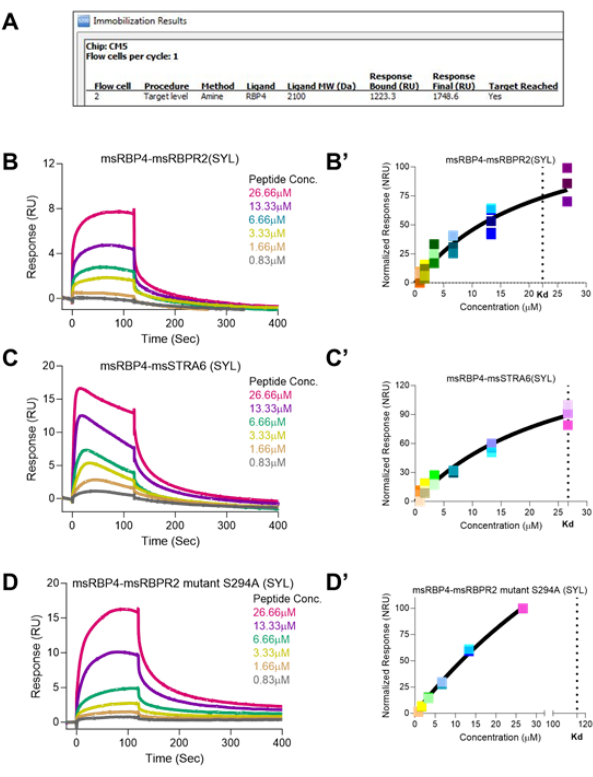
Figure 3: Surface Plasmon Resonance binding studies of individual vitamin A receptor binding domain peptides with its physiological ligand RBP4. (A) The software prompt showing the achieved immobilization of RBP4 on the CM5 Chip surface. (B,C,D) Sensograms of peptide-ligand RBPR2-RBP4, STRA6-RBP4, and mutant S294A RBPR2-RBP4 interactions at various concentrations. (B',C',D') Binding Kinetics and equilibrium Kd determination showing the difference and closeness of binding pattern. Please click here to view a larger version of this figure.
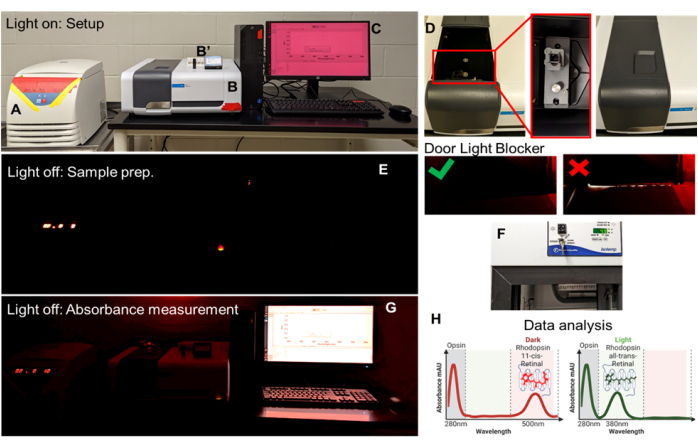
Figure 4: Opsin-11-cis retinal absorbance workspace and overview of the instrumentation. (A) Refrigerated benchtop centrifuge, all LED indicators covered with red tape; (B) UV-visible spectrophotometer, one LED indicator covered with red tape; (B') Rectangular ultra-micro cell, quartz cuvette, and magnetic stand. (C) Scan application software; (D) spectrophotometer compartment cover slide open, cuvette holder for analysis, and compartment cover closed. (E) Light OFF setup with monitor OFF for sample preparation under a single red-light source. (F) Refrigerated rotator for sample preparation and solubilization. (G) Light OFF setup with monitor ON for sample absorbance measurement. (H) Analysis of absorbance in XY-Plot. Please click here to view a larger version of this figure.
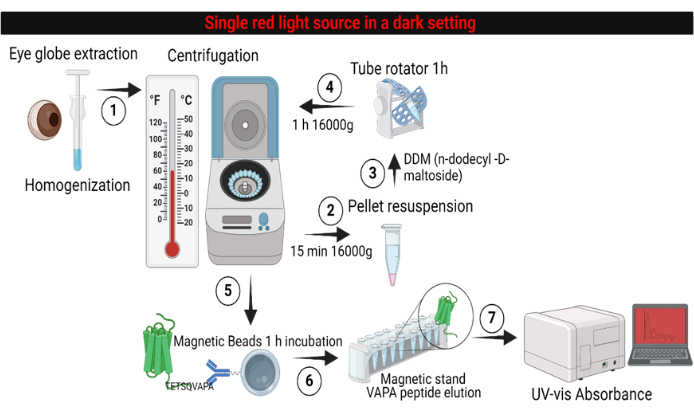
Figure 5: Workflow overview of the Opsin-11-cis retinal absorbance methodology. Step 1: Retinas from dark-adapted mice under a single red-light source are isolated, homogenized, and solubilized to obtain retinal membrane fractions. Steps 2-4: In a sequence of centrifugations, the pellet is solubilized in the absence of detergent and the presence of DDM detergent buffer. Steps 5-6: The solubilized pellet containing retinal photoreceptors and other membrane proteins ready for antibody pulldown and purification. Step 7: The eluted Opsin using VAPA 1D4-peptide ready for absorbance analysis. Please click here to view a larger version of this figure.
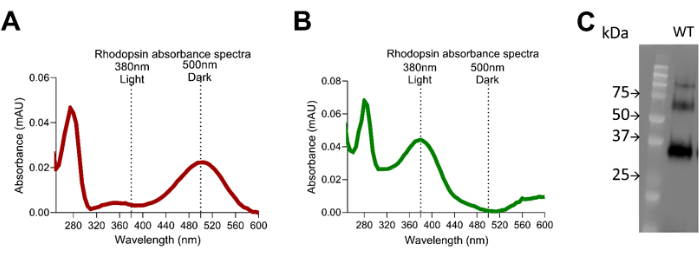
Figure 6: Rhodopsin absorbance spectra. (A) Dark adapted mice retina extract using 1D4 purified rhodopsin showing the 500 nm peak absorbance, and (B) light exposed retina extract using 1D4 purified rhodopsin showing the 380 nm peak absorbance. (C) Western blot using 1D4 rhodopsin antibody showing the quality of the rhodopsin purification and size distribution. Please click here to view a larger version of this figure.
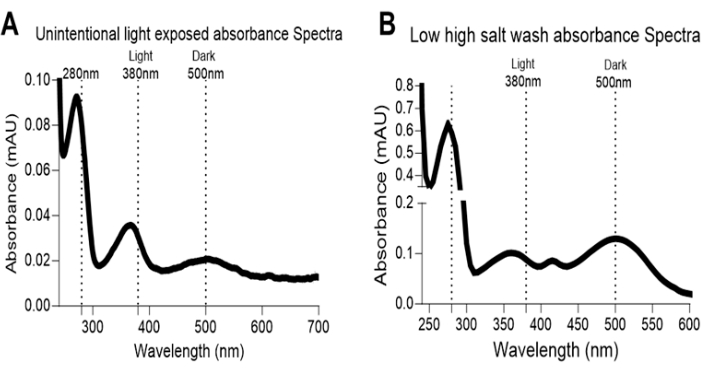
Figure 7: Rhodopsin absorbance spectra artifact. (A) Artifact in absorbance spectra of dark-adapted eye extract is shown with the absorbance peak at 380 nm; the unintentional light exposures from the instruments led indicators or failure of dark room door light blocker causes bleaching of rhodopsin protein. (B) Insufficient washes with high salt buffer cause accumulation of contaminates from RPE, lens, or other sources from eye extract, leading to high absorbance spectrum spread and artifacts. Please click here to view a larger version of this figure.
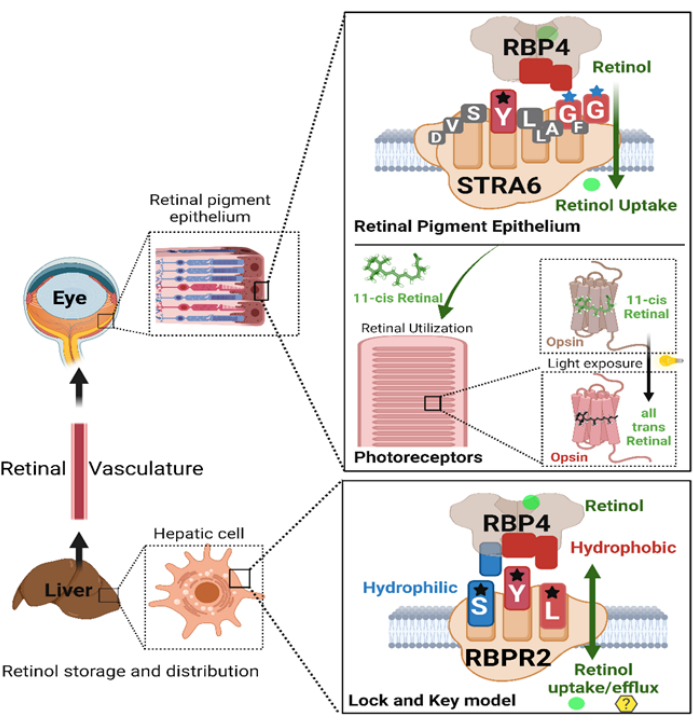
Figure 8: Schematic representation of the interactions between vitamin A membrane receptors (RBPR2 and STRA6) and Opsin protein with their respective ligands (RBP4 and 11-cis retinal) critical for generating the retinylidene protein in photoreceptors for visual function. Please click here to view a larger version of this figure.
Supplemental Figure S1: Intrinsic tryptophan fluorescence intensities. Preliminary evidence of interaction and change in the orientations of intrinsic tryptophan residues of RBP4 upon interacting with various concentrations of RBPR2 and STRA6 peptides. Please click here to download this File.
Supplemental Figure S2: RBPR2 and RBP4 protein-protein docking and interaction. Interface residues are visualized in PyMOL and the orientation of RBPR2 in the membrane is visualized by using the server tool https://opm.phar.umich.edu/. Please click here to download this File.
Supplemental Figure S3: Pipeline for in-silico analysis of the protein-protein docking interaction and possible contact sites. The analysis pipeline demonstrates the sequence of Python script run and PyMOL command line usage from steps 1 to 6, ensuring the reliability of acquiring the sites of interactions. Please click here to download this File.
Supplemental Figure S4: CD spectroscopy secondary structure analysis showing the composition of the RBP4, RBPR2, and STRA6 peptides. The pie graph shows the shares of secondary structures present in the molecule. Using the BeStSel Secondary Structure tool, Protein Fold Prediction by Circular Dichroism Spectroscopy (https://bestsel.elte.hu) was analyzed. Please click here to download this File.
Discussion
Critical steps in the protocol
SPR Methodology
In silico modeling and docking analysis: The predicted structure of RBPR2 (https://alphafold.ebi.ac.uk/entry/Q9DBN1) and STRA6, and the known structure for msRBP4 PDB database (RSCB PDB ID: 2wqa), should be used for docking study29,31. Additionally, in vitro methods (cell culture) should be used to confirm the interaction of the putative binding sites on vitamin A receptors (RBPR2 and STRA6) with its ligand (RBP4)29,31(Supplemental Figure S1, Supplemental Figure S2, and Supplemental Figure S3). Determine the quality of peptides using CD spectroscopy. Previously, for far-UV CD spectrum, 1 mm rectangular cell 0.1 μg/μL ~200 μL (3-4 μg RBP4 protein, 32 µM RBPR2, and 32 µM STRA6 peptides) were used31(Supplemental Figure S4). The nitrogen gas flow should be used to prevent harmful ozone formation under emission Xenon lamps and reduce background absorbance at 200-300 nm. Using the default parameter, the spectrum was measured from 185 nm to 300 nm. The baseline should be corrected by subtraction with the Blank. The alpha helix and beta sheet content are calculated based on the property of absorbance, such as the alpha helix's negative peaks at 222 nm.
Analyze the RBPR2 and STRA6 proteins and topological domains data in the database (https://www.uniprot.org), confirm the previously known possible interaction sites from extracellular regions, and use the sequence ~40-50 amino acids to chemically synthesize the peptides. The study requires purified recombinant mouse RBP4 (msRBP4) protein and chemically synthesized RBPR2 and STRA6 peptides encompassing the proposed RBP4 binding residues for studying receptor-ligand interactions18,19,29,31. Before shortlisting the peptides, the extracellular peptide sequence of the interacting vitamin A receptor proteins must be determined using in silico (computer-based protein-ligand docking) analysis31. SPR assay is performed to understand the kinetics of receptor-ligand interactions. It is crucial to know predicted sites of interactions by in-silico computer-based assays or from in-vitro analysis. In this study, the designed peptide references the extracellular region of membrane proteins RBPR2 and STRA6, which are known to interact with RBP4. To ensure accurate results and prevent potential artifacts and negative SPR sensorgrams, it is crucial to standardize the buffers, peptide concentrations, and solubility. For rhodopsin absorbance studies, retinal lysate isolation requires stringent dark conditions and washing steps to avoid artifacts and unwanted absorbance peaks (Figure 7).
To understand the importance of the SYL motif on vitamin A transporters in binding RBP4, RBPR2, STRA6, and a mutant S294A-RBPR2 peptides31 were chemically synthesized using a condensation reaction of the carboxyl and amino groups between two amino acids. The protocol followed the precise stepwise addition of sequential amino acids to anchoring resin. The process of amino acid synthesis undergoes chemical modifications of protection and deprotection of the N-terminus amino acid unit, allowing the synthesis and peptide polymer formation. Once completed, the peptide is recovered from the resin and purified. The initial validation of RBP4 protein and vitamin A receptor peptides interactions should be confirmed using an internal Tryptophan Fluorescence assay and checked using a CD spectrometer (Supplemental Figure S1). The initial interaction quality of the recombinant RBP4 protein with mouse STRA6 (msSTRA6), mouse RBPR2 (msRBPR2), and control peptides should be confirmed using intrinsic tryptophan fluorescence assay (Supplemental Figure S1). The intrinsic tryptophan fluorescence assay is a critical experimental procedure for assessing the quenching or enhancement of tryptophan amino acid residues in proteins for fluorescence upon binding the receptor and ligand. The measured fluorescence is a direct indication of the change in the local environment as a result of the interaction.
Modifications and troubleshooting of the methods
Optimize the SPR with running buffers: 1x Phosphate-Buffered Saline (Tween 20) or 1x HEPES (P20). To avoid precipitates, the diluted peptides should be centrifuged and filtered prior to use. Standardize the Rhodopsin absorbance with various high-salt buffers (300-500 mM NaCl). To confirm the rhodopsin absorbance peaks in the dark at 500 nm, expose the samples to light for 30 s and repeat the measurement to ensure the quality through absorbance peak shift to 380 nm and efficacy of the pulldown.
Limitations of the methods
SPR can provide specific information on the interaction of two proteins; however, if the interaction requires a third unknown component, the data can become complex to comprehend. The change in the molecule's conformation will remain unidentified in the interaction. Since the RBP4 protein is prepared in the absence of retinol (apo-RBP4), what is measured is the binding of apo-RBP4 to its receptors. Therefore, retinol-loaded RBP4 (holo-RBP4) can have an altered affinity for the RBPR2 and STRA6 receptors compared to the apo-RBP435,36. Interestingly, the affinities for apo- and holo-RBP4 for STRA6 were previously shown in both the micromolar range, and no statistical difference was observed between the bindings of apo- and holo-RBP4 to the STRA6 receptor35. Rhodopsin absorbance methodology can identify the presence of un-liganded opsin (apoprotein opsin) in the eye but cannot identify the causative mechanism(s).
Rhodopsin absorbance spectra
CRITICAL CHECKPOINT: The photo-isomerization of 11-cis retinal to all-trans retinal is highly sensitive and instantaneous32. Quantification of Rhodopsin (holo-Opsin) should be conducted under strict dark conditions to measure proper Opsin and 11-cis retinal content in dark (500 nm) or under light-adapted conditions as Meta II Rhodopsin (380 nm)32. Mice should be therefore dark adapted in a dark room for 12-16 h to measure unbleached rhodopsin32. For this purpose, the dark room should be completely dark, with the entry door covered in blackout cloth and external LED light sources on all equipment covered with red tape. Cover the laptop screen with a red plastic sheet and keep closed until required. An overhead red-light source is also required.
CRITICAL STEP: Standardize the washing steps at various high concentrations of salts to remove lens or RPE proteins or molecule contaminants that have 300-500 nm wavelength absorbance and could potentially interfere with opsin absorbance measurement.
Significance of the methods with respect to existing/alternative methods
There is no feasible approach to study systemic retinoid utilization, multi-tissue contributions, and impact of mutations in retinol-binding protein receptors for the retinol distribution mechanisms. This protocol utilizes two essential techniques to understand and fill the missing connections in retinol depletion in photoreceptors with Apo-Opsin and liver retinoid storage utilization via RBPR2-RBP4 receptor-ligand interactions (Figure 3, Figure 6, and Figure 8).
Importance and potential applications of the method in specific researchareas
SPR and absorbance-based rhodopsin spectroscopy assays provide a meaningful strategy to study systemic and ocular vitamin A homeostasis mechanisms for the generation of the retinylidene protein (rhodopsin). In summary, these techniques and experimental approaches can elucidate the kinetics of membrane receptor-dependent transport of dietary retinoids through the liver and into the eye, facilitating the generation of rhodopsin (Figure 8). They also aid in understanding the mechanisms and ocular consequences of mutations in vitamin A receptors and opsin proteins, particularly in binding to their respective ligands. These interactions may influence the generation of the retinylidene protein, which is crucial for visual function.
Divulgations
The authors have nothing to disclose.
Acknowledgements
The authors thank Dr. Beata Jastrzebska, Ph.D. (Department of Pharmacology, Case Western Reserve University, OH) for her advice on the rhodopsin absorbance protocol. This work was supported by an NIH-NEI grant (EY030889 and 3R01EY030889-03S1) and, in part, by the University of Minnesota start-up funds to G.P.L.
Materials
| 2-D Quant Kit | Cytiva | 80648356 | |
| Amine Coupling Kit | Cytiva | BR100050 | |
| Biacore evaluation software | Biacore S200 | Version 1.1 | |
| Biacore Sensor chip CM5 | Cytiva | BR100530 | |
| Bis tris propane | Sigma | B6755-25G | 20 mM |
| BL21 DE3 competent cells | Thermo Scientific | EC0114 | |
| CD spectrophotometer | Jasco | J-815 Spectropolarimeter | |
| Glycine HCL | Fisher Bioreagents | BP381-1 | |
| GraphPad Prism | Model fitting, data analysis | ||
| LB broth | Fisher Bioreagents | BP1426-500 | |
| n-dodecyl-β-d-maltoside (DDM) | EMD Millipore | 324355-1GM | 2-20 mM |
| pET28a His-tag Kanamycin-resistant expression vector | Addgene | 69864-3 | |
| Plasmid purification kit | Qiagen | 27106 | |
| Rho1D4 MagBeads | CubeBiotech | 33299 | |
| Slide-A_Lyzer 10K dialysis cassette | Thermo Scientific | 66810 | |
| Tween20 | Fisher Bioreagents | BP337-500 | 0.05% |
| UV vis Spectrophotometer | Agilent | Cary 60 UV-Vis | |
| Peptide name | Peptide sequence | HPLC-purity | Mass Spec |
| Mouse Rbpr2 (42) | HVRDKLDMFEDKLESYLTHM NETGTLTPIILQVKELISVTKG |
92.14% | Conforms |
| Mouse Stra6 (40) | SVVPTVQKVRAGINTDVSYL LAGFGIVLSEDRQEVVELVK |
90.84% | Conforms |
| Mouse Rbpr2 mutant S294A (42) | HVRDKLDMFEDKLEAYLTHM NETGTLTPIILQVKELISVTKG |
0.92% | Conforms |
References
- Dowling, J. E., Wald, G. Vitamin A deficiency and night blindness. Proc Natl Acad Sci U S A. 44 (7), 648-6618 (1958).
- Dowling, J. E., Wald, G. The biological function of vitamin A acid. Proc Natl Acad Sci U S A. 46 (5), 587-608 (1960).
- Kiser, P. D., Palczewski, K. Retinoids and retinal diseases. Annu Rev Vis Sci. 2 (1), 197-234 (2016).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: the long and the short of it. Nutrients. 14 (7), 1411 (2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- O’Byrne, S. M., Blaner, W. S. Retinol and retinyl esters: biochemistry and physiology. J Lipid Res. 54 (7), 1731-1743 (2013).
- Blomhoff, R. Transport and metabolism of vitamin A. Nutr Rev. 52 (2 Pt 2), S13-S23 (2009).
- Chelstowska, S., Widjaja-Adhi, M. A. K., Silvaroli, J. A., Golczak, M. Molecular basis for vitamin A uptake and Storage in Vertebrates. Nutrients. 8 (11), 676 (2016).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987 (2021).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Chen, C. C., Heller, J. Uptake of retinol and retinoic acid from serum retinol-binding protein by retinal pigment epithelial cells. J Biol Chem. 252 (15), 5216-5221 (1977).
- Gjøen, T., et al. Liver takes up retinol-binding protein from plasma. J Biol Chem. 262 (23), 10926-10930 (1987).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kanai, M., Raz, A., Goodman, D. S. Retinol-binding protein: The transport protein for vitamin A in human plasma. J Clin Invest. 47 (9), 2025-2044 (1968).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J Lipid Res. 45 (11), 1975-1982 (2004).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Kawaguchi, R., et al. Membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kawaguchi, R., Zhong, M., Kassai, M., Ter-Stepanian, M., Sun, H. STRA6-catalyzed vitamin A influx, Efflux, and Exchange. J. Membr. Biol. 245 (11), 731-745 (2012).
- Pasutto, F., et al. Mutations in STRA6 cause a broad spectrum of malformations including anophthalmia, congenital heart defects, diaphragmatic hernia, alveolar capillary dysplasia, lung hypoplasia, and mental retardation. Am J Hum Genet. 80 (3), 550-560 (2007).
- Golzi, C., et al. Matthew-Wood Syndrome is caused by truncating mutations in the retinol-binding protein receptor gene STRA6. Am J Hum Genet. 80 (14), 1179-1187 (2007).
- Isken, A., et al. RBP4 disrupts vitamin A uptake homeostasis in a STRA6-deficient animal model for Matthew-Wood Syndrome. Cell Metab. 7 (3), 258-268 (2008).
- Ruiz, A., et al. Retinoid content, visual responses, and ocular morphology are compromised in the retinas of mice lacking the retinol-binding protein receptor, STRA6. Investig Opthalmol Vis Sci. 53 (6), 3027-3039 (2012).
- Kelly, M., von Lintig, J. STRA6: Role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229 (2015).
- Berry, D. C., et al. The STRA6 receptor is essential for retinol-binding protein-induced insulin resistance but not for maintaining vitamin A homeostasis in tissues other than the eye. J Biol Chem. 288 (34), 24528-24539 (2013).
- Amengual, J., et al. STRA6 is critical for cellular vitamin A uptake and homeostasis. Hum Mol Genet. 23 (20), 5402-5417 (2014).
- Steinhoff, J. S., Lass, A., Schupp, M. Retinoid homeostasis and beyond: How retinol binding protein 4 contributes to health and disease. Nutrients. 14 (6), 1236 (2022).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Radhakrishnan, R., et al. Mice lacking the systemic vitamin A receptor RBPR2 show decreased ocular retinoids and loss of visual function. Nutrients. 14 (12), 2371 (2022).
- Solanki, A. K., et al. A functional binding domain in the Rbpr2 receptor is required for vitamin A transport, ocular retinoid homeostasis, and photoreceptor cell survival in zebrafish. Cells. 9 (5), 1099 (2020).
- Radhakrishnan, R., Leung, M., Solanki, A. K., Lobo, G. P. Mapping of the extracellular RBP4 ligand binding domain on the RBPR2 receptor for vitamin A transport. Front Cell Dev Biol. 11 (11), 1105657 (2023).
- Ramkumar, S., et al. The vitamin A transporter STRA6 adjusts the stoichiometry of chromophore and opsins in visual pigment synthesis and recycling. Hum Mol Genet. 31 (4), 548-560 (2022).
- Tian, H., Sakmar, T. P., Huber, T. The energetics of chromophore binding in the visual photoreceptor rhodopsin. Biophys J. 113 (1), 60-72 (2017).
- Fan, J., Rohrer, B., Frederick, J. M., Baehr, W., Crouch, R. K. Rpe65-/- and Lrat-/- mice: comparable models of leber congenital amaurosis. Invest Ophthalmol Vis Sci. 49 (6), 2384-2389 (2008).
- Breen, C. J., et al. Production of functional human vitamin A transporter/RBP receptor (STRA6) for structure determination. PLoS One. 10 (3), e0122293 (2015).
- Kawaguchi, R., Zhong, M., Sun, H. Real-time analyses of retinol transport by the membrane receptor of plasma retinol binding protein. J Vis Exp. 28 (71), e50169 (2013).
- Shi, Y., Obert, E., Rahman, B., Rohrer, B., Lobo, G. P. The retinol binding protein receptor 2 (Rbpr2) is required for photoreceptor outer segment morphogenesis and visual function in zebrafish. Sci Rep. 7 (1), 16207 (2017).

.
