12.8:
증기 압력 내림
12.8:
증기 압력 내림
액체의 평형 증기 압력은 기화및 응축이 동일한 속도로 발생할 때 기체 상에 의해 가해지는 압력입니다.
휘발성 액체에 비휘발성 물질을 용해하면 액체의 증기 압력이 저하됩니다. 이 현상은 액체의 기화 및 응축 과정에 추가된 solute 분자의 효력을 고려하여 설명될 수 있습니다. 기화하려면 용매 분자가 용액 표면에 있어야 합니다. 솔루트의 존재는 용매 분자에 사용할 수있는 표면적을 감소시켜 용매 기화의 속도를 감소시킨다. 응축 속도는 솔트의 존재에 의해 영향을 받지 않으므로, 순 결과는 기화 응축 평형이 증기 상상에서 더 적은 용매 분자로 달성된다는 것입니다(즉, 낮은 증기 압력에서).
이 해석은 유용하지만 증기 압력 강하의 정렬 특성의 몇 가지 중요한 측면을 고려하지 않습니다. 더 엄격한 설명엔트로피의속성을 포함한다. 액체의 증기 압의 하강을 이해하기 위해, 별도의 용매 및 솔루트 단계에 비해 용액에서 물질의 분산 특성이 용매 분자를 효과적으로 안정화하고 기화를 방해하는 역할을 한다는 점에 유의하기에 적합합니다. 낮은 증기 압력 결과, 그에 상응하는 더 높은 비등점.
솔루션 구성 요소의 증기 압력과 이러한 구성 요소의 농도 사이의 관계는 Raoult의 법칙에 의해 설명됩니다: 이상적인 용액의 모든 구성 요소에 의해 가해지는 부분 압력은 용액에서 두더지 분획을 곱한 순수 성분의 증기 압력과 같습니다.
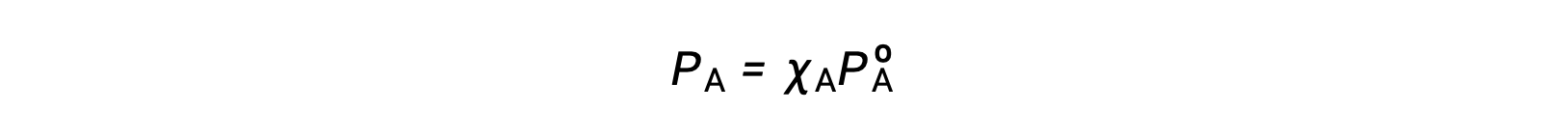
여기서 PA는 용액에서 성분 A에 의해 가해지는 부분 압력인 경우, PºA는 순수 A의 증기 압력이고XA는 용액에서 A의 두더지 분획이다.
기체 혼합물의 총 압력이 모든 구성 요소(Dalton의 부분 압력 법칙)에 대한 부분 압력의 합과 동일하다는 것을 상기, i 성분을 포함하는 용액에 의해 가해지는 총 증기 압력은
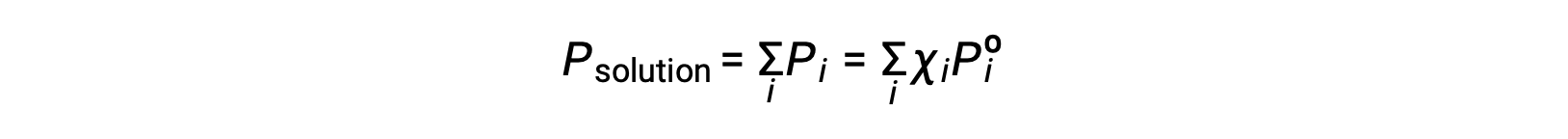
비휘발성 물질은 증기 압력이 무시할 수 있는물질(Pº ≈ 0)이므로 비휘발성 솔루트만 함유하는 용액 위의 증기 압력은 용매에 만 기인합니다.
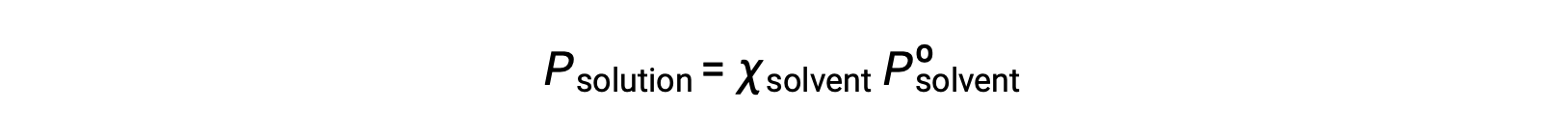
Suggested Reading
- Andrews, Frank C. "Colligative properties of simple solutions." Science 194, no. 4265 (1976): 567-571.
- Lindsay Jr, W. T., and Chu Tisin Liu. “Vapor pressure lowering of aqueous solutions at elevated temperatures.” Westinghouse Research Laboratories, Pittsburgh, Pennsylvania, 1968.
- Chinard, Francis P. "Colligative properties." Journal of Chemical Education 32, no. 7 (1955): 377.
