12.8:
Diminuição da Pressão de Vapor
21,800 Views
•
•
A pressão de vapor de equilíbrio de um líquido é a pressão exercida pela sua fase gasosa quando vaporização e condensação ocorrem a taxas iguais:
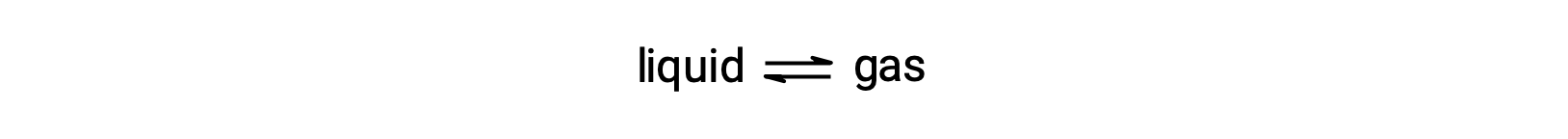
A dissolução de uma substância não volátil em líquido volátil resulta em uma redução da pressão de vapor do líquido. Este fenómeno pode ser explicado considerando o efeito de moléculas de soluto adicionadas nos processos de vaporização e condensação do líquido. Para vaporizarem, as moléculas de solvente devem estar presentes à superfície da solução. A presença de soluto diminui a área de superfície disponível para as moléculas de solvente, reduzindo assim a taxa de vaporização do solvente. Uma vez que a taxa de condensação não é afectada pela presença de soluto, o resultado líquido é que o equilíbrio entre vaporização e condensação é alcançado com menos moléculas de solvente na fase de vapor (ou seja, a uma pressão de vapor mais baixa).
Embora esta interpretação seja útil, não considera vários aspectos importantes da natureza coligativa da diminuição da pressão de vapor. Uma explicação mais rigorosa envolve a propriedade da entropia. Para fins de compreensão da diminuição da pressão de vapor de um líquido, é adequado notar que a natureza mais dispersa da matéria em uma solução, comparada com as fases separadas de solventes e solutos, serve para estabilizar efetivamente as moléculas de solvente e impedir a sua vaporização. Uma pressão de vapor mais baixa resulta daí, e um ponto de ebulição correspondente mais elevado.
A relação entre as pressões de vapor dos componentes da solução e as concentrações desses componentes é descrita pela lei de Raoult: A pressão parcial exercida por qualquer componente de uma solução ideal é igual à pressão de vapor do componente puro multiplicada pela sua fração molar na solução.
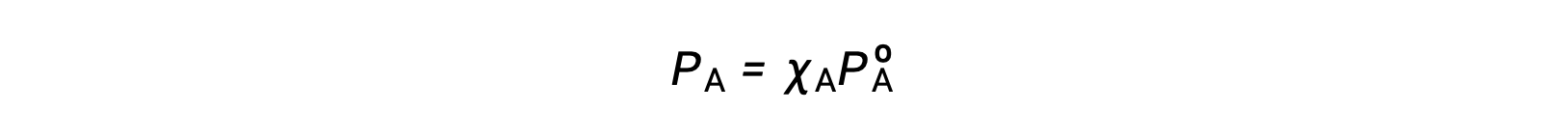
onde PA é a pressão parcial exercida pelo componente A na solução, PºA é a pressão de vapor do A puro, e XA é a fração molar de A na solução.
Recordando que a pressão total de uma mistura gasosa é igual à soma das pressões parciais para todos os seus componentes (lei de pressões parciais de Dalton), a pressão total de vapor exercida por uma solução contendo i componentes é
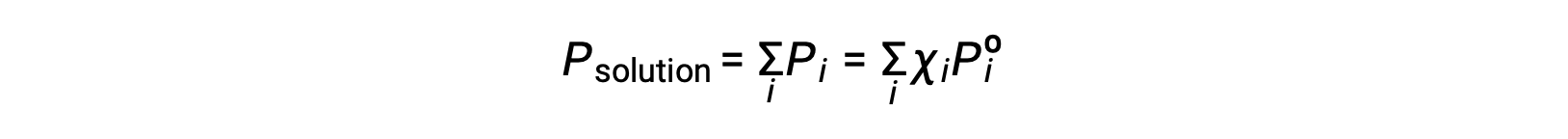
Uma substância não volátil é uma cuja pressão de vapor é negligenciável (Pº ≈ 0), pelo que a pressão de vapor acima de uma solução que contém apenas solutos não voláteis deve-se apenas ao solvente:
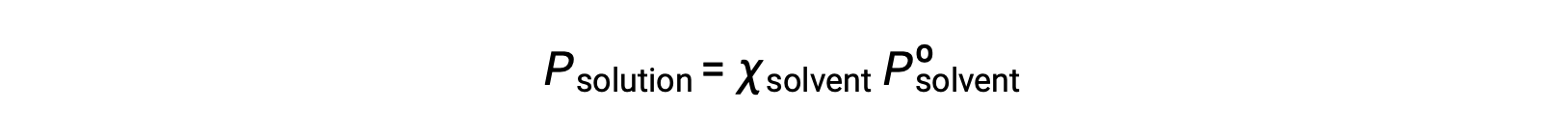
Este texto é adaptado de Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
