12.8:
Reducción de la Presión de Vapor
21,800 Views
•
•
La presión de vapor de equilibrio de un líquido es la presión ejercida por su fase gaseosa cuando la vaporización y la condensación se producen a velocidades iguales:
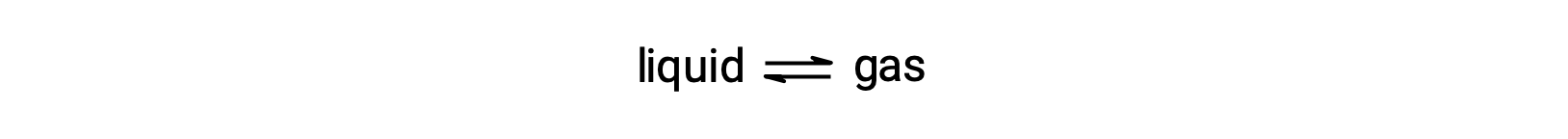
La disolución de una sustancia no volátil en un líquido volátil provoca una disminución de la presión de vapor del líquido. Este fenómeno puede explicarse considerando el efecto de las moléculas de soluto agregadas en los procesos de vaporización y condensación del líquido. Para vaporizar, las moléculas de disolvente deben estar presentes en la superficie de la solución. La presencia de soluto disminuye la superficie disponible para las moléculas de disolvente y, por lo tanto, reduce la velocidad de vaporización del disolvente. Dado que la tasa de condensación no se ve afectada por la presencia de soluto, el resultado neto es que el equilibrio de vaporización-condensación se logra con menos moléculas de disolvente en la fase de vapor (es decir, a una presión de vapor más baja).
Aunque esta interpretación es útil, no tiene en cuenta varios aspectos importantes de la naturaleza coligativa de la reducción de la presión de vapor. Una explicación más rigurosa implica la propiedad de entropía. Para entender la disminución de la presión de vapor de un líquido, es adecuado observar que la naturaleza más dispersa de la materia en una solución, comparada con las fases separadas de disolvente y soluto, sirve para estabilizar eficazmente las moléculas de disolvente e impedir su vaporización. Se obtiene una presión de vapor más baja y un punto de ebullición correspondiente más alto.
La relación entre las presiones de vapor de los componentes de la solución y las concentraciones de dichos componentes se describe en la ley de Raoult: La presión parcial ejercida por cualquier componente de una solución ideal es igual a la presión de vapor del componente puro multiplicada por su fracción molar en la solución.
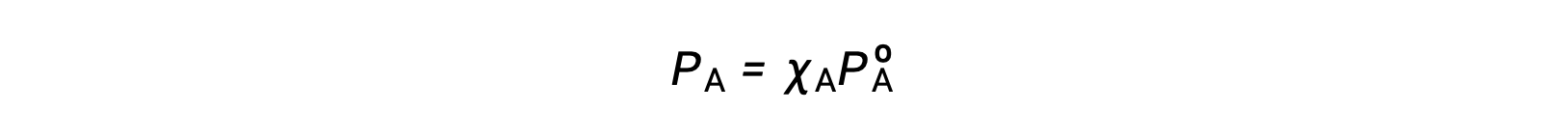
Donde PA es la presión parcial ejercida por el componente A en la solución, PºA es la presión de vapor de A puro, y XA es la fracción molar de A en la solución.
Recordando que la presión total de una mezcla gaseosa es igual a la suma de las presiones parciales de todos sus componentes (ley de las presiones parciales de Dalton), la presión total de vapor ejercida por una solución que contiene componentes i es
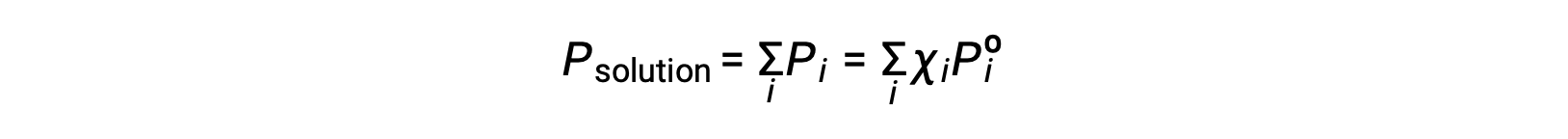
Una sustancia no volátil es aquella cuya presión de vapor es insignificante (Pº ≈ 0), por lo que la presión de vapor sobre una solución que sólo contiene solutos no volátiles se debe únicamente al disolvente:
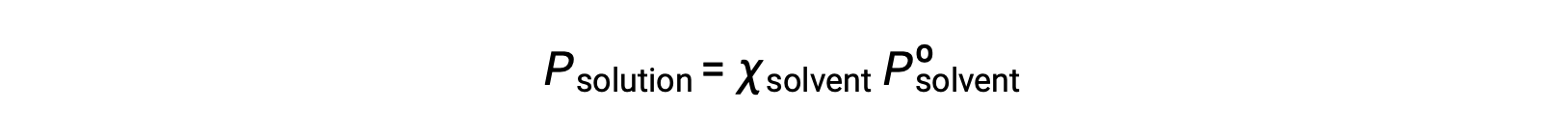
Este texto es adaptado de Openstax, Química 2e, Sección 11.4: Propiedades Coligativas.
