12.8:
تخفيض ضغط البخار
21,775 Views
•
•
ضغط بخار التوازن للسائل هو الضغط الذي تمارسه مرحلته الغازية عندما يحدث التبخر والتكثف بمعدلات متساوية:
ينتج عن إذابة مادة غير متطايرة في سائل متطاير انخفاض ضغط بخار السائل#8217;. يمكن تفسير هذه الظاهرة من خلال النظر في تأثير الجزيئات المذابة المضافة على عمليات تبخير وتكثيف السائل'. للتبخير، يجب أن تكون جزيئات المذيب موجودة على سطح المحلول. يقلل وجود المذاب من مساحة السطح المتاحة لجزيئات المذيبات وبالتالي يقلل من معدل تبخر المذيب. نظرًا لأن معدل التكثيف لا يتأثر بوجود المذاب، فإن النتيجة الصافية هي تحقيق توازن التبخر والتكثيف باستخدام عدد أقل من جزيئات المذيبات في مرحلة البخار (أي عند ضغط بخار أقل).
في حين أن هذا التفسير مفيد ، إلا أنه لا يأخذ في الاعتبار العديد من الجوانب المهمة للطبيعة التجميعية لخفض ضغط البخار. يتضمن التفسير الأكثر صرامة خاصية الانتروبيا. لأغراض فهم خفض ضغط بخار السائل'، من المناسب ملاحظة أن الطبيعة الأكثر تشتتًا للمادة في المحلول، مقارنة بمراحل المذيب والمذاب المنفصلة، تعمل على تثبيت جزيئات المذيب بشكل فعال وإعاقة تبخيرهم. ينتج عن ذلك ضغط بخار أقل ونقطة غليان أعلى.
يوضح قانون رولت’ العلاقة بين ضغط بخار مكونات المحلول وتركيزات هذه المكونات: الضغط الجزئي الذي يمارسه أي مكون من محلول مثالي يساوي ضغط بخار المكون النقي مضروبًا في الكسر الجزيئي في المحلول.
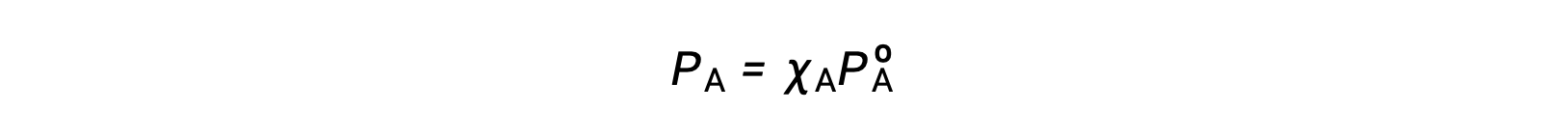
حيث PA هو الضغط الجزئي الذي يمارسه المكون A في المحلول، PºA هو ضغط بخار النقاء A ، و XA هو الجزء الجزيئي من A في المحلول.
بالتذكير بأن الضغط الكلي للمزيج الغازي يساوي مجموع الضغوط الجزئية لجميع مكوناته (قانون دالتون للضغوط الجزئية)، فإن إجمالي ضغط البخار الناتج عن محلول يحتوي على مكونات i هو
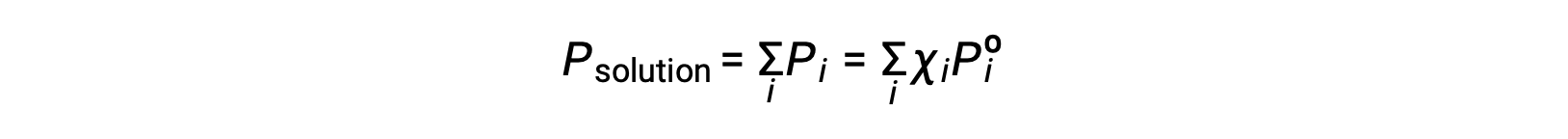
المادة غير المتطايرة هي تلك التي يكون ضغط بخارها مهملاً (Pº ≈ 0)، وبالتالي فإن ضغط البخار فوق المحلول الذي يحتوي على مواد مذابة غير متطايرة فقط يرجع إلى المذيب:
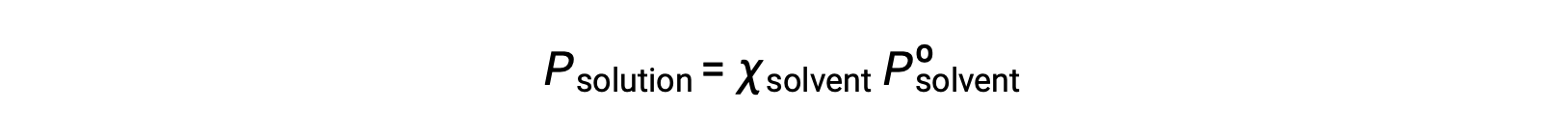
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
