ジンクフィンガーヌクレアーゼを使用して、アポリポタンパク質C-IIIのノックアウトウサギの生産
Summary
ツールを標的遺伝子における最近の開発は、ノックアウトの製造(KO)ウサギができる。本研究では、我々は、ジンクフィンガーヌクレアーゼ(ZFN)を使用して、5アポリポタンパク質(アポ)C-III KOウサギを生成しました。この作品は、ZFNはKOウサギを製造するための非常に効率的な方法であることを実証した。
Abstract
アポリポタンパク質(アポ)C-III(アポCIII)は、血漿カイロミクロン(CM)、超低密度リポタンパク質(VLDL)、高密度リポタンパク質(HDL)の表面上に存在する。これは、心血管疾患(CVD)のためのプラズマアポCIIIのconstitutea危険因子の高いレベルが認められている。上昇した血漿アポCIIIレベルは、多くの場合、インスリン抵抗性、肥満症、および高トリグリセリド血症と相関する。 ApoCIIIin脂質代謝およびCVDの役割に関する貴重な知識は、アポCIIIノックアウト(KO)マウスを含むトランスジェニックマウスモデルから得られたが、これはマウスにおけるリポタンパク質の代謝の多くの局面において、ヒトのものとは異なることに留意されたい。これは、上昇した血漿アポCIIIが直接、アテローム発生であるかどうか、今まで知られていない。私たちは、ウサギは人間の脂質代謝およびアテローム性動脈硬化症を研究reasonablemodelforとしての役割を果たすことができるという仮説に基づいて、本研究でアポCIIIのKOウサギの開発に取り組みました。ジンクフィンガーヌクレアーゼ(ZFN)セットターゲットウサギアプoCIIIgene前胚のマイクロインジェクションするためのin vitroの検証を行った。 mRNAは、35ウサギ前核期胚の細胞質に注入し、胚盤胞状態に突然変異率を評価した。アッセイした16個の胚盤胞から、標的部位で十分な50%の突然変異率(8/16)in vivo実験のために1セットの使用を支持するものであった。次に、我々はセット1 mRNAと145胚をマイクロインジェクションして、7受信者のウサギにこれらの胚を移す。 30日の妊娠の後、21のキットはその5から、生まれたPCR配列アッセイ後のアポCIIIのKOウサギであることが確認された。 KO動物率は(#KOキット/総生まれ)23.8%であった。全体的な生産効率(5 kits/145胚転写)3.4%である。本研究では、ZFNはKOウサギを製造するための非常に効率的な方法であることを実証した。これらのアポCIIIのKOウサギは脂質代謝にアポCIIIの役割を研究するための新たなリソースです。
Introduction
アポリポタンパク質(アポ)C-III(アポCIII)は、肝臓および腸内で主に合成される小型のO-グリコシル化分泌タンパク質である。これは、プラズマカイロミクロン(CM)、超低密度リポタンパク質(VLDL)、高密度リポタンパク質(HDL)の表面上に存在する。アポCIII 1は、心血管疾患の危険因子として認識されている。アポCIIIの遺伝性欠損症の患者は、低い血漿トリグリセリド(TG)濃度の減少不顕性冠動脈アテローム性動脈硬化症、2,3を持っている。上昇した血漿アポCIIIレベルが、他方で、多くの場合、インスリン抵抗性、肥満症、および高トリグリセリド血症(HTG)4,5と相関する。
遺伝子ノックアウト(KO)は、遺伝子の機能を研究するための強力な手段である。ヒト変異集団での観察と一致して、マウスでのアポCIII遺伝子のノックアウトは、血漿TGの減少と食後のHTG 6からの保護につながった。アポCIIIのような積極的な役割が登場アポリポタンパク質E(アポE)に依存しないように、アポEおよびアポCIIIの両方の欠損したマウスとしても食後高脂血症7から保護されています。これらのアポCIII KOマウスモデルは、ヒトにおけるアポCIIIの可能な機能に関する貴重な情報を提供してきたが、これはマウスのリポタンパク質の代謝の多くの局面において、ヒトのものとは異なることに留意されたい。例えば、マウスは、血漿コレステリルエステル転送タンパク質(CETP)、VLDL、LDLの輸送に関与する主要な酵素、およびHDL 8を欠く。したがって、さらにin vivoでアポCIIIの生理学的役割を理解するために適切な動物モデルを開発する必要がある。
ウサギは、古典的なモデル動物種9月11日である。これは、短い妊娠期間(30〜31日)、大型産子数(4-12/litter)を有し、屋内の施設で、便利に収納することができる。マウスと比較して、ウサギは、ヒト10に系統発生的に近い。重要なのは、HU様男はしかし、マウスとは違って、ウサギは、LDLを多く含む哺乳類であり、CETP 10,12の実質的なレベルを持っている。さらに、彼らは人間のアテローム性動脈硬化症13に見られるものと類似の病変を有するコレステロールを多く含む食事誘発性アテローム性動脈硬化症の影響を受けやすい。これらの理由から、我々は、アポCIII KOウサギ、ヒトにおける脂質代謝およびアテローム性動脈硬化症にApoCIIIplayの役割を調査するために、それらのマウス対応物よりも良好なモデルとして役立つことができるという仮説を立てた。
遺伝子の標的遺伝子組換え(GTT)ウサギの生産が課題となっている。これは、胚性幹細胞(ESC)を送信する生殖細胞系の欠如、およびウサギにおける体細胞核移植(SCNT)の非常に低い効率の主な原因である。と体細胞が正常ブタ、ヒツジ、牛ではなく、ウサギなどの生殖細胞系列の送信のESCを欠く種でノックアウト動物を作製するために適用されているのに対し、ESCは、GTTマウスを生成するための主要なツールです。最近、ジンクフィンガーヌクレアーゼ(ZFN)、トランscriptionアクティベーター様エフェクターヌクレアーゼ(TALEN)14、およびRNAのガイド付きエンドヌクレアーゼ(RGEN)15は、ゲノム編集のための強力な手段を浮上した。その「分子ハサミ」と呼ばれるこれらのヌクレアーゼは、標的遺伝子の機能的なKOにつながるか、ゲノム中の特定の遺伝子座のDNA配列を統合するために使用することができ、ゲノム中の二本鎖切断(DSB)を生成する際に効率的である種16の数。 2011年には、ZFN技術を適応させる最初のうち、我々はこのアプローチを経由してペルオキシソーム増殖因子活性化受容体γ(PPARγ)のKOブタの細胞を生成して成功して体細胞17のためにこれらの細胞を使用した後、PPARγのKO豚を生成した。同年、またZFNを使用して効率的な免疫グロブリン遺伝子破壊及びウサギにおける標的交換は18を報告しました。
PCR配列決定によって確認されるように、本 研究では、5つのアポCIII KOウサギをZFNセット1を用いて、生成された( 図1を参照</strong>。フローチャートでの場合)。これらの動物は、脂質代謝にアポCIIIの役割を研究するための新たなリソースです。
Protocol
Representative Results
Discussion
本研究では、5つのアポCIII KOウサギをZFN技術を用いて生成した。以前のGTTウサギの生産の唯一の報告書はまた、ZFN技術18を使用していました。本研究では、ZFNを効果的にウサギの遺伝子を標的にすることが有用であることを確認した。
本研究では、ウサギの前のZFNレポート(30.8%、52分の16)18に匹敵する、それらが報告された遺伝子組換え率(正キット/合計生まれ)is23.8%(5月21日)、ゼブラフィッシュ19、マウス20、21匹のラットおよびブタ17を含む他の動物種において、ZFNを用いた。この速度は、実際には、通常、5〜20%の範囲に多くの従来のトランスジェニックウサギの生産試験のレートよりも高い。例えば、従来のDNAのマイクロインジェクションを介した製品アポCIIIトランスジェニックウサギに努め、鼎ら (5.6%)22生まれの54匹のうち3つの肯定的な創業者を得た。
これまでの知見と一致して、ターゲットのサイトでの変異は、(5 KOのウサギで1から21までの範囲)の塩基数が異なるから欠失または挿入を含む、可変である。創始者動物の特定の配列情報に基づいて、少なくとも4つのことが予想される( すなわち 。Δ1、+1、+1、またはΔ20変異を含有するもの)はアポCIIIの機能喪失を有するであろう。この変異が唯一の原因の7アミノ酸の喪失ではなく、読み枠シフトすることが予測されるなどの動物、R-16Δ21では、機能の損失が表示されない場合があります。最終的に、表現型アッセイは、これらの創始動物が本当にアポCIII機能の喪失を表示するかどうかを決定するために必要である。
本研究で生成された5 KOウサギはいずれも二対立遺伝子の修正が含まれていない。興味深いことに、これはまた、以前のZFNウサギのレポートの場合である。これとは対照的に、ZFNはα1、3 – ガラクトシルをターゲットとした場合は、豚に適用された細胞は、単一の対立遺伝子を標的化頻度は、突然変異の約3分の1は23ノックアウト対立遺伝子、シングルステップの作成 を、7から46までパーセントの範囲であった。 TALENはブタ線維芽細胞に適用したときにこれと一致して、対立遺伝子改変は、合計14個の陽性クローンの約15〜40%に認められた。なお、本研究では二対立遺伝子のKOウサギを生成する失敗がターゲットとヌクレアーゼベースの遺伝子のような能力のための種差( すなわちウサギ対豚)を指示する可能性がある。なお、このプロジェクトで生成KOウサギの数が比較的少ないため、これは単にであることがより可能性が高い。我々は、ZFNは、ZFNベースのGTTウサギ生産の別の潜在的な利点として考慮されるべきであるウサギにbialleic突然変異を発生させることができると信じています。さらなる実験は、ウサギにおけるZFNのような能力を確認するために必要とされる。
結論として、本研究では実証するZアプローチを対象とした、FNベースの遺伝子がノックアウトウサギを生産するのに効果的である。特に、我々は、23.8%の満足ジェニック率は5アポCIIIのKOウサギを生成しました。これらの動物は、対応するマウスモデルよりも、ヒトにおける脂質代謝に対するこのタンパク質の役割についてのより意味のある情報を提供すると考えられている。我々は、ZFNベースの遺伝子ターゲティング、ならびにTALENやRGENなど他のヌクレアーゼベースの技術を予測、nonmurine動物で有意に様々なヒトの病気を研究するための新しい動物モデルの開発を促進します。
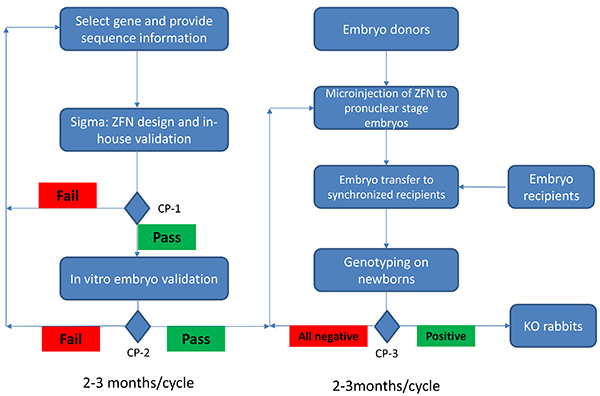
図1。 ZFN技術を用いてノックアウトウサギの産生のチャートを流す 。 ZFN技術を使用してのKOウサギの生産は、目的の遺伝子の選択から始まります。配列情報が提供され、ZFNセットが設計されている首題社内での検証に基づく酵母ected。チェックポイント(CP)1(CP-1)では、社内検証(内部陽性対照の50%以上)を通過したもののみセットが選択のためにユーザに提供される。まだセットはCP-1に合格しない場合は、追加の配列は、効果的なZFNセットを設計するために必要とされ得る。 in vitroでの胚の検証は、選択したZFNセットが選択したサイト(CP-2)に突然変異を誘発することができることを確認するために続いている。それは( インビトロ胚で> = 10%の突然変異率)CP-2に合格した場合、ZFNセット(S)がのみ使用されます。 CP-2での失敗は、ZFNセットの再設計が必要になります。胚ドナーが準備され、前核期胚を検証ZFNセットをマイクロインジェクションされます。これらのマイクロインジェクションした胚は、同期化された胚の受信者に転送されます。 1ヶ月の妊娠期間の後、新生児は(CP-3)遺伝子型を決定します。新生児のいずれも陽性でなかった場合、追加のマイクロインジェクションが行われる。それは、nを仮定し、CP-2に、プロジェクトの開始から2〜3ヶ月かかりますプロセス中のO障害。それは、CP-3へのCP-2からさらに2〜3ヶ月かかります。従って、ZFN技術を使用して4-6ヶ月の時間枠内でノックアウトウサギを生成することができる。 拡大画像を表示するには、ここをクリックしてください 。
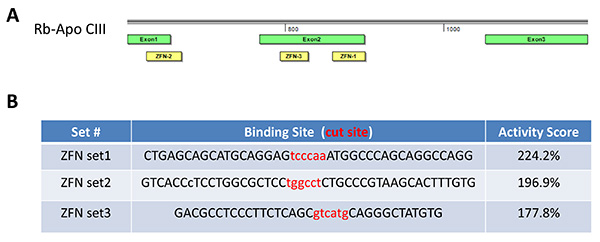
図2。 ZFNデザイン 。三ZFNは(セット1、2、および3)を設定するエキソン1またはウサギアポCIIIのエクソン2(A)上の異なる配列を標的とするように設計した。すべての3つのセットは、ZFN活性を決定するために、酵母MEL-1レポーターアッセイに供した。製造業者のプロトコールに従って、製造業者の内部陽性対照のそれの> 50%の活性を示すのZFNは、 インビトロおよびインビボのゲノム編集のための実験において有用であるとみなされる。ZFN活動は、したがって、1本研究では、選択した設定、セット1のための224.2パーセント、セット2のための196.9パーセントとセット3(B)のための177.8パーセントだった。 拡大画像を表示するには、ここをクリックしてください 。
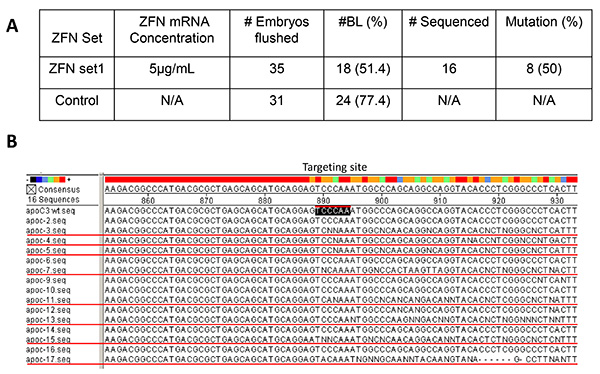
ZFNの図3。胚の体外検証 。セット1のmRNA(5μgの個/ ml)を、35前核期ウサギ胚(A)の細胞質にマイクロインジェクションした。マイクロインジェクション治療た(n = 31)なしでフラッシュした胚を対照群として使用した。 BLの展開率は、対照群で77.4%であった。顕微注入群では、BL率は51.4%だった。 PCR配列を受け16 BLのうち、8(50%)が陽性と確認された、セット1を示すことはタージェで突然変異を誘発するための効果的なZFNセットですティンサイト(B、apoc3wt.seq、ブラックボックス化)ウサギにおけるアポCIIIの。突然変異を含有するが、BLとBL#のAPOC-3、4、5、7、11、13、15、および17である(B、赤下線)。残りのBLは(#のAPOC-2、6、9、10、12、14および16)は、標的部位での変異を持っていません。 拡大画像を表示するには、ここをクリックしてください 。

図4。アポCIIIのKOウサギの生産 。 ZFNセット1のmRNAをマイクロインジェクションは百四〇から五胚は7偽妊娠レシピエントウサギ(A)に移した。 ZFNマイクロインジェクションすることなく新たにフラッシュした胚た(n = 75)(n = 6)は、対照群としてレシピエントに移した。実験群では、全期間キット/総胚として計算期間率は14である.5%(21/145)、速度は対照群では(22/75)29.3%であるのに対し、(A)。顕微注入群で生まれた21のキットのうち、5個(R1、R9、R11、R12およびR16)を、PCR配列決定(B)後に陽性KOキットとして同定された。標的サイトのインデルは2つの挿入(R9とR11の両方のための1)と(それぞれΔ1、Δ20、R1、R12とR16のためのΔ21)3欠失を含む。 拡大画像を表示するには、ここをクリックしてください 。
Disclosures
The authors have nothing to disclose.
Acknowledgements
この作品は、部分的に国立衛生研究所からの補助金によって賄われていた(HL105114、HL088391、NS066652、およびYECにHL068878)、米国心臓協会(JZナショナル·サイエンティスト開発0835237N)。 YECは、財政的にミシガン大学医療センター(UMMC)の循環器内科の恵まれフレデリックHuetwell教授としてサポートされています。この作品はUMMCのトランスレーショナル科学および治療のための高度なモデルのためのセンター(CAMTraST)でサポートされているコアサービスを利用した。
Materials
| APOC3-ZFN | Sigma Aldrich | CSTZFNY-1KT | Target Gene: APOC3, Lot Number: 12201118MN |
| mMESSAGE kit | Invitrogen | AM1344M | mRNA synthesis |
| MEGAclear Kit | Invitrogen | AM1908M | mRNA purification |
| Follicle-stimulating hormone | Bioniche Life Sciences | Folltropin-V | Treating embryo donor rabbits |
| Human chorionic gonadotropin | Intervet | Chorulon | Treating embryo donor rabbits |
| Gonadotropin-releasing hormone | Prospecbio | HOR-255 | Treating embryo recipient rabbits |
| Earle's Balanced Salt Solution (EBSS) | Thermo Fisher Scientific | SH30029.02 | Embryo culture, base medium |
| MEM (nonessential amino acid) | Sigma Aldrich | M7145 | Embryo culture, supplements |
| BME AMINO ACIDS solution | Sigma Aldrich | B6766 | Embryo culture, supplements |
| Glutamine | Gibco | 25030-149 | Embryo culture, supplements |
| Sodium pyruvate | Gibco | 11360-070 | Embryo culture, supplements |
| Fetal bovine serum | Sigma Aldrich | 12003C | Embryo culture, supplements |
| HEPES buffered TCM 199 | Gibco | 12350039 | Embryo manipulation medium |
| Incubator | Eppendorf | Galaxy 170 | Embryo culture equipment |
| Micromanipulator | Eppendorf | TransferMan NK 2 | Embryo manipulation equipment |
| Micropipette puller | Sutter Instruments Inc. | P-1000 | Embryo manipulation equipment |
| Microinjector | Tritech Research | MINJ-D | Embryo manipulation equipment |
| Borosilicate glass capillary tubes | World Precision Instruments, Inc. | TW100F-6 | Embryo manipulation supply |
| Euthasol (pentobarbitol sodium) | Virbac AH, Inc. | ANADA#200-071 | Euthanization of embryo donor rabbits |
References
- Ooi, E. M., Barrett, P. H., Chan, D. C., Watts, G. F. Apolipoprotein C-III: understanding an emerging cardiovascular risk factor. Clinical Science. 114, 611-624 (2008).
- Pollin, T. I., et al. A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection. Science. 322, 1702-1705 (2008).
- Ginsberg, H. N., et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. The Journal of Clinical Investigation. 78, 1287-1295 (1986).
- Cohn, J. S., et al. Increased apoC-III production is a characteristic feature of patients with hypertriglyceridemia. Atherosclerosis. 177, 137-145 (2004).
- Cohn, J. S., Patterson, B. W., Uffelman, K. D., Davignon, J., Steiner, G. Rate of production of plasma and very-low-density lipoprotein (VLDL) apolipoprotein C-III is strongly related to the concentration and level of production of VLDL triglyceride in male subjects with different body weights and levels of insulin sensitivity. The Journal of Clinical Endocrinology and Metabolism. 89, 3949-3955 (2004).
- Maeda, N., et al. Targeted disruption of the apolipoprotein C-III gene in mice results in hypotriglyceridemia and protection from postprandial hypertriglyceridemia. The Journal of Biological Chemistry. 269, 23610-23616 (1994).
- Jong, M. C., et al. Apolipoprotein C-III deficiency accelerates triglyceride hydrolysis by lipoprotein lipase in wild-type and apoE knockout mice. Journal of Lipid Research. 42, 1578-1585 (2001).
- James, J. F., Hewett, T. E., Robbins, J. Cardiac physiology in transgenic mice. Circ. Res. 82, 407-415 (1998).
- Duranthon, V., et al. On the emerging role of rabbit as human disease model and the instrumental role of novel transgenic tools. Transgenic Research. 21, 699-713 (2012).
- Fan, J., Watanabe, T. Transgenic rabbits as therapeutic protein bioreactors and human disease models. Pharmacol. Ther. 99, 261-282 (2003).
- Shiomi, M., Ito, T. The Watanabe heritable hyperlipidemic (WHHL) rabbit, its characteristics and history of development: a tribute to the late Dr. Yoshio Watanabe. Atherosclerosis. 207, 1-7 (2009).
- Morehouse, L. A., et al. Inhibition of CETP activity by torcetrapib reduces susceptibility to diet-induced atherosclerosis in New Zealand White rabbits. Journal of Lipid Research. 48, 1263-1272 (2007).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32, 1104-1115 (2012).
- Carlson, D. F., et al. Efficient TALEN-mediated gene knockout in livestock. Proceedings of the National Academy of Sciences of the United States of America. , (2012).
- Jiang, W., Bikard, D., Cox, D., Zhang, F., Marraffini, L. A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nature Biotechnology. 31, 233-239 (2013).
- Petersen, B. Update on ‘molecular scissors’ for transgenic farm animal production. Reproduction, Fertility, and Development. 25, 317-318 (2012).
- Yang, D., et al. Generation of PPARgamma mono-allelic knockout pigs via zinc-finger nucleases and nuclear transfer cloning. Cell Research. 21, 979-982 (1038).
- Flisikowska, T., et al. Efficient immunoglobulin gene disruption and targeted replacement in rabbit using zinc finger nucleases. PLoS ONE. 6, e21045 (2011).
- Foley, J. E., et al. Targeted mutagenesis in zebrafish using customized zinc-finger nucleases. Nature Protocols. 4, 1855-1867 (2009).
- Carbery, I. D., et al. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186, 451-459 (2010).
- Mashimo, T., et al. Generation of knockout rats with X-linked severe combined immunodeficiency (X-SCID) using zinc-finger nucleases. PLoS ONE. 5, e8870 (2010).
- Ding, Y., et al. Hypertriglyceridemia and delayed clearance of fat load in transgenic rabbits expressing human apolipoprotein CIII. Transgenic Research. 20, 867-875 (2011).
- Hauschild, J., et al. Efficient generation of a biallelic knockout in pigs using zinc-finger nucleases. Proceedings of the National Academy of Sciences of the United States of America. 108, 12013-12017 (2011).

