6.9:
定容量热法
反应内能的变化,ΔE,是热量 q 和功 w 的总和。虽然通过温度变化测量热量 很简单,但通过体积变化测量 压力-体积型的功并不方便。对于气态化学反应,如果体积不 允许改变,那么 ΔV 等于零,因此,w 将为零。因此,反应的内能变化 将完全等于所传递的热量。在定容条件下,反应中传递的热量 是用炸弹量热计测量的。这与咖啡杯量热计不同,咖啡杯量热计 是在恒定压力条件下测量反应的 热量。在炸弹量热计中,将 0.512 克的萘 放入一个不锈钢炸弹中。通过一个入口,点火线圈 被放置在与样品接触的地方。然后将炸弹装满氧气,并浸入一个装满已知质量的水 的绝缘容器中。用电点燃反应物 引发炸弹内部的燃烧反应。释放的热量被量热计组件的水 和各种部件吸收,它们 一起构成了周围的环境。这导致气温上升了 6.42 摄氏度。整个量热计组件吸收的热量 q cal 等于其热容 C cal 乘以温度 变化 ΔT。如果实验测定的 C cal 值为 3.20 千焦每摄氏度,则将其与 ΔT 值一起代入,得出 量热计的热量为 20.5 千焦耳。量热计获得的热量 正好等于反应释放的热量。炸弹是被密封的,反应是 在恒定的体积下发生的,因此所做的功为零。因此,反应的热量等于它的内能 变化,负 20.5 千焦耳。将该值除以 0.512 克 萘中的摩尔数。3.99 乘以10的负 3 次方摩尔 得出每摩尔萘的内能变化,即负的 5140 千焦每摩尔。
6.9:
定容量热法
量热计可用于确定化学反应释放或吸收的热量。咖啡杯量热仪设计为在恒定(大气压)下运行,并且方便地测量伴随在恒定压力下在溶液中发生的过程的热流(或焓变)。以恒定体积运行的另一种量热计(俗称炸弹量热计)用于测量由产生大量热量和气态产物的反应(例如燃烧反应)产生的能量。 (“炸弹”一词来自这样的观察,即这些反应可能足够剧烈,就像爆炸会损坏其他热量计一样。)
热力学第一定律表明,反应的内能变化(Δ E )是热量( q )和功( w )。
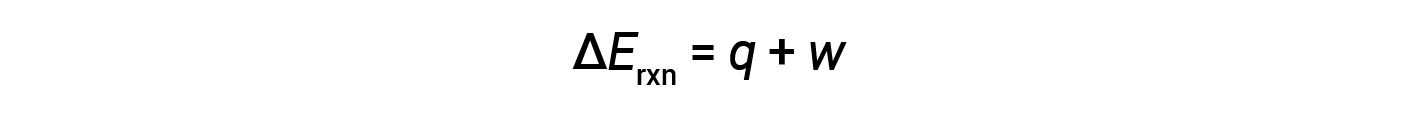
在气态反应中,所完成的工作是压力-体积类型,因此会导致反应体积发生变化。
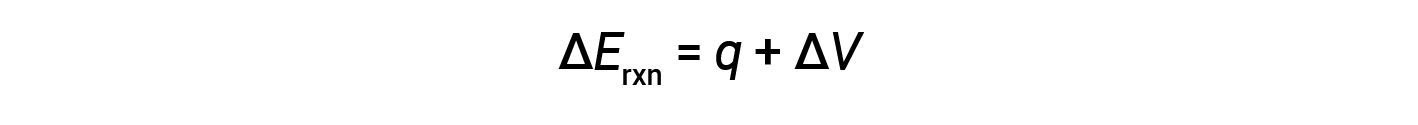
炸弹量热仪设计为在恒定体积下运行,因此不允许改变反应体积(Δ V = 0)。
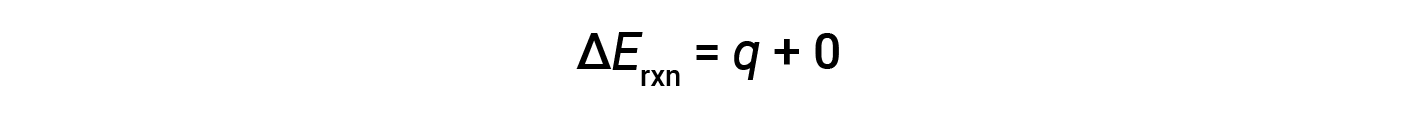
因此,完成的功为零,使用炸弹量热仪测量的热量( q v )等于反应内部能量的变化。
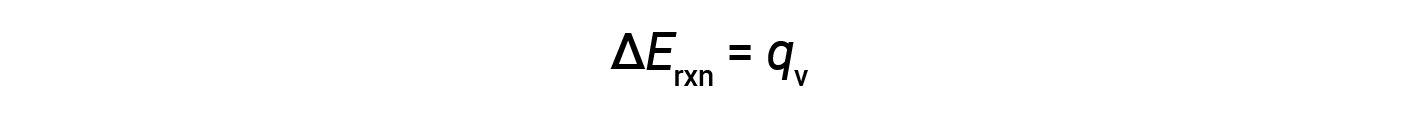
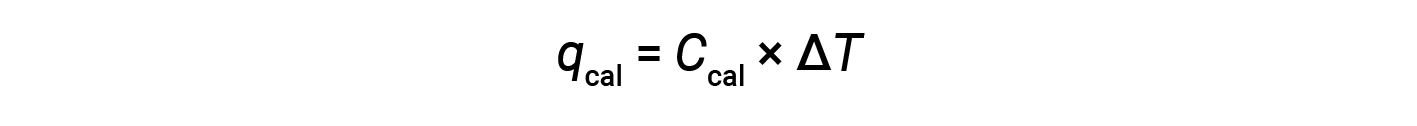
由于量热仪是绝热的,没有热量散失到环境中,因此量热仪获得的热量等于反应释放的热量。
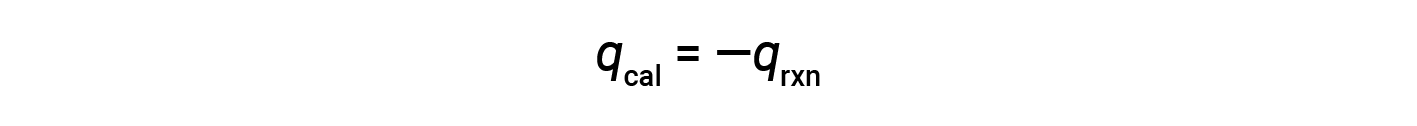
由于体积条件恒定,反应中放出的热量与内部能量的变化相对应。
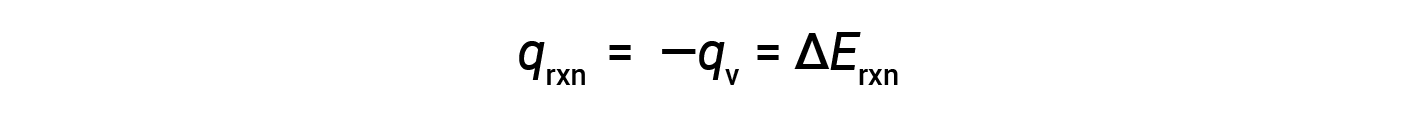
这是经历燃烧的特定量反应物的内部能量变化。通过将值除以实际反应的摩尔数,可以得到每摩尔特定反应物的ΔErxn。
炸弹量热仪需要校准以确定量热仪的热容量并确保准确的结果。校准使用已知q值的反应完成,例如在反应前后称重的镍熔丝产生的火花点燃的苯甲酸的测定量。由已知反应产生的温度变化用于确定量热仪的热容量。通常每次使用量热仪收集研究数据之前都要进行校准。
Suggested Reading
- Hornyak, Frederick M. "A flashbulb bomb calorimeter." Journal of Chemical Education 38, no. 2 (1961): 97.
- Watkins, Geo B. "Total Carbon in Coal Determined by Analysis of Gas from Bomb Calorimeter." Industrial & Engineering Chemistry 19, no. 9 (1927): 1052-1054.
- Olney, David J. "Bomb calorimeter simulation." (1990): 922.
