Information sur la structure à partir d'une seule molécule FRET expériences utilisant la Nano-positionnement Système rapide
Summary
We present the setup and experimental procedure to obtain smFRET data from large donor-acceptor networks with a TIRF microscope. The step-by-step analysis of these measurements with the Bayesian inference software Fast-NPS yields high-resolved structural information via the application of adapted dye models.
Abstract
Single-molecule Förster Resonance Energy Transfer (smFRET) can be used to obtain structural information on biomolecular complexes in real-time. Thereby, multiple smFRET measurements are used to localize an unknown dye position inside a protein complex by means of trilateration. In order to obtain quantitative information, the Nano-Positioning System (NPS) uses probabilistic data analysis to combine structural information from X-ray crystallography with single-molecule fluorescence data to calculate not only the most probable position but the complete three-dimensional probability distribution, termed posterior, which indicates the experimental uncertainty. The concept was generalized for the analysis of smFRET networks containing numerous dye molecules. The latest version of NPS, Fast-NPS, features a new algorithm using Bayesian parameter estimation based on Markov Chain Monte Carlo sampling and parallel tempering that allows for the analysis of large smFRET networks in a comparably short time. Moreover, Fast-NPS allows the calculation of the posterior by choosing one of five different models for each dye, that account for the different spatial and orientational behavior exhibited by the dye molecules due to their local environment.
Here we present a detailed protocol for obtaining smFRET data and applying the Fast-NPS. We provide detailed instructions for the acquisition of the three input parameters of Fast-NPS: the smFRET values, as well as the quantum yield and anisotropy of the dye molecules. Recently, the NPS has been used to elucidate the architecture of an archaeal open promotor complex. This data is used to demonstrate the influence of the five different dye models on the posterior distribution.
Introduction
La détermination de la structure d'une biomolécule est une condition essentielle pour la compréhension de sa fonction. Deux méthodes bien établies pour la détermination de la structure sont cryo-microscopie électronique et cristallographie aux rayons X 1, 2. Aujourd'hui, les deux méthodes fournissent à haute résolution des informations structurelles avec une résolution jusqu'au niveau angström. Ces deux méthodes ont été largement utilisées pour élucider la structure de grandes biomolécules telles que des complexes protéiques. Bien que les méthodes existantes ont été constamment améliorées au cours des dernières décennies, la complexité des structures biologiques pose toujours un défi majeur pour la biologie structurale, en particulier lorsque de grandes, dynamiques et transitoires complexes sont étudiés 3.
Afin d'étudier la dynamique des complexes macromoléculaires et la relation structure-fonction, en particulier, les méthodologies d'une seule molécule ont provided informations utiles 4. Plusieurs nouvelles stratégies ont été élaborées fournissant une approche orthogonale sur l'acquisition de l'information structurelle et dynamique. Les exemples sont AFM à grande vitesse 5, manipulation mécanique 6, fluorescence localisation microscopie 7, ainsi que une seule molécule de transfert Förster Resonance Energy (smFRET) 8, 9. Depuis très tôt FRET a été appelé une règle moléculaire, en raison de la dépendance de la distance sur l'échelle de longueur de biomacromolecules 10.
Une application particulièrement intéressante de smFRET consiste à utiliser l'information de distance obtenue à partir des mesures smFRET pour déduire des informations de structure 11, 12, 13, 14, 15 </sup>, 16, 17, 18, 19, 20, 21, 22, 23. En raison de la haute résolution temporelle de smFRET, la position des parties mobiles d'une structure protéique peut être localisée. Toutefois, afin d' en extraire des informations quantitatives de données smFRET correction des paramètres importants sur les molécules de colorant doivent être déterminés lors de la mesure 24. Avec ces facteurs de correction, l'efficacité de FRET E FRET peut être calculée en utilisant la formule
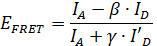 ,
,
où je A et I D </sub> sont les intensités de fluorescence du donneur et la molécule accepteur, respectivement (voir la figure 2). Comptes Le β-facteur de la diaphonie, la fuite d'émission du donneur dans le canal accepteur et est calculée par

où I 'A et je' D sont les intensités de fluorescence du donneur et la molécule accepteur après photo blanchiment de la molécule d'accepteur.
Γ le facteur corrige la différence dans les efficacités de détection relatif dans les deux canaux, ainsi que les différences dans le rendement quantique de fluorescence du donneur et le colorant accepteur. Il est calculé à partir de toute trace de temps individuel par
<p class="jove_content" fo:keep-together.within-page="1" fo:text-align="center" style = "text-align: center;">
Notez que cette description néglige excitation directe de la molécule accepteur, qui devient parfois importante et aurait besoin d'être corrigée pour ainsi. Pour la détermination de ces facteurs de correction , il est utile d'exciter le donneur ainsi que l'accepteur dans un schéma alternatif 25 afin de différencier entre les changements de photo-physique et dynamique des structures.
Afin d'obtenir non seulement l' efficacité de smFRET quantitatives , mais aussi des informations structurelles quantitative, le système Nano-positionnement (NPS) a été introduit en 2008 26. Le nom a été choisi en fonction de ses similitudes avec le système de positionnement global par satellite (GPS). Le NPS est une technique hybride combinant smFRET et les données de cristallographie aux rayons X pour la localisation des positions de colorants inconnus dans les complexes biomacromolecular. Le cStructure rystal sert de cadre de référence et les résultats smFRET sont utilisés pour obtenir des informations de distance entre une position inconnue fluorophore (antenne) et une position connue à partir de la structure cristalline (satellite). Dans des expériences successives les distances entre l'antenne et plusieurs satellites sont mesurés et la position de l'antenne est déterminée au moyen d'une méthode d'analyse statistique rigoureuse basée sur Bayesian estimation des paramètres. Par conséquent, non seulement la position la plus probable de l'antenne est calculé, mais la distribution de l'incertitude 3D complet, la partie postérieure dite, visualisée par des volumes crédibles. En outre, NPS a été élargi pour permettre l'analyse des réseaux complets de smFRET 27.
Le NPS a été utilisé pour résoudre un certain nombre de questions importantes dans la transcription eucaryote, à savoir le cours de l'ADN en amont, l'ADN non-modèle et l'ARNm naissant au sein de l'allongement co RNA Polymerase IImplex 12, 28, ce qui démontre également l'effet de la transcription facteurs d' initiation 26 et l'architecture dynamique d'un open-promotor complexe 29. En outre, le NPS a été utilisé pour élucider la structure de l'Archaea complexe ouvert RNA Polymerase 30 et en particulier la position du facteur initiation de la transcription TFE, qui se lie de manière compétitive à le même site que le facteur de transcription de l' allongement Spt4 / 5 31.
Depuis lors, un certain nombre d'approches structurelles fondées smFRET ont été publiés 15, 18, 21, 23. Lorsque l'on compare les différentes méthodes structurelles fondées smFRET, il devient clair que la précision apparente de la méthode est fortement dépendante du choix particulier de modèles de colorant. Il faut noter quedes molécules de colorant peuvent présenter un comportement spatial et d'orientation différente en fonction de leur environnement local.
À cette fin, Fast-NPS a été introduit 32. Fast NPS utilise un algorithme d'échantillonnage avancé réduisant les temps de calcul de manière drastique. En outre, Fast-NPS permet d'effectuer une analyse structurelle et pour chaque molécule de colorant l'utilisateur peut choisir parmi un ensemble de cinq modèles de colorants différents qui sera décrit suivant. Le modèle le plus conservateur, appelé classique, suppose que le colorant occupe une seule, mais inconnue, la position. Dans cette position, le fluorophore peut tourner librement à l'intérieur d'un cône dont la taille est déterminée à partir de son respectif (dépendant du temps) anisotropie de fluorescence. L'orientation du cône est inconnue, ce qui conduit à des incertitudes importantes lors de la conversion de l'efficacité smFRET mesurées en distances. À cet égard, le modèle est conservatrice, car elle conduira à la plus petite précision par rapport à l'autre mode de colorantls. Seulement pour les très courtes distances devrait les hypothèses retenues par le modèle classique de plomb à une détermination de la position sensiblement incorrecte. Pour les valeurs typiques de smFRET, la position correcte est toujours enfermé dans le volume relativement important crédible.
Cependant, comme une plus grande précision est souhaitable, il est important de développer et de tester des modèles de colorants alternatifs, qui pourraient aider à améliorer la précision. Si le colorant tourne beaucoup plus rapidement que sa durée de vie de fluorescence intrinsèque, le soi-disant modèle iso peut être appliqué. Ici, le facteur d'orientation k 2 (nécessaire pour le calcul du rayon de Förster isotrope caractéristique  ) Est fixé à 2/3. Par conséquent, les volumes calculés sont fiables presque deux ordres de grandeur par rapport à celles du modèle classique 32. Dans le cas où le fluorophore se trouve dans un environnement qui permet non seulement rapide reorientation, mais le mouvement plus rapide sur tout son volume accessible, le modèle meanpos-iso devraient être utilisés. Dans ce modèle, le colorant de manière efficace que occupe une position moyenne, où la moyenne spatiale est représentée par une conversion de 15 minutes polynomiale. Ce modèle est applicable par exemple si le colorant (généralement hydrophobe) est fixé à une région hydrophile, par exemple, l'ADN. Application du modèle meanpos-iso conduit à une réduction supplémentaire de la taille des volumes crédibles par un facteur d'environ deux. Cependant, un colorant lié à une protéine peut se lier de manière réversible à plusieurs taches hydrophobes dans son volume stériquement accessibles (AV). Un fluorophore qui bascule instantanément entre ces régions, mais dans une région subit une rotation libre et le mouvement localisé rapide est mieux décrit par le modèle var-meanpos-iso. Pour une situation similaire dans laquelle le colorant est pas libre de faire pivoter les var-meanpos modèle applique. Plus d ÉTAILS sur ces modèles peuvent être trouvés dans notre récente publication 32.
) Est fixé à 2/3. Par conséquent, les volumes calculés sont fiables presque deux ordres de grandeur par rapport à celles du modèle classique 32. Dans le cas où le fluorophore se trouve dans un environnement qui permet non seulement rapide reorientation, mais le mouvement plus rapide sur tout son volume accessible, le modèle meanpos-iso devraient être utilisés. Dans ce modèle, le colorant de manière efficace que occupe une position moyenne, où la moyenne spatiale est représentée par une conversion de 15 minutes polynomiale. Ce modèle est applicable par exemple si le colorant (généralement hydrophobe) est fixé à une région hydrophile, par exemple, l'ADN. Application du modèle meanpos-iso conduit à une réduction supplémentaire de la taille des volumes crédibles par un facteur d'environ deux. Cependant, un colorant lié à une protéine peut se lier de manière réversible à plusieurs taches hydrophobes dans son volume stériquement accessibles (AV). Un fluorophore qui bascule instantanément entre ces régions, mais dans une région subit une rotation libre et le mouvement localisé rapide est mieux décrit par le modèle var-meanpos-iso. Pour une situation similaire dans laquelle le colorant est pas libre de faire pivoter les var-meanpos modèle applique. Plus d ÉTAILS sur ces modèles peuvent être trouvés dans notre récente publication 32.
Ces modèles offrent un vaste répertoire pour tenir compte spécifiquement pour les différents milieux un colorant pourrait rencontrer et de les appliquer à bon escient optimise la précision de la localisation. Dans rapide NPS chaque molécule de colorant attaché à une position spécifique peut être affecté à un modèle individuel, de telle sorte que FRET-partenaires sont autorisés à avoir des modèles différents. Cela permet la modélisation sans limites et à proximité à la nature. Cependant, il est important que l'on effectue des tests statistiques rigoureux pour assurer que le résultat obtenu par la combinaison du modèle final est toujours en accord avec les données expérimentales. Ces tests sont inclus dans le logiciel rapide NPS.
Pour appliquer Fast NPS aux données expérimentales de la mesure de (seulement) trois paramètres d'entrée est nécessaire. Tout d'abord, le colorant paire isotrope Förster spécifique rayons (/54782/54782eq5.jpg "/>) Doivent être déterminés. Par conséquent, le rendement quantique (QY) du colorant donneur, les spectres d'émission de fluorescence du donneur et le spectre d'absorption de l'accepteur doivent être mesurés. Ces mesures peuvent être réalisées en en masse, en utilisant un spectromètre standard et d' un spectromètre à fluorescence standard. Pour chaque couple, le R 0 est ensuite calculée en utilisant l'PhotochemCAD gratuit et peut être utilisé dans l'analyse SNP. Par ailleurs, les (résolu temps) anisotropies de fluorescence des molécules de colorant doivent être obtenue en utilisant une polarisation (et le temps), un spectromètre de fluorescence sensible. Toutefois, les paramètres d'entrée les plus importants pour fast NPS sont les rendements smFRET mesurés sur une installation de microscopie à fluorescence de molécule unique, comme une interne fluorescence par réflexion microscope totale (TIRFM) .
Ici, nous présentons un protocole étape par étape pour obtenir des données smFRET et l' application rapide NPS (Figure 1).
Protocol
Representative Results
Discussion
Nous présentons la procédure d'installation et expérimentale pour déterminer avec précision l' efficacité de FRET entre les colorants fixés par l' intermédiaire des linkers flexibles à biomacromolecules, à savoir, les acides nucléiques et / ou des protéines.
Afin d'assurer des mesures de smFRET précises (section 3), il est crucial d'exclure l'air de la chambre d'écoulement à tout moment pendant la mesure. De plus, assurez-vous de ne pas surcharger la chambre d'écoulement avec des fluorophores. Les fluorophores doivent être clairement séparés pour assurer une analyse correcte. Comme paires smFRET, qui ne présentent pas de blanchiment du donneur doivent être exclus de l'analyse, assurez-vous que> 80% des molécules dans le champ de vision sont blanchis à la fin du film. Pour tenir compte des hétérogénéités de l'échantillon de la β-facteur et le γ-facteur, en corrigeant la diaphonie et le rapport d'efficacité de détection du canal de donneur et accepteur, respectivement, sont calculées pour chaque paire de FRET individuellement.
<p class= "Jove_content"> Les réglages de l'appareil (temps d'intégration, le gain de multiplicateur d'électrons, de gain pré-amplificateur et taux de lecture décrit dans la section 3.9) doit être réglé sur des valeurs donnant le meilleur compromis entre le rapport signal sur bruit, la plage dynamique et résolution temporelle. Ils doivent être réajustés pour différentes expériences ou si un matériel différent est utilisé. Le nombre de trames doivent être suffisamment élevée pour assurer que la plupart des molécules du donneur agent de blanchiment dans le temps d'observation.Pour les mesures sur le spectromètre de fluorescence (articles 7 à 9) un bon compromis entre l'intensité du signal et la résolution spectrale des données enregistrées doit être trouvée. À cette fin, les fentes dans la voie d'excitation et d'émission du spectromètre à fluorescence doivent être adaptées dépendant de l'instrument utilisé et de la concentration de l'échantillon.
En outre, nous présentons la méthode d'analyse rapide NPS pour obtenir des informations structurales de MACROM transitoire ou dynamiquecomplexes olecular. NPS a été appliqué pour révéler le trajet du non-matrice de brin d'ADN et la position de facteurs d'initiation de transcription dans le complexe ouvert d'ARN polymérase d'archéobactéries. En utilisant le réseau de plus de 60 mesures de distance différentes, nous avons montré que Fast NPS, équipé d'un moteur d'échantillonnage nouvellement mis en œuvre (Eilert, T., Beckers, M., Drechsler, F., & Michaelis, J. en préparation), réduit le temps nécessaire à l'analyse de ce réseau complexe smFRET ≈2 par ordres de grandeur, par rapport à la méthode de NPS 27 global d' origine. La robustesse de l'algorithme est ancré dans un échantillonneur Metropolis-dans-Gibbs combiné avec un système de trempe parallèle. Fast NPS montre la reproductibilité exacte des résultats du réseau et est compatible avec les résultats publiés précédemment 30.
Plusieurs méthodes différentes ont été publiées visant à déduire des informations structurelles à partir des mesures smFRET 11 </sup>, 12, 13, 14, 15, 16, 17, 18. Toutes ces approches fournissent un seul modèle de colorant spécifique. Ainsi, les colorants, qui ne remplissent pas les hypothèses faites par le modèle respectif, ne peuvent pas être utilisés ou conduisent à des informations structurales faux. NPS rapide, au contraire, permet de choisir pour chaque molécule de colorant d'un modèle différent. Cela contribue à expliquer le comportement conformationnel différent des deux, la molécule de colorant elle-même, ainsi que l'agent de liaison utilisé pour sa fixation. Les environs moléculaires locaux de la molécule de colorant, ainsi que ses propriétés physiques détermineront quel modèle est le plus approprié.
Pour le réseau smFRET analyse du complexe d'initiation archéobactéries, une hypothèse isotrope pour toutes les molécules de colorant conduit à une diminution drastique in la taille des volumes crédibles par rapport au modèle classique. En combinaison avec une position dynamique en moyenne pour toutes les molécules de colorant la médiane de toutes tailles de volume crédibles (à 95%) se réduit à moins de 0,5 nm 3. Cependant, ces postérieurs molécules de colorant ne correspondent plus sont avec leurs mesures de smFRET, indiquant que les hypothèses retenues conduisent à des informations structurelles faux. En revanche, les dents postérieures déterminées dans le modèle classique sont compatibles avec les rendements déterminés smFRET.
Comme l'hypothèse de la position isotrope et / ou dynamique en moyenne pour tous les colorants conduisent à des incohérences, Fast-NPS permet prieurs de molécules de colorant dans lequel chaque colorant peut être attribué l'un des cinq modèles. Chaque modèle utilise le même volume accessible. L'algorithme pour le calcul de l'AVS de colorant fait plusieurs hypothèses. Dans un premier temps, la forme spatiale du fluorophore est approximée par une sphère. Ainsi, un diamètre en tenant compte de la wid du fluorophoree, la hauteur et l'épaisseur doivent être utilisés (article 12). En outre, la forme du segment de liaison est approchée par une tige flexible. Les valeurs présentées dans l'article 12 ont été calculés pour le colorant Alexa 647 fixé par l'intermédiaire d'un lieur 12-C. À ce jour, il est impossible de déterminer avec précision, a priori, quel modèle est le plus adapté, étant donné une géométrie expérimentale, et donc tous les modèles doivent être testés. En général, on choisira le modèle qui donne la plus petite taille possible postérieure, tout en étant compatible avec les données. Pour tester si un choix de modèles est compatible avec les données smFRET, on calcule à la fois la partie postérieure et la probabilité. signifie que plus de consistance 90% des échantillons prélevés dans la partie postérieure est dans l'intervalle de confiance à 95% de la probabilité.
Bien qu'il soit vrai que les arrangements géométriques du plus bas de l'anisotropie, plus l'incertitude de distance dans un réseau de smFRET des molécules de colorants doivent également être pris en compte. Ainsi, tandis que representing molécules de colorant avec une faible anisotropie de fluorescence avec un modèle d'iso est un premier choix typique, le test de cohérence fournit un moyen plus direct pour sélectionner le modèle de colorant correct. Le choix optimal des modèles de colorant peut conduire à une augmentation drastique de la précision de la localisation et en même temps conserver la cohérence du réseau avec ses données FRET.
Pour résumer, Fast-NPS permet d'obtenir des informations structurales et dynamiques des grands complexes macromoléculaires. Contrairement aux méthodes structurelles communes telles que la cristallographie aux rayons X ou par microscopie électronique de cryo ce qui permet de surveiller des complexes très souples ou transitoires, ce qui élargit considérablement notre compréhension des mécanismes de processus biologiques complexes.
Declarações
The authors have nothing to disclose.
Acknowledgements
The authors thank B. Gruchmann for the mechanical drawings of the flow chamber. Further, we want to express our gratitude to Max Beckers and Florian Drechsler for insightful comments and discussions regarding NPS and the underlying sampling engine.
Materials
| Flowchamber preparation | |||
| Customized metall sample holder | self-built | n/a | |
| quartz-glass slides, 76 x 26 mm | Technical Glass Products | 26007 | |
| coverslips, 60 x 24 mm | Marienfeld | 101242 | |
| detergent, Hellmanex II | Hellma | 320.001 | |
| ultra-pure water from Synergy UV | Millipore | 2512600 | |
| Zepto plasma cleaner | Diener | n/a | |
| (3-aminopropyl)-triethoxysilane, p.a. | Sigma-Aldrich | A3648 | |
| methoxy PEG-succinimidyl valerate, 5 kDa | Laysan Bio Inc. | MPEG-SVA-5000-1g | |
| biotinylated PEG-succinimidyl valerate, 5 kDa | Laysan Bio Inc. | BIOTIN-PEG-SVA-5000 | |
| Sodium biocarbonate | Sigma-Aldrich | S5761 Sigma | |
| Sodium carbonate | Sigma-Aldrich | S2127 Sigma-Aldrich | |
| sealing film (Nescofilm) | Fisher Scientific | 12981805 | |
| Tygon Flexible Silicone Tubing, 0.8 mm ID, 2.4 mm OD | Saint-Gobain Performance Plastics | 720958 | |
| Fine-Bore Polyethylene Tubing, 0.58 mm ID, 0.96 mm OD (Smiths Medical) | Fisher Scientific | 12665497 | |
| Neutravidin | Life Technologies | A2666 | |
| Name | Company | Catalog Number | Comments |
| Total internal reflection fluorescence microscope | |||
| Nd:YAG Laser, 532 nm | Newport Spectra-Physics | EXLSR-532-100-CDRH | |
| diode-pumped solid-state laser, 491 nm, Calypso | Cobolt | 904010050 | |
| diode laser 643 nm, iBeam smart | Toptica | iBEAM-SMART-640-S | |
| dichroic mirror, 532 RDC | Chroma | F33-540 | |
| dichroic mirror, 476 RDC | Chroma | F33-476z | |
| acousto-optic tunable filter | AA Opto-Electronic | AOTFnC-VIS | |
| plano-convex cylindrical lens, f = 75 mm | Thorlabs | LJ1703L1-A | |
| plano-concave cylindrical, f = -300 mm | Thorlabs | ||
| prism, PS 991 | Thorlabs | PS991 | |
| focussing lens, f = 75 mm | Thorlabs | LA1608-B | |
| syringe pump, PHD 2000 | Harvard Apparatus | 70-2002 | |
| 2 stepper motors, Z812B | Thorlabs | Z812B | |
| piezoelectric actuator, PE4 | Thorlabs | PE4 | |
| IR diode laser | Edmund Optics | CPS808 | part of the autofocus system |
| dichroic mirror, 775 DCXR | Chroma | 775 DCXR | |
| position-sensing detector (PSD), PDP90A | Thorlabs | PDP90A | part of the autofocus system |
| water-immersion objective, Plan Apo 60X WI, NA 1.2 | Nikon | MRD07601 | |
| dichroic mirror, 645 DCXR | Chroma | 645 DCXR | part of the emission pathway |
| emission filter, 3RD550-510 | Omega Optical | 3RD550-510 | green channel in the emission pathway |
| emission filter, 3RD660-760 | Omega Optical | 3RD660-760 | red channel in the emission pathway |
| EMCCD camera, iXon+ DU897EBV | Andor | AND-20-00032 | |
| EMCCD camera, iXon3 DU897D-BV | Andor | AND-20-000141 | |
| Name | Company | Catalog Number | Comments |
| Miscellaneous | |||
| Varian 50 | Cary | UV-VIS spectrometer | |
| Fluorolog2 | SPEX | fluorescence spectrometer | |
| Solis (V4.15) | Andor | control software for the EM-CCD camera | |
| Apt user utility (V1.022) | Thorlabs | control software for the piezo-motors | |
| Norland Optical Adhesive 68 | Thorlabs | adhesive | |
| PC-AFN-0.8 Nile red | Kisker Biotech | avidin-coated fluorescent multispec beads | |
| Matlab | Mathworks | technical computing language for custon written software | |
| Origin (V9.0) | Originlab | scientific graphing and data analysis software | |
| Hellma 105-202-15-40 | Hellma | 105-202-15-40 | absorption cuvette of 1 cm path length |
| Hellma 105-251-15-40 | Hellma | 105-251-15-40 | fluorescence cuvette with 3 mm path length |
Referências
- Cheng, Y. Single-Particle Cryo-EM at Crystallographic Resolution. Cell. 161, 450-457 (2015).
- Garman, E. F. Developments in X-ray Crystallographic Structure Determination of Biological Macromolecules. Science. 343 (6175), 1102-1108 (2014).
- Sali, A. Outcome of the First wwPDB Hybrid/Integrative Methods Task Force Workshop. Structure. 23, 1156-1167 (2015).
- Hopfner, K. P., Michaelis, J. Mechanisms of nucleic acid translocases: lessons from structural biology and single-molecule biophysics. Curr Opin Struct Biol. 17, 87-95 (2007).
- Ando, T., Uchihashi, T., Kodera, N. High-speed AFM and applications to biomolecular systems. Annu Rev Biophys. 42, 393-414 (2013).
- Neuman, K. K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5, 491-505 (2008).
- Yildiz, A. Myosin V walks hand-over-hand: single fluorophore imaging with 1.5-nm localization. Science. 300 (5628), 2061-2065 (2003).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. Advances in Single-Molecule Fluorescence Methods for Molecular Biology. Annu Rev Biochem. 77 (1), 51-76 (2008).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chem Soc Rev. 43 (4), 1156-1171 (2014).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proc Natl Acad Sci U S A. 58 (2), 719-726 (1967).
- Rasnik, I., Myong, S., Cheng, W., Lohman, T. M., Ha, T. DNA-binding Orientation and Domain Conformation of the E. coli Rep Helicase Monomer Bound to a Partial Duplex Junction: Single-molecule Studies of Fluorescently Labeled Enzymes. J Mol Biol. 336 (2), 395-408 (2004).
- Andrecka, J. Single-molecule tracking of mRNA exiting from RNA polymerase II. Proc Natl Acad Sci U S A. 105 (1), 135-140 (2008).
- Schröder, G. F., Grubmüller, H. FRETsg: Biomolecular structure model building from multiple FRET experiments. Comput Phys Commun. 158 (3), 150-157 (2004).
- Margittai, M. Single-molecule fluorescence resonance energy transfer reveals a dynamic equilibrium between closed and open conformations of syntaxin 1. Proc Natl Acad Sci U S A. 100 (26), 15516-15521 (2003).
- Kalinin, S. A toolkit and benchmark study for FRET-restrained high-precision structural modeling. Nat Methods. 9 (12), 1218-1227 (2012).
- Choi, J. N6-methyladenosine in mRNA disrupts tRNA selection and translation-elongation dynamics. Nat Struct Mol Biol. 23 (August 2015), 110-115 (2015).
- Svensson, B. FRET-based trilateration of probes bound within functional ryanodine receptors. Biophys J. 107 (9), 2037-2048 (2014).
- Stephenson, J. D., Kenyon, J. C., Symmons, M. F., Lever, A. M. L. Characterizing 3D RNA structure by single molecule FRET. Methods. (2016), 1-11 (2016).
- Lee, N. K. Accurate FRET measurements within single diffusing biomolecules using alternating-laser excitation. Biophys J. 88 (4), 2939-2953 (2005).
- McCann, J. J., Choi, U. B., Zheng, L., Weninger, K., Bowen, M. E. Optimizing methods to recover absolute FRET efficiency from immobilized single molecules. Biophys J. 99 (3), 961-970 (2010).
- Brunger, A. T., Strop, P., Vrljic, M., Chu, S., Weninger, K. R. Three-dimensional molecular modeling with single molecule FRET. J Struct Biol. 173, 497-505 (2011).
- Schuler, B. Single-molecule FRET of protein structure and dynamics – a primer. J nanoboitechnology. 11, 1-17 (2013).
- Choi, U. B. Single-molecule FRET-derived model of the synaptotagmin 1-SNARE fusion complex. Nat Struct Mol Biol. 17 (3), 318-324 (2010).
- Dale, R. E., Eisinger, J., Blumberg, W. E. The orientational freedom of molecular probes. The orientation factor in intramolecular energy transfer. Biophys J. 26 (2), 161-193 (1979).
- Kapanidis, A. N. Alternating-laser excitation of single molecules. Acc Chem Res. 38 (7), 523-533 (2005).
- Muschielok, A. A nano-positioning system for macromolecular structural analysis. Nat Methods. 5 (11), 965-971 (2008).
- Muschielok, A., Michaelis, J. Application of the nano-positioning system to the analysis of fluorescence resonance energy transfer networks. J Phys Chem B. 115 (41), 11927-11937 (2011).
- Andrecka, J. Nano positioning system reveals the course of upstream and nontemplate DNA within the RNA polymerase ii elongation complex. Nucleic Acids Res. 37 (17), 5803-5809 (2009).
- Treutlein, B. Dynamic Architecture of a Minimal RNA Polymerase II Open Promoter Complex. Mol Cell. 46 (2), 136-146 (2012).
- Nagy, J. Complete architecture of the archaeal RNA polymerase open complex from single-molecule. FRET and NPS. Nat Commun. 6, 6161 (2015).
- Grohmann, D., et al. The Initiation Factor TFE and the Elongation Factor Spt4/5 Compete for the RNAP Clamp during Transcription Initiation and Elongation. Mol Cell. 43 (2), 263-274 (2011).
- Beckers, M., Drechsler, F., Eilert, T., Nagy, J., Michaelis, J. Quantitative structural information from single-molecule FRET. Faraday Discuss. 184, 117-129 (2015).
- Bennink, M. L. Unfolding individual nucleosomes by stretching single chromatin fibers with optical tweezers. Nat Struct Biol. 8 (7), 606-610 (2001).
- Chandradoss, S. D. Surface passivation for single-molecule protein studies. J Vis Exp. (86), e50549 (2014).
- Würth, C., Grabolle, M., Pauli, J., Spieles, M., Resch-Genger, U. Relative and absolute determination of fluorescence quantum yields of transparent samples. Nat Protoc. 8 (8), 1535-1550 (2013).
- Lakowicz, J. R. . Principles of Fluorescence Spectroscopy. , (2006).
- Korkhin, Y. Evolution of complex RNA polymerases: The complete archaeal RNA polymerase structure. PLoS Biol. 7 (5), (2009).

