Overview
ソース: ムニエシルヴァン1,2,3, パーチェットティボー1,2,3, ソフィー・ノヴォールト 4, レイチェル・ゴルブ1,2,3
リンパポイシスのための1ユニット、免疫学科、パスツール研究所、パリ、フランス
2 INSERM U1223, パリ, フランス
3ユニバーシテ パリ ディデロ, ソルボンヌ パリ シテ, セルレ パストゥール, パリ, フランス
4フローサイトメトリープラットから, サイトメトリーとバイオマーカー UtechS, 翻訳科学センター, パスツール研究所, パリ, フランス
病原体に対する防御は、免疫系による監視に依存する。このシステムは複雑で、多くのセルタイプで構成され、それぞれが特定の機能を持ちます。この複雑な組成物は、病原体および傷害の大きな多様性に対する免疫応答を可能にする。適応免疫は、特定の病原体に対する特定の応答を可能にします。このタイプの免疫を担う細胞の大半はリンパ球(B細胞およびT細胞)である。通常、B細胞は細胞外感染(細菌感染など)に反応し、T細胞は細胞内感染(ウイルス感染など)に反応する。リンパ球集団における細胞の異なるタイプは、それらが発現する細胞表面タンパク質の組み合わせおよび/または分泌されたサイトカインのパネルによって特徴付けることができる。
磁気ソートは、1つまたは複数の細胞表面タンパク質の磁気特性および発現を使用して標的細胞集団の濃縮を可能にする(1、2)。この手法は、3 つの手順で構成されます。まず、細胞は、1つまたは複数のモノクローナル特異的抗体と結合された磁気ビーズでインキュベートされる。これらの抗体に結合する表面タンパク質を発現する細胞は、磁気ビーズに付着する。次に、標的細胞集団を磁石で捕捉する。最後に、標的細胞は磁石からeledされます。最後に、2つの選別産物が得られ、1つは標識されていない細胞を含み、もう1つは磁気ビーズと結合した標的細胞を含む。カラムは、磁気ソートの効率を向上させるために使用することができます。列では、非磁性要素は、列を通るセルのパスを長くします。したがって、細胞の流れが遅くなり、磁石による細胞捕捉が容易になります。
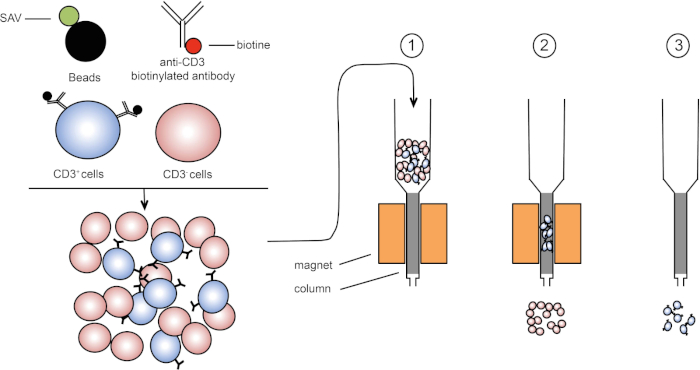
図1:磁気分離の概略図。胸腺白血病は、抗CD3ビオチン化抗体で染色される。洗浄後、ストレプトアビジン(SAV)結合ビーズは、抗CD3抗体上のビオチンを特異的に固定する。(1) セルは列内で転送されます。(2) 磁石は標識されていない細胞を保持せず、CD3陽性細胞はカラムに残ります。最後に、カラムを磁石から分離し、(3)CD3陽性細胞を培地中でelqする。この図のより大きなバージョンを表示するには、ここをクリックしてください。
磁気選別には2種類あります(3)。正の選別では、目的の細胞を磁気ビーズで捕捉します。負の選別では、適切な抗体を運ぶ磁気ビーズで捕捉することにより不要な細胞を除去する。このMACS技術は、標的細胞の良好な濃縮を可能にし、臓器内の1-20%から60-98%に回収された細胞の割合を改善します。ソート後、細胞の純度を確認し、異なる方法(例えばフローサイトメトリー)でソートする必要があります。MACS技術は、細胞培養や細胞周期解析などの他の実験の標的集団を豊かにするのに理想的です。
このラボでは、胸腺白血病を単離し、その後、磁気細胞選別技術を用いて、胸腺CD3陽性細胞をミックスから濃縮する方法を示す。
Procedure
1. 準備
- 始め始めの前に、実験室の手袋と適切な防護服を着用してください。
- すべての解剖ツールを洗剤で洗い、次に70%のエタノールで洗い、清潔なペーパータオルで乾かします。
- 2%の胎児子牛血清(FCS)を含むハンクのバランス塩溶液(HBSS)の200 mLを調調します。
2. 解剖
- スピーヌ位置の解剖プレートに安楽死マウスをピン留めします。
- はさみと鉗子を使用して、胸腔にアクセスするために縦腹腔切り目を行います。
- 心臓の上に位置する胸腺へのアクセスを得るために心臓を削除します。次に、2つの白い葉で構成され、心臓の上の胸腔に位置する胸腺を識別します。
- 鉗子を使用して慎重に胸腺を取り外し、HBSS 2%FCSの5 mLでペトリ皿の上に置きます。
3. 免疫細胞分離
- 同じペトリ皿の上に40 μmセルストレーナーに胸腺を置きます。同じ皿でそれを解離するためにプランジャーで胸腺をつぶします。
- 解離した胸腺と流体を15 mL遠心管に移します。
- 5 mLのHBSS 2%FCSでペトリ皿を洗浄し、洗浄した媒体も同じ遠心管に移します。
- チューブを20°Cで7分間370 x gで遠心し、ペレットを避けて上清を捨てます。
- 赤血球をlyseseにアセテートカリウムの2mLで再濁させる。2 分間待ってから、HBSS 2% FCS を使用して最大 14 mL の音量を構成します。
- 20°Cで7分間370 x gでチューブを再度遠心分離します。上清を廃棄し、HBSS 2%FCSの5 mLでペレットを再懸濁します。
- トリパンブルー染色アッセイを用いて細胞濃度を推定し、HBSS 2%FCSの適切な体積を用いて最終細胞濃度を107細胞/mLに調整する。
4. 免疫細胞の磁気標識
- FACSチューブを2本取ります。1つのチューブに「非濃縮T細胞」、および他のチューブを「濃縮T細胞」と標識し、磁気標識を用いて分離する。
- 2つのFACSチューブのそれぞれに細胞溶液を分配する。
- 20°Cで3分間370 x gで「濃縮T細胞」チューブを遠心分離し、ペレットを避けて上清を廃棄します。
- 抗CD3ビオチン化抗体ミックスの250μLでペレットを再ステースする(表1、ミックス1)。
| ミックス | ラベリング試薬 | 希釈 |
| 1 | 抗CD3ビオチン化抗体 | 1/400 (HBSS 2% FCS内) |
| 2 | ストレプトアビジン結合ビーズ | 1/5 (HBSS 2% FCS内) |
| 3 | アンチCD3 BV421 | 1/200 (HBSS 2% FCS内) |
表1:抗体混合組成物。ミックス1と2は磁気分離に使用されます。ミックス3は、磁気分離後の細胞濃縮を評価するために使用される。
- 細胞懸濁抗体混合物を暗闇の4°Cで15分間インキュベートする。
- 両方のチューブにHBSS 2%FCSの3 mLを追加し、20°Cで3分間370 x gで再度遠心分離します。
- 上清を廃棄し、250 μL連鎖アビジン結合ビーズでペレットを再懸濁します(表1、ミックス2)。
- 細胞混合物とビーズを氷の上で20分間インキュベートします。
- 次に、HBSS 2%FCSの3 mLを追加し、20°Cで3分間370 x gで再びよく混ぜて遠心分離機を混ぜます。
- HBSS 2% FCSの2 mLでペレットを再中断します。
5. CD3陽性細胞の磁気分離
- 磁石の上にカラムを置き、HBSS 2%FCSの3 mLを加えてシステムを加湿させます。5分間待ちます。
- 次に、ラベル付きセルを柱にピペトします。
- セルサスペンションがカラムを通過した後、HBSS 2%FCSの3 mLでカラムX3を洗浄します。
- 次に、磁石からカラムを取り出し、15 mLの回収管に入れます。
- 標的細胞を溶出させるには、HBSS 2%FCSの5 mLをカラムに追加し、カラムをプランジャーで洗い流します。
- HBSS 2% FCSの別の5 mLで溶出ステップを繰り返します。
6. フローサイトメトリーによる標的細胞濃縮の評価
- 「濃縮T細胞」と標識されたFACSチューブに500μLのeluted細胞懸濁液を移す。「非濃縮T細胞」懸濁液の200μLを第2のFACSに移す。
- 次いで、20°Cで7分間370 x gで両方のチューブを遠心分離します。
- 上清を廃棄し、次に100μLの蛍光抗体ミックス3(表1参照)を両管に添加する。
- 暗闇の中で4°Cで20分間両方のチューブをインキュベートします。
- 次に、チューブにHBSS 2%FCSの3 mLを追加し、20°Cで3分間370 x gで遠心分離します。
- 上清を廃棄し、HBSS 2%FCSの250 μLで各チューブを再懸濁します。
- ここで、フローサイトメトリーによるCD3陽性細胞濃縮率を評価する。
7. データ分析
- 「FlowJo」アイコンを開き、「すべてのサンプル」ウィンドウで各チューブのファイルをドラッグします。
- 「エンリッチされたTセル」ファイルをダブルクリックすると、X軸上に前方散布図(FSC-A)を表示するドットプロットとY軸上のサイドスキャッタ(SSC-A)が表示されます。
- リンパ球集団を囲む「ポリゴン」をクリックします。
- 次に、円で囲まれた人口をダブルクリックして新しいウィンドウを作成します。
- Y 軸の"FSC-W"と X 軸の"FSC-A"を選択し、FSA-W 負のセルを丸で囲みます。「亜集団識別」ウィンドウで、セル母集団に「単一細胞」という名前を付けます。
- 円で囲まれた人口をダブルクリックして、新しいウィンドウを作成します。Y 軸で「CD3」を選択し、CD3 陽性セルを丸で囲みます。「サブ人口識別」ウィンドウで、セル母集団に「T セル」という名前を付けます。
- 「非濃縮T細胞」で繰り返します。
- セルの人口を視覚化するには、[レイアウトエディタ]をクリックし、"Tセル"母集団を "エンリッチト T セル" ファイルと "非エンリッチト T セル" ファイルからタブにドラッグします。
- CD3+リンパ球を表すドットプロットが表示されます。CD3+ 細胞は、CD3+ 濃縮チューブの対象の集団にのみ現れる必要があります。
- ソートされた細胞におけるCD3+リンパ球の濃縮を評価するには、「テーブルエディタ」をクリックし、「濃縮T細胞」および「非濃縮T細胞」ファイルから「T細胞」母集団をテーブルにドラッグします。
- 「統計」メニューで、[リンパ球の頻度]細胞を選択して、すべてのリンパ球の CD3+ 細胞の割合を確認し、[テーブルを作成]をクリックします。
- パラメータ値が新しいテーブルに表示されます。「濃縮T細胞」の場合、CD3+細胞の周波数は約80%である必要があります。
磁気活性化細胞選別(MACS)は、研究者が表面に発現する特定のエピトープに基づいて細胞を分離することを可能にする技術です。
プロセスは、通常、胸腺などの器官または組織の抽出から始まる。次いで、細胞は機械的に分離され、通常は破砕によって、組織が単一細胞に解離されるまでである。不要な細胞は、化学物質の添加を介して、この段階で除去することができます。例えば、塩化アンモニウム-カリウム、またはACKバッファーは、不要な赤血球をlyseseに使用することができる。
次に、ビオチンと呼ばれる分子に結合した抗体を懸濁液に加え、これらの複合体が標的細胞の表面のエピトープに結合する。ビオチンは、ストレプトアビジンと呼ばれる別の分子に対して高い親和性を有する。次のステップでは、磁気ビーズに融合したストレプトアビジン分子を抗体標識細胞に添加する。ビオチンとストレプトアビジンが接触すると、それらはしっかりと結合します。その結果、目的の細胞は磁気ビーズでコーティングされます。この複合体は、サンドイッチと呼ばれることもあります。この場合、底部の細胞膜上のCD3は、次いで抗CD3をビオチンに結合し、最後に、ストレプトアビジンを磁気ビーズに結合させた。
これらの標識された細胞は、重力によって助けられ、細胞が磁石によってゆっくりと通過することを可能にするマトリックスを含む列に置くことができるようになりました。そうすると、磁気ビーズ標識細胞は磁石に最も近いチューブの端に付着し、非標識された細胞は下のコレクションチューブに続きます。次に、標識された細胞は、磁石を取り除き、溶出液を加え、プランジャーで穏やかな圧力をかけてカラムから新鮮な回収管に流し込むだけで、カラムから取り除くことができます。最終的に、このプロセスは、対象の細胞の60~98%の検索を可能にします。
この手順では、マウスから胸腺白血球を分離し、MACSを使用してCD3陽性T細胞を選別し、FACSを用いたソートの効率を確認する。
まず、ラボコートや手袋を含む適切な保護具を着用してください。次に、解剖はさみと鉗子を70%のエタノールで洗い、きれいなペーパータオルで乾かします。次に、4ミリリットルのFCSと196ミリリットルのHBSSを混合することにより、200ミリリットルのHBSS 2%胎児子牛血清、またはFCSを調製する。
解剖プレート上のスピネの位置に安楽死マウスをピン留めします。はさみと鉗子を使用して、胸腔にアクセスするために縦腹腔切り目を行う。まず、心臓の上に位置する胸腺へのアクセスを得るために心臓を削除します。次に、2つの白い葉で構成される胸腺を識別します。鉗子を使用して、慎重に胸腺を取り外し、HBSS 2%FCSの5ミリリットルでペトリ皿の上に置きます。
免疫細胞を単離するには、まずペトリ皿の40マイクロメートルの細胞ストレーナーに胸腺を置きます。プランジャーでティッシュをつぶし、皿に解離します。この後、HBSS 2%FCSでプランジャーとストレーナーをすすいで、付着した細胞を回収します。次いで、解離された胸腺細胞および流体をペトリ皿から15ミリリットル遠心管にピペットする。5ミリリットルのHBSS 2%FCSでペトリ皿を洗い、この洗浄液を15ミリリットル遠心管に移します。
次に、20°Cで7分間、370回gでチューブを遠心分離します。上清を廃棄し、赤血球をlysesesASASAの2ミリリットルでペレットを再懸濁する。ベンチトップの室温で2分間インキュベートします。次に、HBSS 2% FCSで14ミリリットルにボリュームを持って来ます。20°Cで7分間、370回gでチューブを遠心分離します。次いで、上清を廃棄し、HBSS 2%FCSの5ミリリットルで細胞を再懸濁する。
Bリンパ球のFACS単離のためのプロトコルに示すようにマラセススライドを使用して細胞濃度を推定し、HBSS 2%FCSで1ミリリットル当たり10~7番目の細胞に細胞濃度を調整します。
500マイクロリットルのセル溶液を2つのFACSチューブに転送します。1つのチューブ非濃縮T細胞と他のチューブ濃縮T細胞に標識し、磁気標識を使用して分離するT細胞を濃縮する。
濃縮されたT細胞チューブを370倍gで遠心分離し、摂氏20度で3分間使用します。上清を廃棄し、250マイクロリットルのビオチン結合抗CD3抗体でペレットを再懸濁し、HBSS 2%FCSで400分の1を希釈した。氷の上と暗闇の中で20分間細胞をインキュベートします。チューブにHBSS 2%FCSの3ミリリットルを追加し、20°Cで3分間370回gで再度遠心分離します。上清を廃棄し、HBSS 2%FCSで5分の1を希釈したストレプトアビジン結合ビーズの250マイクロリットルでペレットを再懸濁する。細胞とビーズの混合物を氷上で20分間インキュベートします。次に、HBSS 2%FCSの3ミリリットルをチューブに加え、上下にピペットを混ぜ合わせ、20°Cで3分間370回gで遠心分離機を再び加えます。HBSS 2% FCSの2ミリリットルでペレットを再中断します。
磁石の上にカラムを置き、HBSS 2%FCSの3ミリリットルを加えてシステムを加湿させます。次いで、染色された細胞を柱にピペットする。セルサスペンションがカラムを通過した後、HBSS 2%FCSの3ミリリットルでカラムを3回洗浄します。次に、磁石からカラムを取り出し、15ミリリットルのチューブに入れます。標的細胞を溶出させるには、HBSS 2%FCSの5ミリリットルをカラムに追加し、カラムをプランジャーで洗い流します。HBSS 2% FCS の別の 5 ミリリットルでこの手順を繰り返します。
標的細胞単離の有効性を評価するために、まず500マイクロリットルのeluted細胞懸濁液をFACSチューブに移し、濃縮T細胞に標識する。次いで、濃縮チューブと非濃縮チューブの両方を370回gで20°Cで7分間遠心分離する。上清を廃棄し、次いで200分の1の蛍光抗体をHBSS2%FCSで200マイクロリットルの両管に添加する。氷の上と暗闇の中で20分間細胞をインキュベートします。次に、HBSS 2%FCSの3ミリリットルをチューブに加え、20°Cで3分間370回gで遠心分離します。上清を廃棄し、250マイクロリットルのHBSS 2%FCSでペレットを再懸濁させる。ここで、FACS プロトコルに示すようにフローサイトメトリーを使用して CD3 陽性細胞濃縮率を評価します。
次に、マウス胸腺から単離したすべての胸腺細胞の中でCD3陽性リンパ球の頻度を決定する。開始するには、FlowJo アイコンをダブルクリックし、すべてのサンプル ウィンドウで各チューブのファイルをドラッグします。次に、濃縮された T セル ファイルをダブルクリックして、そのサンプルから記録されたセルをドット プロットに表示し、X 軸上の前方散布図、FSCA、およびサイド スキャッタ(SSCA)を Y 軸に表示します。
ポリゴンをクリックしてリンパ球集団を円で囲みます。次に、円で囲まれた人口をダブルクリックして新しいウィンドウを作成します。Y 軸で FSC-W を選択し、X 軸で FSC-A を選択し、FSA-W 負のセルを丸で囲みます。サブ母集団識別ウィンドウで、セルの母集団に単一セルという名前を付けます。次に、サブ母集団識別ウィンドウで [OK] をクリックし、円で囲まれた母集団をダブルクリックして新しいウィンドウを作成します。Y 軸で CD3 を選択し、CD3 陽性セルを丸で囲みます。サブ母集団識別ウィンドウで、セル母集団に T セルに名前を付けます。非エンリッチト T セル ファイルを繰り返します。セルの母集団を視覚化するには、[レイアウト エディタ] をクリックし、エンリッチされた T セルファイルと非エンリッチ T セル ファイルから T セルの母集団をタブにドラッグします。
CD3陽性リンパ球を表すドットプロットが現れる。CD3陽性細胞は、CD3陽性濃縮チューブ内の対象の集団にのみ現れるべきである。ソートされた細胞におけるCD3陽性リンパ球の濃縮を評価するには、テーブルエディタをクリックし、濃縮されたT細胞および非濃縮T細胞ファイルからT細胞母集団をテーブルにドラッグします。統計メニューで、[リンパ球細胞の頻度]を選択して、すべてのリンパ球におけるCD3陽性細胞の割合を確認します。次に、[テーブルの作成] をクリックします。パラメータ値が新しいテーブルに表示されます。濃縮されたT細胞の場合、CD3陽性細胞の頻度は約80%以上である必要があります。
Subscription Required. Please recommend JoVE to your librarian.
Results
このプロトコルでは、CD3陽性細胞を磁気細胞選別を用いて胸腺白血病から濃縮した(図1)。磁気細胞濃縮CD3陽性細胞の前に、全胸腺細胞の53.6%を占めた(図2、トップパネル)。磁気細胞濃縮後、CD3陽性細胞の割合は95%に増加した(図2、下パネル)。したがって、MACSは、細胞懸濁液混合物から所望の細胞集団を濃縮するための、シンプルで迅速かつ効率的な細胞濃縮技術である。

図2:ゲーティング戦略と純度検定ソート。細胞はまず形態に基づいてゲートされ(左:FSC-A、SSC-A)、次に細胞はCD3に対してプロットされる(右:CD3、SSC-A)。トップパネルは、細胞濃縮前の胸腺細胞懸濁液を表す。下部パネルは、磁気細胞選別後の胸腺細胞懸濁液を表す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
磁気分離技術は、標的細胞集団を容易かつ迅速にソートする一般的な方法です。T細胞特異的抗体と磁気ビーズを用いて、試料中のT細胞周波数を濃縮した。実験終了時の純度率は、初期細胞懸濁液中の標的細胞の割合に依存する。磁気細胞選別後に得られた細胞は、細胞移動や細胞周期解析などの様々な目的に使用することができる。フローサイトメトリーを用いて、細胞を濃縮する別のソート方法を使用することができる。この技術の収量は、セルのソート後に非常に高い純度率を有するが、それはより多くのステップを必要とし、より多くの時間がかかる。
Subscription Required. Please recommend JoVE to your librarian.
References
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).


