Mikrodesenli Elastomerler Kullanarak Tek Hücreli Kasılmanın Basitleştirilmiş, Yüksek Verimli Analizi
Summary
Bu çalışma, floresan olarak etiketlenmiş elastomerik büzülebilir yüzeyler (FLECS) Teknolojisini, floresan protein mikrodesenlerinin görselleştirilmiş yer değiştirmelerine dayanan tek hücreli kontraktil kuvvetlerin basitleştirilmiş, eller kapalı nicelleştirilmesi için mikrowell formatında kullanmak için esnek bir protokol sunmaktadır.
Abstract
Hücresel kontraktil kuvvet üretimi, hemen hemen tüm hücreler tarafından paylaşılan temel bir özelliktir. Bu kasılma kuvvetleri doğru gelişim için çok önemlidir, hem hücresel hem de doku seviyelerinde işlev görür ve vücuttaki mekanik sistemleri düzenler. Tek hücrelerin hareketliliği, yapışması ve bölünmesinin yanı sıra kalp, mesane, akciğerler, bağırsaklar ve uterus gibi organların kasılması ve gevşemesi de dahil olmak üzere çok sayıda biyolojik süreç kuvvete bağımlıdır. Uygun fizyolojik fonksiyonun korunmasındaki önemi göz önüne alındığında, hücresel kontraktilite, abartıldığında veya bozulduğunda hastalık süreçlerini de tetikleyebilir. Astım, hipertansiyon, erken doğum, fibrotik skarlaşma ve az aktif mesane, hücresel kontraktil kuvvetin uygun kontrolü ile potansiyel olarak hafifletilebilecek mekanik olarak yönlendirilen hastalık süreçlerinin örnekleridir. Burada, floresan olarak etiketlenmiş elastomerik kontraktilible yüzeyler (FLECS) olarak bilinen ve tek hücreli kontraktilitenin basitleştirilmiş ve sezgisel analizini büyük ölçekli bir şekilde sağlayan yeni bir mikroplaka tabanlı kontraktilite testi teknolojisini kullanmak için kapsamlı bir protokol sunuyoruz. Burada, yöntemin kullanıcılarına uygun tekniği göstermek için, sadece tek bir FLECS testi mikroplakası kullanan basit bir prosedürde, iki kontraktil inhibitörün primer insan mesane düz kas hücrelerinin kasılması üzerindeki etkilerini açıklayan iki altı noktalı doz-yanıt eğrisi elde etmek için adım adım bir protokol sunuyoruz. FLECS Teknolojisini kullanarak, temel biyolojik laboratuvarlara ve floresan mikroskopi sistemlerine sahip tüm araştırmacılar, bu temel fakat ölçülmesi zor fonksiyonel hücre fenotipini incelemeye erişebilir ve kuvvet biyolojisi alanına giriş bariyerini etkili bir şekilde azaltır ve kontraktil hücre kuvvetinin fenotipik taramasını yapar.
Introduction
Hücre tarafından üretilen mekanik kuvvetler, bağırsaklar, mesane, kalp ve diğerleri gibi vücuttaki çeşitli organlarda düzgün çalışması için gereklidir. Bu organlar, iç homeostatik durumu korumak için kararlı hücre kasılma ve gevşeme kalıpları üretmelidir. Anormal düz kas hücresi (SMC) kasılması, örneğin bağırsak düz kas kasılmasının anormal paternleri1 ile karakterize bağırsak dismotilitesi ve aşırı aktif2 veya az aktif mesanenin3 ürolojik koşulları dahil olmak üzere çeşitli bozuklukların başlamasına neden olabilir. Hava yollarında, düzensiz kasılma paternleri sergileyen SMC’ler astımlı aşırı duyarlılığı tetikleyebilir4, potansiyel olarak hava yollarını sıkılaştırabilir ve akciğerlere oksijen hava akışını azaltabilir. Bir diğer yaygın fiziksel durum olan hipertansiyon, kan damarlarındaki düz kas kasılmasındaki dalgalanmalardan kaynaklanır5. Açıkçası, hücreler ve dokular içindeki kasılma mekanizmaları, tedavi seçenekleri gerektiren hastalıklara yol açabilir. Bu koşullar açıkça hücrelerin işlevsiz kontraktil davranışlarından kaynaklandığından, potansiyel ilaç adaylarını tararken hücre kontraktil fonksiyonunun kendisini ölçmek mantıklı ve gerekli hale gelir.
Hücresel kontraktil kuvveti incelemek için araçlara duyulan ihtiyacı kabul ederek, akademik araştırmacılar tarafından traksiyon kuvveti mikroskobu (TFM)6, mikrodesenli TFM7, yüzer jel testleri8 ve elastomerik mikropost tahlilleri9 dahil olmak üzere çeşitli kantitatif kasılma testi yöntemleri geliştirilmiştir. Bu teknolojiler çok sayıda çalışmada tek çanaklı formatta ve çok kuyulu plaka formatında kullanılmış ve hatta üç boyutlu kuvvet ölçümleri için önerilmiştir10,11,12,13,14. Bu teknolojiler, hücre kuvveti biyolojisinin geniş alanında öncü araştırmalara olanak sağlamış olsa da, hepsi büyük ölçüde belirli yeteneklere ve kaynaklara sahip laboratuvarlarla sınırlı kalmıştır, özellikle: TFM substratlarını üretme yeteneği, TFM yer değiştirme haritalarını çözmek için karmaşık ve sezgisel olmayan algoritmaları düzgün bir şekilde uygulama yeteneği ve numunenin sahneden çıkarılmasından önce ve sonra çekilen görüntüleri kaydedebilen nispeten hassas mikroskopi sistemleri (hücre ayrışması için). Bu nedenle, eğitimsiz bir araştırmacı için, bu yöntemleri kullanmak için giriş engeli, bu teknolojileri uygulamak için kapsamlı gereksinimler kümesi göz önüne alındığında oldukça yüksek olabilir. Ek olarak, mevcut birçok teknoloji (40x veya daha büyük) için gereken görüntüleme çözünürlüğü deneysel verimi önemli ölçüde sınırlayabilirken, toplu ölçüm teknolojileri aykırı değerlerden gelen katkıları maskeleyebilir ve daha hafif kontraktil farklılıkların keşfedilmesini önleyebilir. Yazarların bildiği kadarıyla, sadece düşük verimli ve yarı kantitatif yüzer jel testi yaklaşımı araştırmacılara sunulacak kadar olgunlaşmıştır (bkz. Şekil 1).
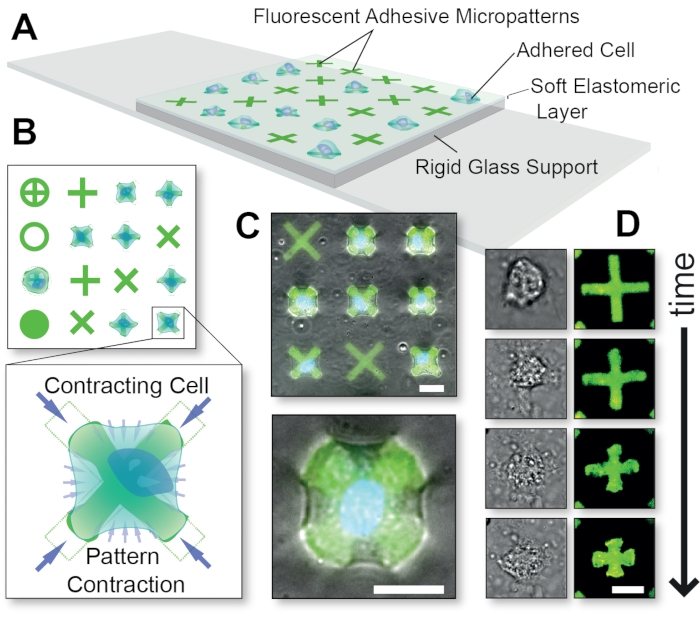
Şekil 1: FLECS Teknolojisi yönteminin genel şeması . (A) Hücreler, cam tarafından desteklenen ince bir elastomerik tabakaya kovalent olarak gömülmüş yapışkan protein mikrodesenlerine yapıştırılır. (B) Çeşitli olası mikro desen şekillerinin üstten görünümü ve ‘X’ şeklinde bir mikro desen büzülen bir hücrenin patlaması. (C) Floresan mikrodesenlerin ve büzülen bir hücrenin faz kontrast görüntülerinin üst üste binmesi. (D) Tek bir büzülen hücrenin zaman rotası görüntüleri. Ölçek çubukları = 25 μm. Bu rakam Pushkarsky et al15’in izniyle uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Mikroteknolojideki son gelişmeleri takiben, yazarlar FLECS (floresan olarak etiketlenmiş elastomerik kontrakte edilebilir yüzeyler) adı verilen yüz binlerce hücrede tek hücreli kasılmanın nicel ölçümlerini sağlayan mikroplaka tabanlı bir teknoloji geliştirdiler15,16,17,18,19,20 , TFM’ye alternatif olarak. Bu yaklaşımda, floresan protein mikrodesenleri, hücreler sezgisel ve ölçülebilir bir şekilde kendilerine çekiş kuvvetleri uyguladığında deforme olan ve küçülen yumuşak filmlere gömülür. Önemli olarak, protein mikro desenleri hücre pozisyonunu, şeklini ve yayılma alanını kısıtlar ve tek tip test koşullarına yol açar. Bunlar, yalnızca 4x büyütme görüntülerinde bile uzamsal olarak yüksek oranda çözülen boyutsal değişikliklerine dayanan basit ölçümlere izin verir. Yöntem, tarayıcı tabanlı bir görüntü analizi modülü içerir ve hassas taşıma prosedürleri veya güvenilir belirteçlerin tescili gerektirmeden kontraktil hücre kuvvetinin basit analizini sağlar, böylece temel bir hücre kültürü tesisi ve düşük büyütmeli basit floresan mikroskobu ile herhangi bir araştırmacı tarafından çalıştırılabilir olmalıdır (Şekil 2 ). Rafa hazır ve ticari olarak temin edilebilen bu teknoloji, son kullanıcı göz önünde bulundurularak tasarlanmıştır ve herhangi bir laboratuvar bilimcisinin hücresel kuvvet biyolojisini incelemesi için giriş engelini azaltmayı amaçlamaktadır.

Şekil 2: Tek hücreli kontraktilite testi için 24 delikli plaka formatının şeması. Bu biçim, burada açıklanan deneylerde kullanılmış ve makalenin video bölümünde gösterilmiştir. Ölçek çubukları = 25 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu çalışmada, primer mesane düz kas hücrelerinde kuvvet modüle edici ilaçların hücresel kontraktilite üzerindeki etkilerini ölçmek için FLECS Teknoloji platformunun 24 kuyucuklu plaka formatını uygulamak için bir protokol sunuyoruz. Bu genel amaçlı protokol, diğer çeşitli zaman ölçeklerini, hücre tiplerini ve ilgilenilen tedavi koşullarını hesaba katmak için gerektiğinde uyarlanabilir ve değiştirilebilir ve kuvvet biyolojisindeki diğer soruları cevaplamak için ölçeklendirilebilir.
Protocol
Representative Results
Discussion
Farklı tedavi koşulları altında bir seferde yüz binlerce hücredeki kasılmayı nicel olarak ölçmek ve sadece standart mikroskopi araçlarını kullanmak için bu basitleştirilmiş yöntem, araştırmacıların hücresel kuvvet biyolojisini incelemeleri için geleneksel TFM’ye erişilebilir bir alternatif sunar. Sunulan teknoloji, düzenli olarak şekillendirilmiş floresan mikro desenlerdeki değişiklikleri analiz ederek hücre kasılmasının görsel bir görüntüsünü sağladığından, herhangi bir hücre tarafından üretilen kasılmanın büyüklüğü sezgisel olarak anlaşılır – mikro model ne kadar küçük olursa, hücre tarafından uygulanan kasılma kuvveti o kadar büyük olur.
Özellikle, mikrodesenleri oluşturan şekil, yayılma alanı ve adezyon molekülü (hücre kontraktilitesini düzenlediği bilinen tüm faktörler22,23,24) gibi faktörler üzerinde kontrol sağlayarak, sunulan teknoloji, hücre kasılma çalışmalarının yorumlarını karıştırabilecek ek değişkenleri sistematik olarak ortadan kaldırmaktadır.
Bu deneyde, jelde 10 kPa sertlik kullanılmış ve tip IV kollajenden oluşan 70 μm (diyagonal uzunlukta) mikrodesen kullanılmıştır. Bu parametrelerin yanı sıra, yapışkan molekül çeşitli kollajenler, fibronektin, jelatin ve diğer hücre dışı matriks (ECM) ile değiştirilebilir. Jelin sertliği 0,1 kPa’ya kadar ve MPa aralığına kadar ayarlanabilir. Mikrodesen geometrisi, ~ 5 μm’lik minimum özellik boyutuna sahip herhangi bir şekil olacak şekilde de novo olarak tasarlanabilir. Bu parametreler ayrıştırılır ve belirli bir biyolojik bağlam için bağımsız olarak optimize edilebilir.
Bu teknolojinin, çeşitli düz kas hücresi tipleri (birincil insan mesanesi, bağırsak, trakeal, bronşiyal, uterus, aort ve arteriyel), mezenkimal kök hücreler ve bunların farklılaşmış soyları, çeşitli fibroblastlar (pulmoner, dermal ve kardiyak), miyofibroblastlar ve endotel hücreleri dahil olmak üzere mezenkimal bir fenotipin yüksek yapışkan ve kontraktil hücre tipleriyle uyumlu olduğu kapsamlı bir şekilde doğrulanmıştır. Ek olarak, monosit türevi makrofajlar, özellikle mikromodel bilinen bir opsoninden oluşuyorsa, mikro desenler üzerinde ölçülebilir büyük fagositik kuvvet üretecektir. Yöntem kullanılarak çeşitli kanser çizgileri de test edilebilir.
Yöntem, T hücreleri ve nötrofiller gibi nispeten küçük hücrelerle veya ağırlıklı olarak epitel fenotipine sahip hücre tipleriyle kullanım için bazı zorluklar doğurabilir. Bunun ana nedeni, yöntemin ölçülebilir kontraktil sinyali üretmek için hücrelerin güçlü yapışmasına ve hücrelerin mikromodel üzerine tamamen yayılmasına dayanmasıdır. Zayıf bir şekilde bağlanan, birbirine bağlanan veya tamamen yayılmayan hücreler ölçülebilir kasılma sinyalleri üretmeyecektir. Nispeten nadir görülen bu davranışlar, mikro desen boyutunu daha küçük olacak şekilde ayarlayarak veya mikro desenler içinde bu hücrelerde yapışmayı ve yayılmayı daha iyi teşvik edecek alternatif yapışkan moleküller kullanılarak hafifletilebilir.
Teknolojinin kullanıcıları, farklı bileşenler, büyüme faktörleri, serum seviyeleri ve pH duyarlılıkları farklı hücrelerde değişken davranışlara neden olabileceğinden, ilgilendikleri hücre tipi için farklı olası hücre kültürü ortam formülasyonlarını dikkatlice değerlendirmelidir. Protokolün optimizasyonu, deneysel iş akışlarının ölçeklendirilmesinden önce gelmeli ve medya bileşenleri her zaman taze, steril ve önceki toplu işlerle tutarlı olmalıdır.
Nihayetinde, bir kullanıcının hedefleri için tek hücreli çözünürlük gerekli değilse veya hedef hücre tipi minimum yayılma kapasitesine sahipse, geleneksel TFM bu tür deneyler için eşit veya daha uygun olabilir. Yazarların amacı ve umudu, bu aracın, hücre biyologlarının, özellikle otomatik yüksek verimli fenotipik ilaç ekranları bağlamında, hücresel kasılmayı incelemeleri için ek bir yol sağlamasıdır.
İlaç ekranlarında gelecekteki kullanımlara özgü olarak, 384 kuyucuklu FLECS plakası gibi daha yüksek verimli plakalar kullanılabilir. Bu tür plakalarda, birçok mikroskoptaki 4x hedefleri, görüş alanlarındaki tek bir kuyunun tamamını yakalayabilir ve tüm hücresel kasılma tepkilerinin yakalanmasını sağlar. Yüksek verimli bir görüntüleme sistemi kullanılarak, 384 kuyucuklu bir plakanın tamamı yaklaşık 5 dakika içinde görüntülenebilir, bu da bu sistemi diğer seçeneklerden önemli ölçüde daha hızlı hale getirir ve bu nedenle yüksek verimli fenotipik ilaç keşfi için uygundur. Gerçekten de, yazarlar rutin olarak haftalık ilaç taramalarını otomasyon kullanarak ~ 50 384 kuyu plakasında (toplam 19.000’den fazla kuyu) çalıştırmaktadır.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Laboratuvar çalışmaları, Forcyte’ın araştırma faaliyetlerine sponsor olduğu UCLA Moleküler Paylaşımlı Tarama Kaynağı (MSSR) ve Forcyte Biotechnologies, Inc.’in yerleşik bir şirket olduğu California NanoSystems Enstitüsü’ndeki (CNSI) Magnify Incubator’ın desteğiyle gerçekleştirildi. Yazarlar, talep üzerine tüm akademik araştırmacılara Biodock.ai FLECS analiz modülüne erişim izni verecektir. L.H. ve I.P. bu çalışmaya eşit derecede katkıda bulundu.
Materials
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
References
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362 (2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539 (2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833 (2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091 (2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).

