معايرة أليسا كأسلوب لتحديد ثابت تفكك مستقبلات يجند التفاعل
Summary
ويرد وصف بروتوكول مفصلة للقيام معايرة أليسا. وعلاوة على ذلك، يرد خوارزمية جديدة لتقييم معايرة اليساس والحصول على ثابت تفكك ملزمة ليجند القابلة للذوبان لمستقبل المعطل تداولها لوحة ميكروتيتير.
Abstract
ثابت تفكك يصف التفاعل بين الشريكين في التوازن الملزم، وهو مقياس لما تقارب. أنها معلمة حاسمة لمقارنة يغاندس مختلفة، مثلاً، ومثبطات تنافسية، isoforms البروتين وطفرات، لقوتها الملزمة لشريك ملزم. ثوابت تفكك تتحدد بالتآمر تركيزات منضم مقابل يجند مجاناً منحنيات ملزمة. وفي المقابل، منحنيات المعايرة، التي يتم رسم إشارة بأن يتناسب مع تركيز يجند منضم ضد التركيز الكلي ليجند المضافة، أسهل بكثير لتسجيل. ويمكن الكشف عن الإشارة سبيكتروسكوبيكالي والمرتبط بالانزيم المرتبط بالانزيم (ELISA). ويتمثل ذلك في وضع بروتوكول لمعايرة أليسا أن التدابير ربط رهودوسيتين المستمدة من السم الثعبان إلى المجال الهدف المعطل تداولها من إنتغرين α2β1. الساس معايرة تنوعاً والمستخدمة على نطاق واسع. يمكن استخدام أي زوج من البروتينات المتفاعلة مستقبلات المعطل تداولها ويجند القابلة للذوبان، شريطة أن كلا البروتينات محض، ومعروفة تركيزات. حتى الآن كانت الصعوبة تحديد ثابت تفكك من منحنى معايرة. في هذه الدراسة، هو إدخال دالة رياضية الكامنة وراء منحنيات المعايرة. دون أي تقدير العائد تشبع رسومية عرضه للخطأ، تسمح هذه الخوارزمية معالجة البيانات الخام (كثافة إشارة بتركيزات مختلفة من يجند المضافة) مباشرة بواسطة التقييم الرياضية عن طريق الانحدار غير الخطي. وهكذا، يمكن تسجيلها في نفس الوقت عدة معايرة المنحنيات وتتحول إلى مجموعة من المعالم المميزة، بينها ثابت التفكك وتركيز مستقبلات ملزم-نشطة، وأنها يمكن تقييمها إحصائيا. عندما يتم دمجها مع هذه الخوارزمية، معايرة الساس كسب ميزة مباشرة عرض ثابت التفكك. ولذلك، يمكن استخدام أكثر كفاءة في المستقبل.
Introduction
ثابت تفكك ك معلمة رئيسية لوصف التقارب من مستقبل (R) لأن يجند (L). استناداً إلى قانون العمل الجماعي، تم تعريفه ك للتوازن، الذي ينأى RL معقدة يجند مستقبلات مستقبلات R ويجند l:
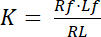 معادلة 1
معادلة 1
مع الأرقام القياسية و التي تشير إلى الدولة الحرة/غير منضم من مستقبلات ويجند. تركيز المجمع مستقبلات-يجند RL، مطابق لتركيز مستقبلات زمنياً يجند لب. كما التركيز الكلي لمستقبلات آرتي هو مجموع مستقبلات الحرة Rو ويجند زمنياً مستقبلات صب = لب، كما يمكن كتابة ثابت التفكك ك:
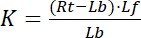 المعادلة 2
المعادلة 2
لذلك، تحقق التشبع Y، تعرف بأنها الجزء من يجند منضم لب فيما يتعلق بالتركيز الكلي لمستقبلات آرتي،
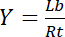 المعادلة 3
المعادلة 3
يعتمد على تركيز يجند مجاناً لو:
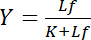 المعادلة 4
المعادلة 4
يصف هذه العلاقة الزائدي المنحنى ملزمة تفاعل مستقبلات-يجند وعلى الأرض يظهر تركيز يجند منضم لب كدالة لتركيز يجند مجاناً لو. من منحنى ملزمة، يمكن اشتقاق ثابت تفكك ك كتركيز يجند مجاناً في الغلة تشبع النصف الأعلى. وعلاوة على ذلك، تم إنشاء خوارزميات مختلفة لينيريزي منحنيات الملزمة، مثل المؤامرة المزدوجة التبادلية كلوتز1،2، أو التحولات وفقا سكاتشارد أو ترفيهي [هنس] (استعرضها بيسوانجير3). ومع ذلك، كافة الخوارزميات يعانون من مشكلة أن الحد الأقصى لقيمة المحصول التشبع، الذي اقترب من شكل مقارب بتركيزات عالية من يجند مجاناً في منحنى ملزمة، يجب أن يكون المقدر في تقييم ما قبل رسومية وبالتالي عرضه للخطأ.
وبالإضافة إلى ذلك، تحديد منحنى ملزم يتطلب التحديد الكمي ليجند حرة وغير المنضمة أثناء التوازن الملزم. وتحقيقا لهذه الغاية، قد يجند مجاناً فصلها من يجند مستقبلات زمنياً وكمياً. ولذلك، يلزم أن يجند ومستقبلات تختلف في خصائصها، مثل يجند غير البروتين بدلاً مستقبلات بروتين. إذا كان كلا الشريكين ملزم البروتينات، أنها يجب أن تكون مميزة في أحجامها، والرسوم، أو ميزات أخرى الجزيئية. ومع ذلك، التحديد الكمي لتركيزات يجند في النهج الملزمة الصغيرة مهمة صعبة. العلامات المشعة ليجند غالباً ما كانت اللازمة للكشف عن تركيز منخفض من يجند المنضم، خاصة إذا كانت كميات كبيرة من مستقبلات لم تكن متاحة أو بتكلفة معقولة. وعلاوة على ذلك، قد ننأى يجند مستقبلات زمنياً أثناء وبعد عزلة بشكل لا يستهان به. ومن ثم، أساليب معقدة، مثل التوازن هلام الترشيح4والتفريد الشعرية5نبض proteolysis6، مطالبون بالتحديد الكمي ليجند مستقبلات زمنياً وفصله من يجند مجاناً.
وعلى النقيض من هذه فحوصات ملزمة، لا تتطلب تجارب المعايرة فصل كمية من يجند حرة وغير المنضمة. وتحقيقا لهذه الغاية، مستقبل بتركيز ثابت هو معاير بتركيزات مختلفة من يجند المضافة. يجند منضم بالربط إلى المستقبلات، خاصية الفيزيائية التي يميزها من يجند حرة وقابلة للقياس من خلال، مثلاً، وقياس الضوء، فلوروميتري، أو الكشف عن الأجسام المضادة. وهكذا، إشارة S، والذي يتناسب مع التشبع تسفر عن ص وعليه أيضا إلى تركيز مستقبلات زمنياً يجند (لب)، يتم الكشف عن كدالة للتركيز الكلي ليجند المضافة (Lt). كل المعلمات وإشارة S والتركيز الكلي ليجند وأضاف كمياً بطريقة مباشرة وأسهل من تركيزات يجند حرة وغير المنضمة. وبخاصة، الكشف عن يجند مستقبلات زمنياً بمقايسة الممتز المرتبط بالانزيم (إليزا) يسمح بالحد حجم العينة إلى أدناه 100 ميليلتر وكذلك قياسات موازية لعدة يجند تركيزات في لوحات متعددة جيدا ميكروتيتير. في معايرة أليسا، مستقبل جسديا تمتز إلى لوحة ميكروتيتير في تركيز نفسه ومعاير مع يجند القابلة للذوبان. هي معطلة المستقبلات على سطح البلاستيك أساسا من الامتزاز مسعور. سطح تركيز مستقبلات المعطل تداولها يرتبط مع تركيز طلاء المستقبلات في علاقة غير خطية، يحتمل وفقا Langmuir´s امتزاز الايسوثرم7. بالإضافة إلى العدد الكلي للجزيئات الممتزة مستقبلات، حالة النشاط معلمة هامة أخرى لفحوصات المعايرة. فقط المعطل تداولها المستقبلات التي احتفظت بنشاط ملزم يجند وهي ذات الصلة للمقايسة المعايرة وتسهم في نهاية المطاف إلى التركيز الكلي ل مستقبلات نشاط البحث والتطويرt لفحص المعايرة، التي لا يمكن تحديدها مباشرة.
المواقع التي لا تغطيها مستقبلات المعطل تداولها على سطح البلاستيك، هم عرضه الجسميات البروتينات الأخرى، مثل يجند. الامتزاز المادية ليجند على مثل هذه المواقع سطح البلاستيك من شأنه أن يؤدي في إشارة مماثلة كما يجند مستقبلات زمنياً، ولكن بطريقة غير محددة. لتقليل هذه الإشارة غير محدد، مواقع سطح البلاستيك من ألواح ميكروتيتير التي قد لا تم المغلفة مع البروتين ولكن سيتم حظر مع ألبومين المصل البقري (BSA). ومع ذلك، لبعض فحوصات المعايرة مستقبلات-يجند، يمكن ملاحظة الإشارات الخلفية غير محدد. آنذاك، وغيرهم من أعوان حظر، يوصي توين 20، مثل حلاً الجيلاتين 0.2% أو 0.04 في المائة.
بعد ملزم المستقبلات، تتم إزالة يجند مجاناً بخطوتين الغسيل. يبقى يجند منضم مع المستقبلات، وهي معطلة على سطح البلاستيك من البئر microtiter، وعززت بشكل اختياري قبل التثبيت الكيميائي. للاحقة التساهمية الصليب-الربط بين يجند منضم ومستقبلات المعطل تداولها مع glutaraldehyde، يتم استبدال المادة العازلة تريس حبيس، دون أي تغيير في ربط يجند. تعطيل حبيس، على النقيض من تريس، لا جلوتارالديهيدي. الصليب-الربط التساهمي مع glutaraldehyde إصلاحات يجند منضم مع مستقبلات لها ويمنع الانفصال من خلال الخطوات اللاحقة الغسيل والحضانة. وهكذا، تفاعل مستقبلات-يجند مجمد كيميائيا وأوامر منحنى معايرة التي لا تتأثر بالخطوات اللاحقة للغسيل والحضانة. ومع ذلك، قد كيميائيا تعديل التثبيت glutaraldehyde يجند ومستقبلات بطريقة أن تفاعلها هو تخفيض أو إلغاء. وعلاوة على ذلك، قد تتغير تعديل [ابيتوبس] داخل يجند تقارب ملزم من جسم كشف، خاصة إذا كان يتم استخدام جسم [مونوكلونل] للتحديد الكمي ليجند منضم. ورغم أن أيا من هذه الآثار الضارة للتثبيت جلوتارالديهيدي يحدث في هذه المعايرة أليسا، يجب اختبار حساسية الاختبار نحو glutaraldehyde لكل تفاعل مستقبلات-يجند قبل تجربة المعايرة. بعد التثبيت، يتم إزالة glutaraldehyde الزائدة في ثلاث خطوات الغسيل مع المخزن المؤقت الذي يحتوي على تريس. تريس يحللها ألدهيد المجموعات المتبقية، التي قد نونسبيسيفيكالي تتفاعل مع كشف الأجسام المضادة في الخطوة اللاحقة.
هو كمياً مقدار يجند منضم مع الأضداد المرتبطة بالانزيم، التي تعطي إشارة أليسا مضوائيه س. هذا هو رسم مقابل تركيز ل يجند مجموعt إضافة لكل بئر. على الرغم من حيازتها أسهل، منحنى المعايرة ليست وظيفة القطعي خلافا للمنحنى ملزمة. وعلاوة على ذلك، فقد غير الواضح كيفية حساب ثابت تفكك ك من منحنى معايرة. على الرغم من أن الخوارزميات منحنيات المعايرة المكتسبة سبيكتروسكوبيكالي لينيريزي أفيد بشكل مستقل ستوكل8 و Heyn وويشيت9، أنها قصرت بسبب عدم اليقين على تقدير إشارة الحد الأقصى قيمة النهج العائد التشبع بتركيزات عالية من يجند المضافة.
هنا، موصوفة معايرة أليسا وخوارزميه انحدار غير خطي لاشتقاق ثابت تفكك ك تفاعلاً يجند مستقبلات من منحنى معايرة. ويتمثل هذا البروتوكول للتفاعل بين الكولاجين-ملزمة بالمجال من α2β1 إنتغرين مع مثبط ثعبان المستمدة من السم. إينتيجرينس هي جزيئات التصاق الخلية، التوسط المرسى للخلايا في المصفوفة خارج الخلية المحيطة أو10،الغشاء الكامنة وراء11. وعلاوة على ذلك، إينتيجرينس ينقل إشارات هامة بين الخلايا والمصفوفة خارج الخلية عن طريق تعيين إشارات جزيئات إضافية وتشكيل خلية جديدة العضيات، أدهيسوميس، عند الخلية-مصفوفة التفاعل12،13، 14-الكولاجين، يجند إنتغرين α2β1، هو البروتين الأكثر وفرة في جسم الإنسان وهو عنصر حاسم سقالات النسيج الضام15. التفاعل بين إنتغرين α2β1 والكولاجين هو توسط أ-المجال فرعية α2 إنتغرين. ويتضمن α2A إنتغرين-المجال الأيونات الموجبة ديفالينت، وهي مطلوبة من أجل ربط الكولاجين واستقرار هيكلها. يمكن بسهولة أنتجت ريكومبينانتلي في نظام تعبير بكتيرية البرية من نوع النموذج فضلا عن طفرات في المجال α2A، مثل تلك التي تم الاستعاضة عن بقايا يتعرض سطح Y216 جليكاين، ومعزولة عن طريق بهم اليغو-صاحب-العلامات مع نينتا عمود سوبيرفلوو مع الغسيل الكلوي لاحقة ضد تريس مخزنة المالحة (TBS؛ 50 مم تريس/HCl، درجة الحموضة 7.4، 150 مم كلوريد الصوديوم) 2 مم مجكل2تحتوي على16. تم تحديد تركيزات بهم مع مقايسة حمض بيسينتشونينيك (اتفاق التعاون الأساسي) واختبارها من قبل الحزب الديمقراطي الصربي صفحة التقليدية بهم بورتيس وملطخة بأخذ الرائعة R250 الأزرق.
التفاعل بين إنتغرين α2β1 والكولاجين محظور بواسطة ربط عنصر ثعبان السم، رهودوسيتين، من16،الممهد حفرة الأفعى (رهودوستوما كالوسيلاسما)17. يستخدم يجند القابلة لذوبان في هذه المعايرة أليسا، رهودوسيتين تمت تنقيته من النفط الخام السم كما هو موضح سابقا16. يذوب في المحلول الملحي مخزنة حبيس (ميزانيات؛ 10 ملم حبيس/هيدروكسيد الصوديوم، درجة الحموضة 7.4، 150 مم كلوريد الصوديوم) ويتم تخزينها مجمدة عند-20 درجة مئوية. تركيزه كان يحددها اتفاق التعاون الأساسي وثبتت النقاء من الحزب الديمقراطي الصربي صفحة. كخصم، رهودوسيتين ليس فقط كتل الكولاجين ملزم إنتغرين A α2β1 المجال، ولكن أيضا استقرار المطابقة غير نشط من إنتغرين مما يحول دون أي إشارة من الكولاجين في الخلايا أو الصفائح الدموية18. أنها من الأهمية الطبية تحديد ثابت تفكك من رهودوسيتين مع هدفها مستقبلات وهكذا كشف عن الآلية الجزيئية والأدوية المحتملة مثلاً، كعامل أنتيثرومبوتيك. تحقيقا لهذه الغاية، معايرة أليسا توصف بما في ذلك في تقييمه، وهو ينطبق على ما يقرب من أي تفاعل مستقبلات-يجند مع stoichiometry تفاعل 1:1.
Protocol
Representative Results
Discussion
أليسا المعايرة نظام اختبار متعددة لتحديد الانفصال من تفاعل مستقبلات-يجند. المعايرة تلتف أليسا ضرورة لفصل يغاندس الحرة وهي مقيدة فعلياً وتحليل تركزاتها كمياً، أكثر بكثير من الدراسات والمنشورات استخدمت معايرة الساس بدلاً من تسجيل منحنيات ملزمة . وعلاوة على ذلك، معايرة اليساس سهلة لأداء و?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
البروتوكول والخوارزمية وضعت ضمن مشروع ممول من الأوقيانوغرافية الألمانية (DFG منحة SFB1009 A09 و EB177/13-1). بفضل مقدم البلاغ باربرا شيدينج وفيلكس شمالبين للدعم الفني والدكتور نيلاند للغاية قراءة المخطوطة.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

