6.11:
표준 생성 엔탈피
6.11:
표준 생성 엔탈피
엔탈피 변화는 일반적으로 반응제와 제품 모두 동일한 조건에 있는 반응에 대해 표로 매화됩니다. 표준 상태는 다른 다른 조건하에서 속성 의 측정을 위한 기준점으로 사용되는 일반적으로 허용되는 조건 집합입니다. 화학자의 경우 IUPAC 표준 상태는 1M의 압력 하에서 물질을 말하며 온도를 지정하지 않습니다. 많은 열화학 표는 1 atm의 표준 상태를 가진 값을 나열합니다. 반응의 ΔH는 압력(1bar = 0.987 atm)의 작은 변화와 함께 거의 변경되지 않으므로 ΔH 값(가장 정확하게 측정된 값을 제외하고)은 두 표준 조건 하에서 본질적으로 동일합니다. 엔탈피 변경 기호의 “o”는 표준 상태를 지정합니다. 일반적인 온도 (기술적으로 표준은 아니지만) 온도는 298.15 K이므로 다른 온도를 지정하지 않는 한이 온도가 가정됩니다. 따라서, 심볼(ΔH°)은이러한 조건 하에서 발생하는 공정에 대한 엔탈피 변화를 나타내는 데 사용된다. (기호 ΔH는 비표준 조건하에서 발생하는 반응에 대한 엔탈피 변화를 나타내는 데 사용됩니다.)
많은 유형의 화학 적 및 물리적 과정에 대한 엔탈피 변화는 연소 반응, 위상 전환 및 형성 반응을 포함하여 참조 문헌에서 사용할 수 있습니다. 주어진 반응에 대한 엔탈피 변화는 관련된 물질의 양에 비례하기 때문에, 그 기초에 보고될 수 있다(즉, 특정 양의 반응에 대한 Δ H로). 그러나, 우리는 종종 하나의 광범위한 속성 (ΔH)을다른 (물질의 양)로 나누고, 종종 두더지 당 기준으로 “정규화”인 ΔH의양 집약적 인 값을보고하는 것이 더 유용하다고 생각합니다.
형성의 표준 엔탈피
형성 ΔHf°의 표준 엔탈피는 표준 상태 조건하에서 가장 안정적인 상태에서 자유 원소에서 순수한 물질의 정확히 1 두더지가 형성되는 반응에 대한 엔탈피 변화입니다. 이러한 값은 실용적이지 않거나 실행하기 어려운 화학 반응 또는 측정하기 어려운 프로세스에 대한 엔탈피 변화를 계산하거나 예측하는 데 특히 유용합니다. 형성의 표준 엔탈피의 알려진 값을 사용하여, 어떤 반응에 대한 엔탈피 변화를 결정할 수 있습니다.
CO2 (g)의형성의 표준 엔탈피는 -393.5 kJ / mol입니다. 이것은 엑소더스 반응에 대한 엔탈피 변화입니다.
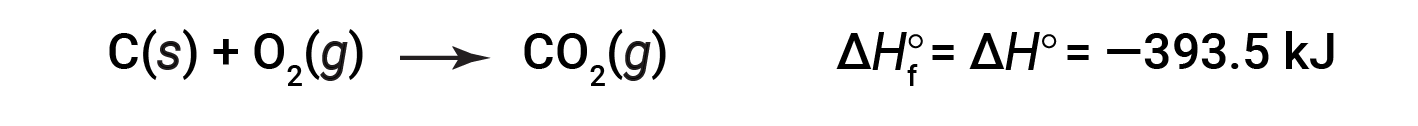
1 atm 및 25°C의 압력에서 반응체로 시작하여 (이러한 조건하에서 가장 안정적인 형태의 탄소인 흑연으로 존재하는 탄소와 함께) 1 atm 및 25°C에서도 CO2의두더지 1개로 끝납니다. 이산화질소의 경우 NO2(g),ΔHf°는 33.2 kJ/mol입니다. 이것은 엔더스 반응에 대한 엔탈피 변화입니다.

N2의 1/2두더지와O2의 1/2 두더지가 있는 반응 방정식은 이 경우 형성의 표준 엔탈피가 항상 1개의 두더지(NO 2(g)를 지칭하기 때문에 정확하다.
정의에 따르면, 가장 안정적인 형태로 요소의 형성의 표준 엔탈피는 표준 조건하에서 0과 같습니다. 예를 들어, 탄소(그래핀), 다원자 산소 가스, 다원자 질소 가스, 나트륨 금속 및 액체 수은의 형성의 표준 엔탈피는 표준 조건하에서 0입니다.
Suggested Reading
- Hawk, Eric Leigh. "The calculation of standard enthalpies of formation of alkanes: Illustrating molecular mechanics and spreadsheet programs." Journal of chemical education 76, no. 2 (1999): 278.
- Mazzuca, James W., Alexis R. Downing, and Christopher Potter. "Empirically corrected electronic structure calculations applied to the enthalpy of combustion physical chemistry laboratory." Journal of Chemical Education 96, no. 6 (2019): 1165-1170.
- Jansen, Michael P. "The Cost of Converting a Gasoline-Powered Vehicle to Propane. A Practical Review Problem for Senior High School or Introductory Chemistry." Journal of Chemical Education 77, no. 12 (2000): 1578.
