17.4:
Третий закон термодинамики
17.4:
Третий закон термодинамики
Чистый, идеально кристаллический твердый, не обладающий кинетической энергией (то есть при температуре абсолютного нуля, 0 к) может быть описан одним микросостоянием, как его чистота, Идеальная кристаллочность, полное отсутствие движения означает, что для каждого идентичного атома или молекулы, составляющих кристалл, существует только одно возможное местоположение (W = 1). По уравнению Больцмана энтропия этой системы равна нулю.
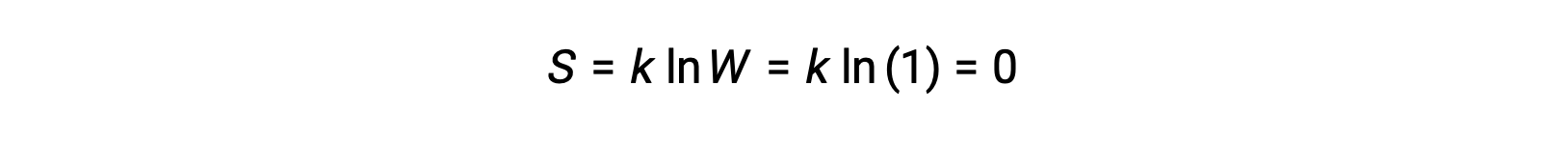
Это ограничивающее условие энтропии системы представляет собой третий закон термодинамики: Энтропия чистого, совершенного кристаллического вещества при 0 к равна нулю.
Для определения температурной зависимости от энтропии вещества и получения абсолютных значений энтропии в конкретных условиях можно провести тщательные калориметрические измерения. Стандартные энтропики (S°) предназначены для одного моль вещества в стандартных условиях. Различные вещества имеют разные стандартные значения молярной энтропии в зависимости от физического состояния вещества, молярной массы, аллотропных форм, молекулярной сложности и степени растворения.
Из-за большей диспергирования энергии между рассеянными частицами в газовой фазе газообразные формы веществ имеют тенденцию иметь гораздо больше стандартных молярных энтальпий, чем их жидкие формы. По аналогичным причинам жидкие формы веществ имеют, как правило, более крупные значения, чем их твердые формы. Например, S°H2O (l) = 70 Дж/моль·K и S°H2O (g) = 188.8 Дж/моль·K.
Среди элементов в том же состоянии более тяжелый элемент (большая молярная масса) имеет более высокое стандартное значение молярной энтропии, чем более легкий элемент. Например, S°AR (g) = 154.8 Дж/моль·K и S°XE (g) = 159.4 Дж/моль·K.
Аналогично, среди веществ в том же состоянии более сложные молекулы имеют более высокие стандартные значения энтальпии моляра, чем более простые. Существуют более возможные расположения атомов в более крупных, более сложных молекулах, что увеличивает количество возможных микросостояний. Например, S°AR (g) = 154.8 Дж/моль·K и S°NO (g) = 210.8 Дж/моль·K несмотря на более высокую молярный массу аргона. Это связано с тем, что в газообразном аргоне энергия принимает форму поступательного движения атомов, в то время как в газообразном оксиде азота (NO) энергия принимает форму поступательного движения, вращательного движения и (при достаточно высоких температурах) колебательных движений молекул.
Стандартная молярная энтропия любого вещества увеличивается при повышении температуры. При фазовых переходах, таких как переход от твердого вещества к жидкому и сжиганному, происходят большие скачки энтропии, что связано с внезапным увеличением молекулярной подвижности и увеличением доступных объемов, связанных с фазовыми изменениями.
Этот текст адаптирован к Openstax, Химия 2е изд., Глава 16.2: Второй и третий Закон термодинамики.
