17.4:
热力学第三定律
17.4:
热力学第三定律
一个完全不含动能的纯结晶固体 (即在绝对零温度下为 0 K) 可能被单个微状态描述为其纯度, 完美的结晶度和完全缺乏运动意味着每一个组成晶体的相同原子或分子只有一个可能的位置 (W = 1)。 根据博尔兹曼方程,该系统的熵为零。
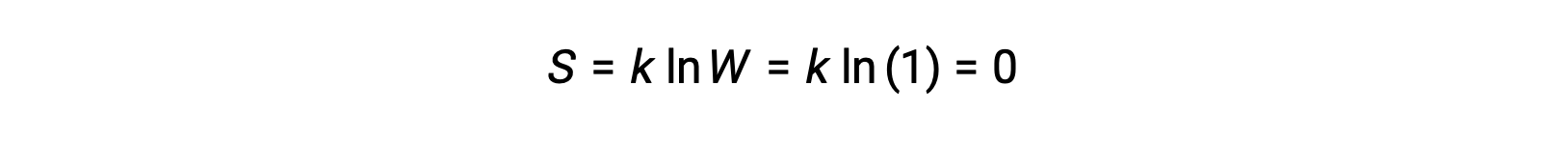
系统熵的这种限量条件代表热力学第三定律: 0 K 时纯,完美结晶物质的熵为零。
可以进行仔细的量度法测量,以确定物质熵的温度相关性,并在特定条件下得出绝对熵值。 标准托架 (S°) 用于在标准条件下一个摩尔物质的托架。 不同的物质具有不同的标准摩尔熵值,具体取决于物质的物理状态,摩尔质量,各向同性形式,分子复杂性和溶解的范围。
由于能量耗散中分散的粒子中的气相越大,气体形式的物质的标准摩尔焓往往比其液体形式大得多。 由于类似的原因,液体形式的物质的数值往往大于固体形式。 例如, S°H2O (l) = 70 焦耳·/ 摩尔 K , S°H2O (g) = 188.8 焦耳·/ 摩尔 K
在相同状态的元素中,较重元素 (较大的摩尔质量) 的标准摩尔熵值高于较轻元素。 例如, S°AR (g) = 154.8 焦耳 / 摩尔·K , S°XE (g) = 159.4 焦耳·/ 摩尔 K
同样,在同一状态的物质中,较复杂的分子具有比较简单的摩尔焓值更高的标准摩尔焓值。 更大,更复杂的分子中原子的排列可能会增加可能的微酸盐数量。 例如, S°AR (g) = 154.8 焦耳·/ 摩尔 K , S°NO (g) = 210.8 焦耳·/ 摩尔 K ,尽管氩气摩尔质量较高。 这是因为在气态氩中,能量采用原子的转化运动形式,而在气态氮氧化物 (NO) 中,能量采用分子的转化运动,旋转运动和 (在足够高的温度下) 振动运动的形式。
任何物质的标准摩尔熵都会随着温度的升高而升高。 在相变,例如从固体到液体,再到液体再到气体,熵会发生大跳,这是由于分子移动性突然提高,并且与相变相关的可用容量更大。
