6.12:
Entalpias de Reações
6.12:
Entalpias de Reações
A lei de Hess pode ser usada para determinar a alteração da entalpia de qualquer reação se as correspondentes entalpiaa de formação dos reagentes e produtos estiverem disponíveis. A reação principal pode ser dividida em reações por passos : (i) decomposições dos reagentes nos seus elementos componentes, para os quais as alterações da entalpia são proporcionais ao negativo das entalpias de formação dos reagentes, −ΔHf°(reagentes), seguida de (ii) recombinações dos elementos (obtidos no passo 1) para originar os produtos, com as alterações de entalpia proporcionais às entalpias de formação dos produtos, ΔHf° (produtos). A alteração da entalpia padrão da reação global é portanto igual a: (ii) soma das entalpias padrão de formação de todos os produtos mais (i) soma dos negativos das entalpias padrão de formação dos reagentes, tal como indicado pela equação seguinte, onde ∑ representa “a soma de” e n representa os coeficientes estequiométricos.
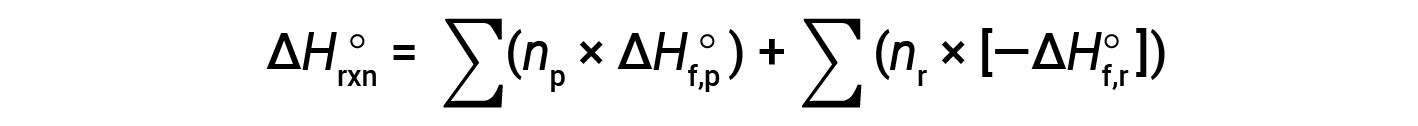
A equação é geralmente rearranjada ligeiramente para ser escrita como se segue:
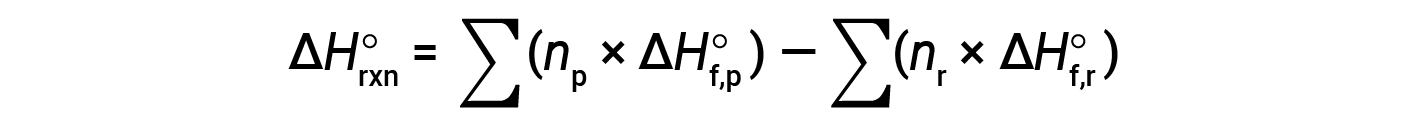
O exemplo a seguir mostra em detalhes por que esta equação é válida e como usá-la para calcular a alteração da entalpia padrão para uma reação:

Aqui, utiliza-se a forma especial da lei de Hess e os valores de formação de calor para os reagentes e produtos: ΔHf° (HNO3) = −206,64 kJ/mol; ΔHf° (NO) = +90,2 kJ/mol; ΔHf° (NO2) = +33 kJ/mol; ΔHf° (H2O) = −285,8 kJ/mol.


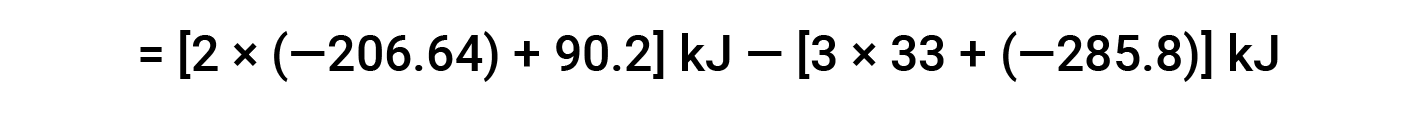
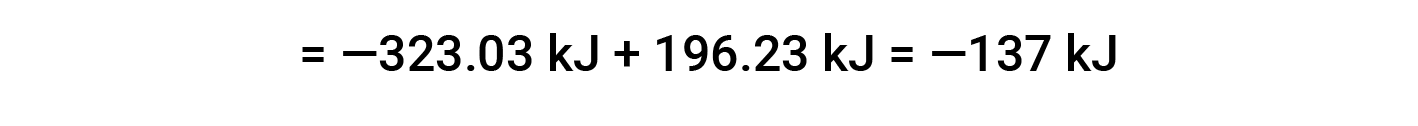
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.3: Enthalpy.
Suggested Reading
- Davis, Thomas W. "A common misunderstanding of Hess' law." Journal of Chemical Education 28, no. 11 (1951): 584.
- Lee, A. L., H. L. Feldkirchner, F. C. Schora, and J. J. Henry. "Heat of Reaction of Hydrogen and Coal." Industrial & Engineering Chemistry Process Design and Development 7, no. 2 (1968): 244-249.
