6.12:
反应焓
对于在标准条件下发生的反应,用一个一般方程式来计算反应的 标准焓变。该方程式的求解是通过求出 产物的标准生成焓之和 与反应物的标准生成焓 之和之间的差值,每一项各乘以其化学计量系数。比如在标准条件下 2 摩尔 的乙炔气与 5 摩尔的氧气发生燃烧反应,形成 4 摩尔的二氧化碳气体 和 2 摩尔的水蒸气。该反应的焓等于 二氧化碳气体生成焓 的四倍和水蒸气生成焓 的两倍之和,减去乙炔气生成焓 的两倍和氧气生成焓的五倍 之和。焓方程式是结合两个概念推导 出来的:标准生成焓和赫斯定律。第一项代表产物的标准生成焓;由碳和氧气生成 二氧化碳—方程式 1,以及由氢气和氧气生成水的过程—方程式 2。二氧化碳和水的已知标准生成焓 分别为负的 393.5 千焦耳和负的 241.8 千焦耳。由于燃烧反应会产生 4 摩尔的二氧化碳,H1 应该为二氧化碳的 标准生成焓乘以 4,即负的 1574 千焦耳。燃烧同时会产生 2 摩尔的水,所以焓变—H2—应该为水的标准生成焓乘以 2,即负的 483.6 千焦耳。这就产生了产物的 净标准生成焓为负的 2058 千焦耳。第二项代表乙炔分解成 碳和氢气的反应—方程式 3。这个反应与反应物的标准 生成焓的反应是相反的,因此它的焓值,227.4 千焦耳,前面有一个负号,这在焓方程中也可以看到。因为反应消耗了 2 摩尔的乙炔,H3 应该是乙炔的标准生成焓 乘以 2 的负值,等于负的 453.4 千焦耳。氧气的标准生成焓为零。因此,反应物的净标准 生成焓为负的 453.4 千焦耳。回想一下赫斯定律,如果一个一步反应是在 多个步骤中进行的,那么 每一步的焓之和,等于净焓变化。将生成焓的值代入 方程式中,得出反应的焓 为负的 2511 千焦耳。
6.12:
反应焓
如果可以得到相应的反应物和产物的生成焓,则可以使用赫斯定律来确定任何反应的焓变。主要反应可分为逐步反应:(i)反应物分解成其组成元素,其焓变与反应物形成焓的负数成正比,−ΔHf°(反应物),然后(ii)重新组合元素(在步骤1中获得),得到产物,其焓变与生成的焓成正比。产品 ΔHf°(产物)。因此,整个反应的标准焓变等于:(ii)所有产物形成的标准焓之和加上(i)反应物形成的标准焓的负数之和,由下式给出:以下等式,其中∑代表“之总和” n 代表化学计量系数。
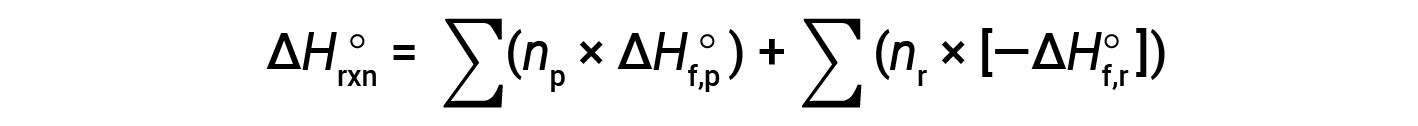
通常将等式重新排列为以下形式:
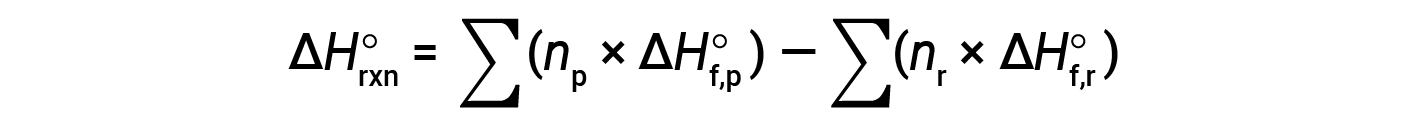
以下示例详细显示了此方程为何有效以及如何使用该方程计算反应的标准焓变:

在此,使用赫斯定律的特殊形式以及反应物和产物的形成热值: ΔHf° (HNO3) = −206.64 kJ/mol; ΔHf° (NO) = +90.2 kJ/mol; ΔHf° (NO2) = +33 kJ/mol; ΔHf° (H2O) = −285.8 kJ/mol.


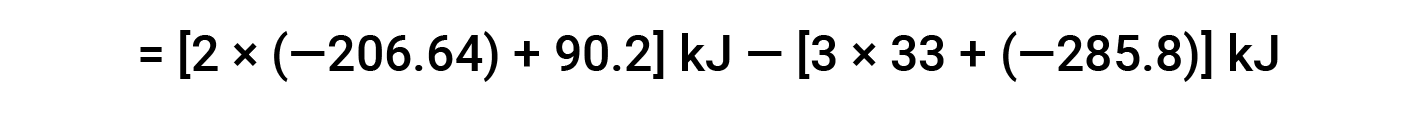
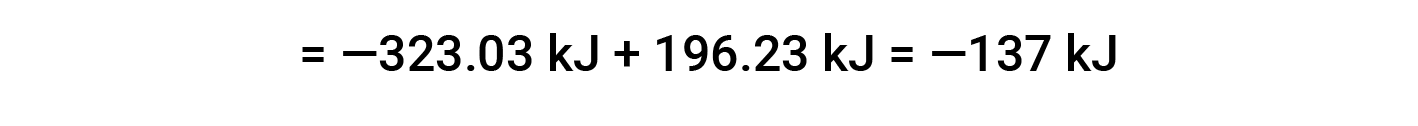
本文改编自 Openstax,化学2e,第5.3节:焓。
Suggested Reading
- Davis, Thomas W. "A common misunderstanding of Hess' law." Journal of Chemical Education 28, no. 11 (1951): 584.
- Lee, A. L., H. L. Feldkirchner, F. C. Schora, and J. J. Henry. "Heat of Reaction of Hydrogen and Coal." Industrial & Engineering Chemistry Process Design and Development 7, no. 2 (1968): 244-249.
