المسلسل كتلة الوجه المسح المجهري الإلكترون (SBEM) لدراسة العمود الفقري Dendritic
Summary
يتم تطبيق المجهر الإلكتروني التسلسلي لمسح الوجه الكتلي (SBEM) على صورة وتحليل العمود الفقري التشجر في قرن آمون مورين.
Abstract
المجهر الإلكتروني ثلاثي الأبعاد (3D EM) يعطي إمكانية لتحليل المعلمات المورفولوجية للعمود الفقري التشجر مع دقة النانو. بالإضافة إلى ذلك ، يمكن ملاحظة بعض ميزات العمود الفقري التشجر ، مثل حجم العمود الفقري وكثافة ما بعد متشابك (PSD) (تمثل جزءا ما بعد متشابك من المشبك) ، ووجود محطة presynaptic ، وشبكية endoplasmic السلس أو شكل غير نمطي من PSD (على سبيل المثال ، العمود الفقري متعددة الداخلية) ، إلا مع 3D EM. باستخدام المجهر الإلكتروني التسلسلي لمسح الوجه الكتلي (SBEM) ، من الممكن الحصول على بيانات EM ثلاثية الأبعاد بشكل أسهل وبطريقة أكثر قابلية للاستنساخ مما كانت عليه عند إجراء القسم التسلسلي التقليدي. هنا نعرض كيفية إعداد عينات فرس النهر الماوس لتحليل SBEM وكيف يمكن الجمع بين هذا البروتوكول مع دراسة immunofluorescence من العمود الفقري التشجر. يسمح لنا التشوه التثبيتي المعتدل بإجراء دراسات الفلورة المناعية باستخدام المجهر الخفيف على نصف الدماغ ، في حين تم إعداد النصف الآخر ل SBEM. هذا النهج يقلل من عدد الحيوانات التي ستستخدم للدراسة.
Introduction
وتقع معظم نقاط الاشتباك العصبي مثير في الجهاز العصبي المركزي على العمود الفقري التشجر – نتوءات صغيرة من غشاء الخلايا العصبية. تشكل هذه النتوءات مقصورات بيوكيميائية محصورة تتحكم في نقل الإشارات داخل الخلايا. ترتبط اللدونة الهيكلية للعمود الفقري المتشجر ونقاط الاشتباك العصبي ارتباطا وثيقا بالتغيرات الوظيفية في الفعالية المتشابكة التي تكمن وراء عمليات مهمة مثل التعلم والذاكرة1و2. من المهم ملاحظة أن المجهر الإلكتروني (EM) هو التقنية الوحيدة التي تسمح بتحديد ما إذا كان العمود الفقري التشجر لديه مدخل ما قبل الاشتباك العصبي. هناك حاجة أيضا إلى دقة EM لدراسة التفاصيل الهيكلية الفائقة مثل شكل كثافة ما بعد المتشابك (PSD) ، والتي تمثل جزءا من متشابكة من المشبك ، أو أبعاد العمود الفقري المتشعب ، وكذلك حجم وشكل بوتون أكسنال. بالإضافة إلى ذلك، مع EM فمن الممكن تصور نقاط الاشتباك العصبي والمناطق المحيطة بها.
بفضل التقدم في تقنيات التصوير والحوسبة ، من الممكن إعادة بناء دوائر عصبية بأكملها. تقنيات المجهر الإلكتروني حجم, مثل المقطع التسلسلي انتقال المجهر الإلكتروني (ssTEM), المسلسل كتلة الوجه المسح المجهري الإلكتروني (SBEM), وركزت شعاع أيون المسح المجهري الإلكتروني (FIB-SEM) وتستخدم عادة لإعادة بناء الدائرة العصبية3.
في دراساتنا، يتم استخدام طريقة SBEM بنجاح للتحقيق في اللدونة الهيكلية للعمود الفقري التشجر وPSDs في عينات من قرن آمون الماوس وشرائح الدماغ organotypic 4،5. ويستند SBEM على تركيب ميكروميكروم مصغرة داخل غرفة المجهر الإلكتروني المسحالضوئي 6،7،8،9. يتم تصوير الجزء العلوي من كتلة العينة ، ثم يتم قطع العينة على عمق محدد بواسطة ultramicrotome ، مما يكشف عن وجه كتلة جديد ، والذي يتم تصويره مرة أخرى ثم يتم تكرار العملية8. ونتيجة لذلك، يتم ترك صورة وجه الكتلة فقط بينما يتم فقدان الشريحة التي تم قطعها كحطام. هذا هو السبب في أن SBEM يسمى تقنية مدمرة ، مما يعني أنه من غير الممكن تصوير نفس المكان مرة أخرى. ومع ذلك ، فإن ميزة الأساليب المدمرة على الكتلة هي أنها لا تعاني من مشاكل تزييفها وفقدان القسم الذي يمكن أن يؤثر بشكل كبير على جودة البيانات وتحليل البيانات3. وعلاوة على ذلك، يعطي SBEM إمكانية لتصوير مجال رؤية كبير نسبيا (> 0.5 ملم × 0.5 ملم) بدقة عالية3.
لتوظيف SBEM ، يجب إعداد العينات وفقا لبروتوكول مخصص ومتناقض للغاية بسبب كاشف الإلكترونات المكثرة المستخدمة للحصول على الصور. نعرض هنا كيفية إجراء إعداد العينة وفقا للبروتوكول استنادا إلى إجراء طورته Deerinck10 (المركز الوطني لبحوث المجهر والتصوير (NCMIR) الأسلوب)، وذلك باستخدام انخفاض osmium-thiocarbohydrazide-osmium (rOTO) البقع وضعت في 1980s8،11. بالإضافة إلى ذلك ، نقدم نهج تثبيت من خطوتين ، مع تغلغل تثبيت خفيف يسمح باستخدام نفس الدماغ لكل من دراسات الفلورة المناعية مع المجهر الخفيف وSBEM.
في البروتوكول يتم إصلاح دماغ الفأر في المقام الأول مع تثبيت معتدل ، ثم يقطع إلى نصفين ، ويتم تثبيت نصف الكرة الأرضية واحد وإعداده للفلورة المناعية (IF) ، في حين أن الآخر لدراسات EM(الشكل 1).

الشكل 1. تمثيل تخطيطي لسير العمل للعمود الفقري dendritic التحضير للتحليل مع SBEM. تم التضحية بالفئران وثقبها مع مثبت أولي خفيف. تم قطع الدماغ إلى أنصاف ، وتم تثبيت نصف الكرة الأرضية مع immunofluorescence (IF) المخصصة المثبتة ، cryoprotected ، شرائح باستخدام cryostat ومعالجتها لدراسات IF ، في حين تم postfixed نصف الكرة الآخر مع مثبت EM ، شرائح مع الهزاز وأعدت لدراسات EM. وتباينت شرائح الدماغ لدراسات SBEM، شقة جزءا لا يتجزأ من الراتنج، ثم تم تركيب منطقة CA1 من قرن آمون إلى دبوس، وصورت مع SBEM (الشكل 1). وظهر الجزء من البروتوكول الذي تم تسليط الضوء عليه في صندوق أصفر في الفيديو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
هناك العديد من الاختلافات في الطريقة NCMIR الأولية التي وصفها Deerinck في 201010. وتظل المبادئ الأساسية كما هي، ولكن، تبعا لنوع المواد التي تمت دراستها، يتم تنفيذ تغييرات طفيفة. وقد وصف سابقا أن الراتنجات المختلفة يمكن استخدامها لتضمين عينات لSBEM وعلى سبيل المثال في حالة النباتات، Spurr ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم إجراء التصوير SBEM والتصوير المجهري الخفيف وإعداد عينة المجهر الإلكتروني باستخدام معدات مختبر الأنسجة التصويرية والوظيفة التي تعمل كمرفق أساسي للتصوير في معهد نينكي للبيولوجيا التجريبية.
لإعداد الشكل 1، تم استخدام صورة فأر (Souris_02)، وقارورة من https://smart.servier.com/.
وقد دعم هذا العمل من قبل المركز الوطني للعلوم (بولندا) منحة أوبوس (UMO-2018/31/B/NZ4/01603) الممنوحة ل KR.
Materials
| Anesthetic: | |||
| Ketamine/xylazine mixture (Ketamina/Sedazin) | Biowet Pulawy, Pulawy, Poland | ||
| Sodium pentobarbital (Morbital) | Biowet Pulawy, Pulawy, Poland | ||
| Fixatives: | |||
| Glutaraldehyde (GA) | Sigma-Aldrich,St. Louis, MI, USA | G5882 | Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative |
| Hydrochloric acid (HCl) | POCH, Gliwice, Poland | 575283115 | pure p.a. |
| Paraformaldehyde (PFA) | Sigma-Aldrich,St. Louis, MI, USA | 441244 | prilled, 95% |
| Phosphate buffered saline (PBS), pH 7.4 | Sigma-Aldrich,St. Louis, MI, USA | P4417-50TAB | tablets |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade, 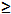 98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich,St. Louis, MI, USA | S3264 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich,St. Louis, MI, USA | S3139 | |
| Perfusion: | |||
| Large blunt/blunt curved scissors (~14.5 cm) | Fine Science Tools, Foster City, CA, USA | 14519-14 | |
| Micro-spatula (double 2" flat ends, one rounded, one tapered to 1/8") | Fine Science Tools, Foster City, CA, USA | 10091-12 | |
| Needle tip, 15 GA, blunt (perfusion needle) | KD Medical GmbH Hospital Products, Berlin, Germany | KD-FINE 900413 | 1.80 x 40 mm |
| Pair of fine (Graefe) tweezers | Fine Science Tools, Foster City, CA, USA | 11050-10 | |
| Perfusion pump | Lead Fluid | BQ80S | |
| Plastic vials | Profilab, Warsaw, Poland | 534.02 | plastic vials with blue cap for tissue storage, 20 ml, 31 x 48 mm |
| Straight iris scissors (~9 cm) | Fine Science Tools, Foster City, CA, USA | 14058-11 | |
| Brain slices preparation for EM: | |||
| 12-well plate | NEST, Rahway, NJ, USA | 712001 | |
| Cyanoacrylic glue | Fenedur, Montevideo, Uruguay | ||
| Glass vials | Electron Microscopy Sciences, Hatfield, PA, USA | 72632 | 20 ml Scintillation Vial, a pack of 100 |
| Pasteur pipette | VWR, Radnor, PA, USA | 612-4545 | LDPE, disposable, 7.5 ml |
| Razor blade | Wilkinson Sword, London, UK | Classic double edge safety razor blades | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Vibratome | Leica Microsystems, Vienna, Austria | Leica VT1000 S | |
| Brain slices preparation for IF: | |||
| 96-well plate | NEST, Rahway, NJ, USA | 701101 | |
| Criostat | Leica Microsystems, Vienna, Austria | Leica CM 1950 | |
| Ethylene glycol | Bioshop, Burlington, Canada | ETH001 | |
| Low-profile disposable blade 819 | Leica Biosystems Inc., USA | 14035838925 | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Sodium azide (NaN3) | POCH, Gliwice, Poland | 792770426 | |
| Sucrose | POCH, Gliwice, Poland | 772090110 | |
| Tissue freezing medium for cryosectioning, OCT-Compound | Leica Biosystems, Switzerland | 14020108926 | |
| Immunostaining: | |||
| 24-well plate | NEST, Rahway, NJ, USA | 702001 | |
| Anti-Post Synaptic Density Protein 95 Antibody | Merck-Millipore, Burlington, MA, USA | MAB1598 | |
| Confocal microscope | Zeiss, Göttingen, Germany | Zeiss Spinning Disc microscope (63 × oil objective, NA 1.4, pixel size 0.13 µm × 0.13 µm) | |
| Cover slide | Menzel Glaser, Braunschweig, Germany | B-1231 | 24 x 60 mm |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen, Carlsbad, CA, USA | A31570 | |
| Fluoromount-G Mounting Medium, with DAPI | Invitrogen, Carlsbad, CA, USA | 00-4959-52 | |
| Microscope slide | Thermo Scientific, Waltham, MA, USA | AGAA00008 | SuperFrost |
| Normal donkey serum (NDS) | Jackson ImmunoResearch Laboratories, West Grove, PA, USA | 017-000-121 | |
| Shaker | JWElectronic, Warsaw, Poland | KL-942 | |
| TritonT X-100 Reagent Grade | Bioshop, Burlington, Canada | TRX506 | |
| Electron microsocpy sample preparation | |||
| Potassium hexacyanoferrate(II) trihydrate | POCH, Gliwice, Poland | 746980113 | |
| Aclar 33C Film | Electron Microscopy Sciences, Hatfield, PA, USA | 50425 | Fluoropolymer Film embedding sheet |
| DMP-30, 2,4,6-Tris(dimethylaminomethyl)phenol | Sigma-Aldrich,St. Louis, MI, USA | T58203 | Epoxy embedding medium accelerator |
| Durcupan ACM single component A, M | Sigma-Aldrich,St. Louis, MI, USA | 44611 | Durcupan ACM single component A, M epoxy resin |
| Durcupan ACM single component B | Sigma-Aldrich,St. Louis, MI, USA | 44612 | Durcupan ACM single component B, hardener 964 |
| Durcupan ACM single component D | Sigma-Aldrich,St. Louis, MI, USA | 44614 | Durcupan ACM single component D , plasticizer |
| Ethyl alcohol absolute | POCH, Gliwice, Poland | 64-17-5 | Ethyl alcohol absolute 99.8 % pure P.A.-BASIC |
| Genlab laboratory oven | Wolflabs, York, UK | Mino/18/SS | Oven Genlab MINO/18/SS 18l volume, no fan circulation, no digital display, standard temperature gradient, standard recovery rate, no timer, 250°C maximum temperature, 240V electrical supply |
| L-Aspartic acid | Sigma-Aldrich,St. Louis, MI, USA | A-9256 | reagent grade, 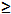 98% (HPLC) 98% (HPLC) |
| Lead (II) nitrate | Sigma-Aldrich,St. Louis, MI, USA | 467790 | 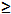 99.95% trace metals basis 99.95% trace metals basis |
| Osmium tetroxide | Sigma-Aldrich,St. Louis, MI, USA | 75632 | for electron microscopy, 4% in H2O |
| pH meter | Elmetron, Zabrze, Poland | CP-5-5 | |
| Rotator | BioSan, Józefów, Poland | Multi Bio RS-24 | rotator Multi Bio RS-24 |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade, 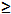 98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sunflower mini shaker | Grant bio, Shepreth,UK | PD-3D | |
| Syringe filter | Millipore, Burlington, MA, USA | SLGP033NB | 0,22 µm pore size |
| Thiocarbohydrazide | Sigma-Aldrich,St. Louis, MI, USA | 88535 | purum p.a., for electron microscopy, 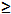 99.0% (N) 99.0% (N) |
| Uranyl acetate | Serva, Heidelberg, Germany | 77870 | Uranyl acetate·2H2O, research grade |
| Water bath | WSL, Swietochlowice, Poland | LWT | |
| Specimen mounting for SBEM | |||
| 96-well culture plate | VWR, Radnor, PA, USA | 734-2782 | 96-well plates, round bottom, non treated |
| AM Gatan 3View stub handling tweezers | Micro to Nano, Haarlem, Netherlands Netherlands |
50-001521 | |
| Binocular | OPTA-TECH, Warsaw, Poland | X2000 | |
| Conductive glue | Chemtronics, Georgia, USA | CW2400 | conductive eopxy |
| Gatan 3View sample pin stubs | Micro to Nano, Haarlem, Netherlands Netherlands |
10-006003 | |
| Parafilm | Sigma-Aldrich,St. Louis, MI, USA | P7793 | roll size 20 in. × 50 ft |
| Pelco conductive silver paint | Ted Pella, Redding, CA, USA | 16062-15 | PELCO® Conductive Silver Paint, 15g |
| Razor blades double edge | Electron Microscopy Sciences, Hatfield, PA, USA | 72000 | Stainless Steel "PTFE" coated. PERSONNA brand .004" thick, wrapped individually, 250 blades in a box. |
| Scanning Electron Microscope | Zeiss, Oberkochen, Germany | Sigma VP with Gatan 3View2 chamber, acceleration voltage 2.5 kV, variable pressure 5 Pa, aperture 20 µm, dwell time 6 µs, slice thickness 60 nm, magnification 15 000 x, image resolution 2048 x 2048 pixels, pixel size 7.3 nm | |
| trim 90° diamond knife | Diatome Ltd., Nidau, Switzerland | DTB90 | |
| Ultramicrotome | Leica Microsystems, Vienna, Austria | Leica ultracutR | |
| Software | webpage | tutorials | |
| FijiJ | https://fiji.sc/ | ||
| Microscopy Image Browser | http://mib.helsinki.fi/ | http://mib.helsinki.fi/tutorials.html | |
| Reconstruct | https://synapseweb.clm.utexas.edu/software-0 | https://synapseweb.clm.utexas.edu/software-0) | |
| Animals | |||
| Mice | Adult 3-month old and 20±1 month old female Thy1-GFP(M) mice (Thy1-GFP +/-) (Feng et al.,2000) which express GFP in a sparsely distributed population of glutamatergic neurons. Animals were bred as heterozygotes with the C57BL/6J background in the Animal House of the Nencki Institute of Experimental Biology. |
References
- Bosch, M., Hayashi, Y. Structural plasticity dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Borczyk, M., Radwanska, K., Giese, K. P. The importance of ultrastructural analysis of memory. Brain Research Bulletin. 173, 28-36 (2021).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience: challenges of SBEM in neuroscience. Journal of Microscopy. 259 (2), 137-142 (2015).
- Śliwińska, M. A., et al. Long-term Memory Upscales Volume of Postsynaptic Densities in the Process that Requires Autophosphorylation of αCaMKII. Cerebral Cortex. 30 (4), 2573-2585 (2020).
- Borczyk, M., Śliwińska, M. A., Caly, A., Bernas, T., Radwanska, K. Neuronal plasticity affects correlation between the size of dendritic spine and its postsynaptic density. Scientific Reports. 9 (1), 1693 (2019).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM – a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial Block-Face Scanning Electron Microscopy to Reconstruct Three-Dimensional Tissue Nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue and Cell. 57, 111-122 (2019).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure: Volume scanning electron microscopy. Biology of the Cell. 108 (11), 307-323 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. . NCMIR methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. , 6-8 (2010).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry & Cytochemistry. 32 (4), 455-460 (1984).
- Feng, G., et al. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2004).
- Walton, J. Lead aspartate, an en bloc contrast stain particularly useful for ultrastructural enzymology. Journal of Histochemistry & Cytochemistry. 27 (10), 1337-1342 (1979).
- Mercer, E. H. a scheme for section staining in electron microscopy. Journal of the Royal Microscopical Society. 81 (3-4), 179-186 (1963).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218 (1), 52-61 (2005).
- Roels, J., et al. An interactive ImageJ plugin for semi-automated image denoising in electron microscopy. Nature Communications. 11 (1), 771 (2020).
- Radwanska, K., et al. Mechanism for long-term memory formation when synaptic strengthening is impaired. Proceedings of the National Academy of Sciences. 108 (45), 18471-18475 (2011).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems: SBFSEM Methods for Plant Cells. Journal of Microscopy. 263 (2), 200-211 (2016).
- Fendrych, M., et al. Programmed Cell Death Controlled by ANAC033/SOMBRERO Determines Root Cap Organ Size in Arabidopsis. Current Biology. 24 (9), 931-940 (2014).
- Russell, M. R. G., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Płachno, B. J., Świątek, P., Jobson, R. W., Małota, K., Brutkowski, W. Serial block face SEM visualization of unusual plant nuclear tubular extensions in a carnivorous plant (Utricularia, Lentibulariaceae). Annals of Botany. 120 (5), 673-680 (2017).
- Genoud, C., Titze, B., Graff-Meyer, A., Friedrich, R. W. Fast Homogeneous En Bloc Staining of Large Tissue Samples for Volume Electron Microscopy. Frontiers in Neuroanatomy. 12, (2018).
- Puhka, M., Joensuu, M., Vihinen, H., Belevich, I., Jokitalo, E. Progressive sheet-to-tubule transformation is a general mechanism for endoplasmic reticulum partitioning in dividing mammalian cells. Molecular Biology of the Cell. 23 (13), 2424-2432 (2012).
- Gluenz, E., Wheeler, R. J., Hughes, L., Vaughan, S. Scanning and three-dimensional electron microscopy methods for the study of Trypanosoma brucei and Leishmania mexicana flagella. Methods in Cell Biology. 127, 509-542 (2015).
- Starborg, T., et al. Using transmission electron microscopy and 3View to determine collagen fibril size and three-dimensional organization. Nature Protocols. 8 (7), 1433-1448 (2013).
- Hughes, L., Borrett, S., Towers, K., Starborg, T., Vaughan, S. Patterns of organelle ontogeny through a cell cycle revealed by whole-cell reconstructions using 3D electron microscopy. Journal of Cell Science. 130 (3), 637-647 (2017).
- Bojko, A., et al. Improved Autophagic Flux in Escapers from Doxorubicin-Induced Senescence/Polyploidy of Breast Cancer Cells. International Journal of Molecular Sciences. 21 (17), 6084 (2020).
- Knott, G. W., Holtmaat, A., Trachtenberg, J. T., Svoboda, K., Welker, E. A protocol for preparing GFP-labeled neurons previously imaged in vivo and in slice preparations for light and electron microscopic analysis. Nature Protocols. 4 (8), 1145-1156 (2009).
- Glauert, A. M., Lewis, P. R. . Biological specimen preparation for transmission electron microscopy. , (2014).
- Genoud, C. Altered Synapse Formation in the Adult Somatosensory Cortex of Brain-Derived Neurotrophic Factor Heterozygote Mice. Journal of Neuroscience. 24 (10), 2394-2400 (2004).

