6.5:
Quantificação do Trabalho
16,255 Views
•
•
À medida que um sistema sofre uma alteração, a sua energia interna pode mudar, e a energia pode ser transferida do sistema para as imediações ou das imediações para o sistema.
A transferência de energia ocorre através do calor e do trabalho. A relação entre energia interna, calor, e trabalho é representada pela equação:
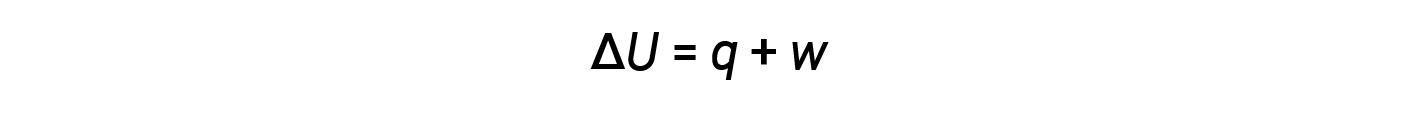
Enquanto que o calor é uma função de uma alteração de temperatura observada, o trabalho é uma função de uma alteração de volume observada chamada trabalho de pressão-volume. O trabalho (w) pode ser definido como uma força (F) que age ao longo de uma distância (D).
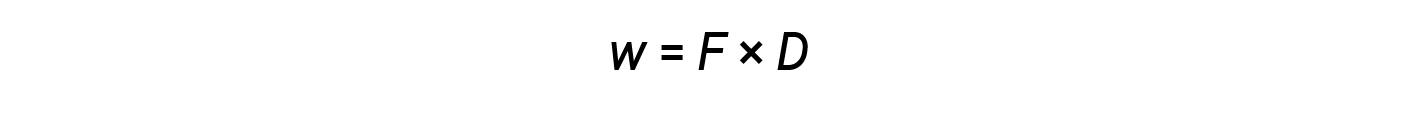
O trabalho de pressão-volume (ou trabalho de expansão) ocorre quando um sistema empurra as imediações para trás contra uma pressão de retenção, ou quando as imediações comprimem o sistema. Um exemplo disto ocorre durante o funcionamento de um motor de combustão interna. A reação de combustão da gasolina e do oxigénio é exotérmica. Alguma desta energia é obtida como calor, e alguma é executada como trabalho expandindo os gases no cilindro, empurrando assim o pistão para fora. As substâncias envolvidas na reação são o sistema, e o motor e o resto do universo são as imediações. O sistema perde energia tanto pelo aquecimento como pelo trabalho para as imediações, e a sua energia interna diminui.
Quando o volume de um cilindro aumenta (ou seja, o gás expande), ele empurra contra uma força externa, que é a pressão definida como força por área da unidade.
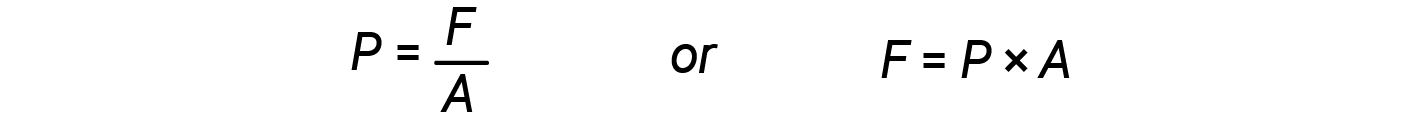
A partir das equações 2 e 3:
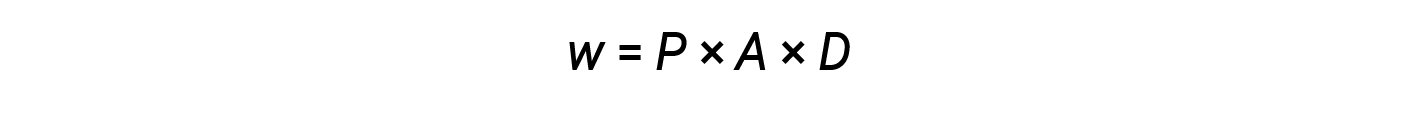
O produto da área e da distância (A × D) é igual à alteração do volume (ΔV) do gás no cilindro.
Portanto,

Como o volume aumenta durante a expansão, Vfinal > Vinicial, e ΔV são positivos. No entanto, para uma expansão positiva (ou seja, quando o sistema realiza trabalho sobre as imediações), w deve ser negativo e, portanto, um sinal negativo é adicionado à equação.
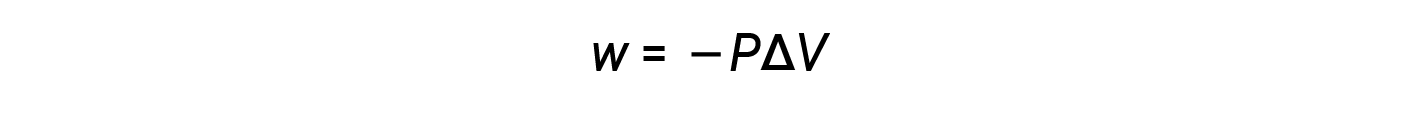
De acordo com esta equação, o trabalho de pressão-volume é o negativo da pressão externa (ou pressão oposta) multiplicado pela alteração de volume.
A unidade de trabalho baseada nesta equação é L·atm. Alguns outros factores de conversão úteis são:
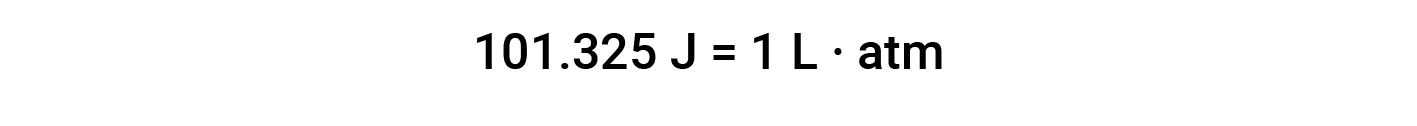
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.3: Enthalpy.
