5.2:
Leggi dei gas
58,534 Views
•
•
Attraverso esperimenti, gli scienziati hanno stabilito le relazioni matematiche tra coppie di variabili, come pressione e temperatura, pressione e volume, volume e temperatura, e volume e talpe, che contengono per un gas ideale.
Pressione e temperatura: legge di Gay-Lussac (legge di Amontons)
Immagina di riempire un contenitore rigido attaccato a un manometro con gas e quindi sigillare il contenitore in modo che nessun gas possa fuoriuscire. Se il contenitore viene raffreddato, anche il gas all’interno diventa più freddo e si osserva che la sua pressione diminuisce. Poiché il contenitore è rigido e ben sigillato, sia il volume che il numero di talpe di gas rimangono costanti. Se la sfera viene riscaldata, il gas all’interno diventa più caldo e la pressione aumenta.
Temperatura e pressione sono linearmente correlate, e questa relazione è osservata per qualsiasi campione di gas confinato ad un volume costante. Se la temperatura è sulla scala kelvin, allora P e T sono direttamente proporzionali (ancora una volta, quando il volume e le talpe di gas sono tenuti costanti); se la temperatura sulla scala kelvin aumenta di un certo fattore, la pressione del gas aumenta dello stesso fattore.
Questa relazione pressione-temperatura per i gas è nota come legge di Gay-Lussac. La legge afferma che la pressione di una data quantità di gas è direttamente proporzionale alla sua temperatura sulla scala kelvin quando il volume è tenuto costante. Matematicamente, questo può essere scritto come:

dove k è una costante di proporzionalità che dipende dall’identità, dalla quantità e dal volume del gas. Per un volume limitato e costante di gas, il rapporto P/Tè quindi costante (cioè, P/T = k). Se il gas è inizialmente a ‘Condizione 1’ (con P = P1 e T = T1), e cambia in ‘Condizione 2’ (con P = P2 e T = T2 ),allora
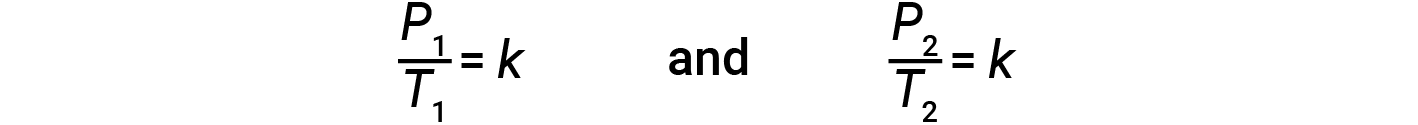
Quindi
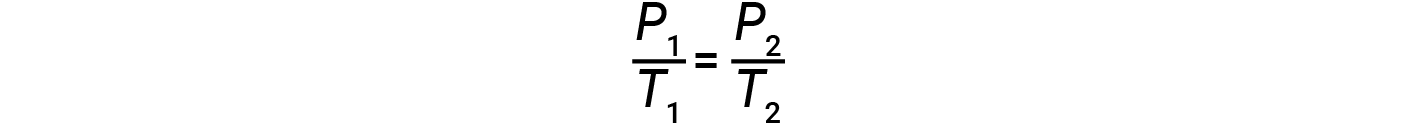
Si noti che per qualsiasi calcolo della legge sul gas, le temperature devono essere sulla scala kelvin.
Volume e temperatura: legge di Carlo
Se un palloncino viene riempito d’aria e sigillato, il palloncino contiene una quantità specifica di aria a pressione atmosferica (1 atm). Se il palloncino viene posto in frigorifero, il gas all’interno si raffredda e il palloncino si restringe (anche se sia la quantità di gas che la sua pressione rimangono costanti). Se il palloncino è fatto molto freddo, si restringerà molto. Quando viene riscaldato, il palloncino si espanderà di nuovo.
Questo è un esempio dell’effetto della temperatura sul volume di una data quantità di un gas confinato a pressione costante. Il volume aumenta all’aumentare della temperatura e il volume diminuisce man mano che la temperatura diminuisce.
La relazione tra il volume e la temperatura di una data quantità di gas a pressione costante è nota come legge di Carlo. La legge afferma che il volume di una data quantità di gas è direttamente proporzionale alla sua temperatura sulla scala kelvin quando la pressione è tenuta costante.
Matematicamente, questo può essere scritto come:
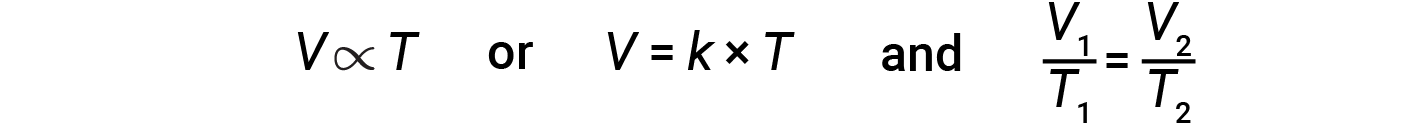
dove k è una costante di proporzionalità che dipende dalla quantità e dalla pressione del gas. Per un gas confinato a pressione costante, il rapporto V/Tè costante.
Volume e pressione: legge di Boyle
Se una siringa ermetica è parzialmente riempita d’aria, la siringa contiene una quantità specifica di aria a temperatura costante, ad esempio 25 °C. Se lo stantuffo viene premuto lentamente mentre la temperatura rimane costante, il gas nella siringa viene compresso in un volume inferiore e la sua pressione aumenta. Se lo stantuffo viene estratto, il volume del gas aumenta e la pressione diminuisce.
Diminuire il volume di un gas contenuto aumenterà la sua pressione e l’aumento del suo volume diminuirà la sua pressione. Se il volume aumenta di un certo fattore, la pressione diminuisce dello stesso fattore e viceversa. Pertanto, pressione e volume mostrano proporzionalità inversa: proporzionalità: l’aumento della pressione si traduce in una diminuzione del volume del gas. Matematicamente questo può essere scritto:
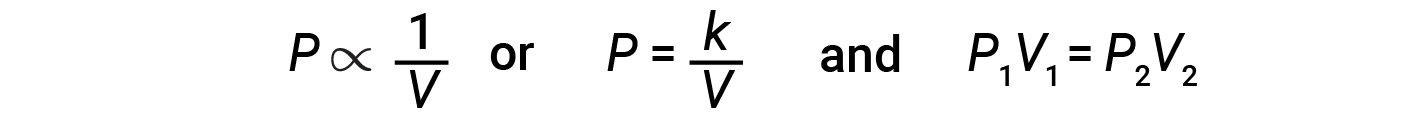
dove k è una costante. Un grafico di P contro V mostra un’iperbole. I grafici con linee curve sono difficili da leggere con precisione a valori bassi o alti delle variabili, e sono più difficili da usare nell’adattare equazioni teoriche e parametri a dati sperimentali. Per questi motivi, gli scienziati spesso cercano di trovare un modo per “linearizzare” i loro dati. Graficamente, la relazione tra pressione e volume è mostrata tracciando l’inverso della pressione rispetto al volume, o l’inverso del volume rispetto alla pressione.
La relazione tra il volume e la pressione di una data quantità di gas a temperatura costante è data dalla legge di Boyle: Il volume di una data quantità di gas trattenuto a temperatura costante è inversamente proporzionale alla pressione sotto la quale viene misurato.
Talpe di gas e volume: la legge di Avogadro
Lo scienziato italiano Amedeo Avogadro avanzò un’ipotesi nel 1811 per tenere conto del comportamento dei gas, affermando che volumi uguali di tutti i gas, misurati nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di molecole. Nel corso del tempo, questa relazione è stata supportata da molte osservazioni sperimentali espresse dalla legge di Avogadro: Per un gas confinato, il volume (V) e il numero di talpe (n) sono direttamente proporzionali se la pressione e la temperatura rimangono entrambe costanti.
In forma di equazione, questo è scritto come:
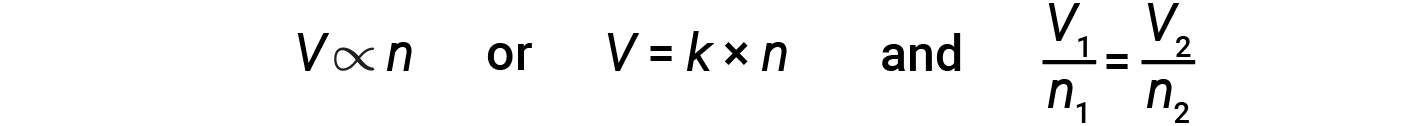
Le relazioni matematiche possono anche essere determinate per le altre coppie di variabili, ad esempio P contro ne n rispetto a T.
La legge sul gas ideale
Combinando queste quattro leggi si ottiene la legge del gas ideale, una relazione tra la pressione, il volume, la temperatura e il numero di talpe di un gas:
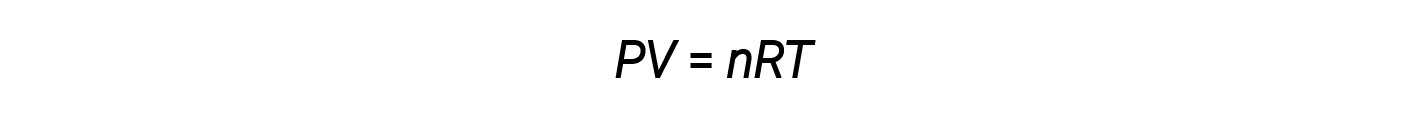
Qui, R è una costante chiamata costante di gas ideale o costante di gas universale. Le unità utilizzate per esprimere pressione, volume e temperatura determinano la forma corretta della costante di gas come richiesto dall’analisi dimensionale. I valori più comunemente incontrati di R sono 0,08206 L-atm mol–1-K–1 e 8.314 kPa-L mol–1-K–1.
Si dice che i gas le cui proprietà di P, Ve T siano accuratamente descritte dalla legge del gas ideale (o dalle altre leggi sul gas) mostrino un comportamento ideale o approssimano i tratti di un gas ideale. Un gas ideale è un costrutto ipotetico che è ragionevole solo per i gas in condizioni di pressione relativamente bassa e alta temperatura.
L’equazione del gas ideale contiene cinque termini, la costante di gas R e le proprietà variabili P, V, ne T. Specificare quattro di questi termini consentirà l’uso della legge sul gas ideale per calcolare il quinto termine.
Se il numero di talpe di un gas ideale è mantenuto costante in due diversi insiemi di condizioni, si ottiene un’utile relazione matematica chiamata legge del gas combinato (usando unità di atm, L e K):
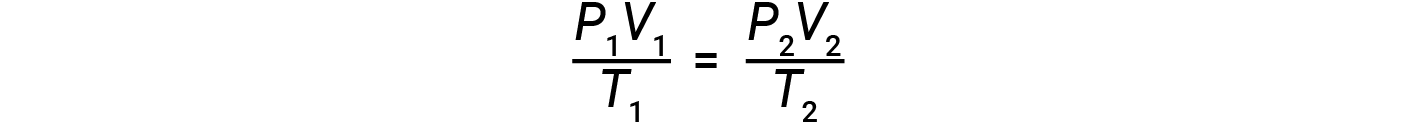
Entrambi gli insiemi di condizioni sono uguali al prodotto di n × R (dove n = il numero di talpe del gas e R è la costante ideale della legge sul gas).
Questo testo è adattato da Openstax, Chemistry 2e, Section 9.2: Relating Pressure, Volume, Amount, and Temperature: The Ideal Gas Law.
