16.8:
Indicadores
38,895 Views
•
•
Algumas substâncias orgânicas mudam de cor em solução diluída quando a concentração de iões hidrónio atinge um valor específico. Por exemplo, a fenolftaleína é uma substância incolor em qualquer solução aquosa com uma concentração de iões hidrónio superior a 5,0 × 10−9 M (pH < 8,3). Em soluções mais básicas, em que a concentração de iões hidrónio é inferior a 5,0 × 10−9 M (pH > 8,33), é vermelha ou rosa. Substâncias como a fenolftaleína, que pode ser utilizada para determinar o pH de uma solução, são designadas por indicadores ácido-base. Os indicadores ácido-base são ácidos orgânicos fracos ou bases orgânicas fracas.
O equilíbrio em uma solução de indicador ácido-base de laranja metilo, um ácido fraco, pode ser representado por uma equação na qual utilizamos HIn como uma representação simples para a molécula complexa de laranja metilo:
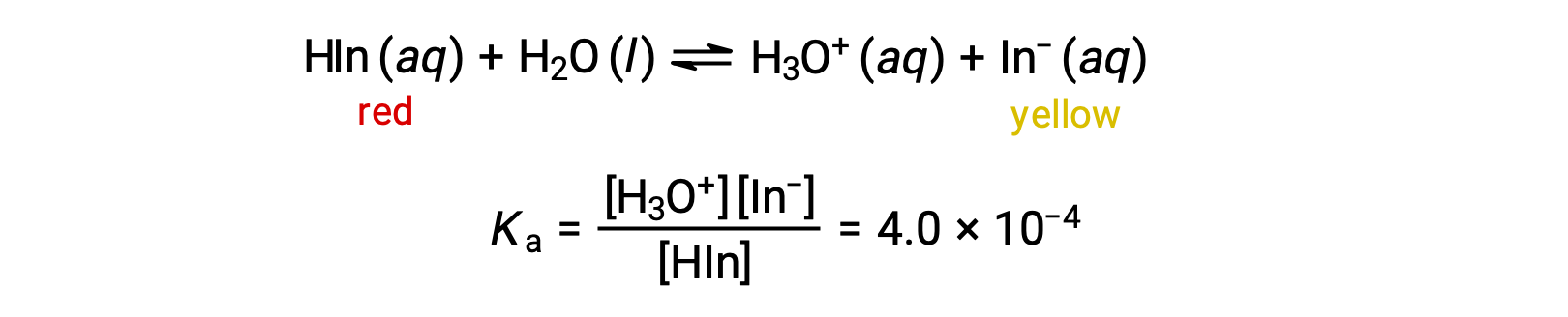
O anião de laranja de metilo, In−, é amarelo, e a forma não ionizada, HIn, é vermelha. Quando adicionamos ácido a uma solução de laranja de metilo, o aumento da concentração de iões hidrónio desloca o equilíbrio para a forma vermelha não ionizada, de acordo com o princípio de Le Châtelier. Se adicionarmos uma base, mudamos o equilíbrio em direção à forma amarela. Esse comportamento é completamente análogo à ação dos tampões.
A cor percebida de uma solução indicadora é determinada pela razão das concentrações das duas espécies In− e HIn. Se a maioria do indicador (normalmente cerca de 60−90% ou mais) estiver presente como In−, a cor perceptível da solução será amarela. Se a maioria estiver presente como HIn, a cor da solução aparecerá vermelha. A equação de Henderson-Hasselbalch é útil para entender a relação entre o pH de uma solução indicadora e a sua composição (e assim, a cor percebida):
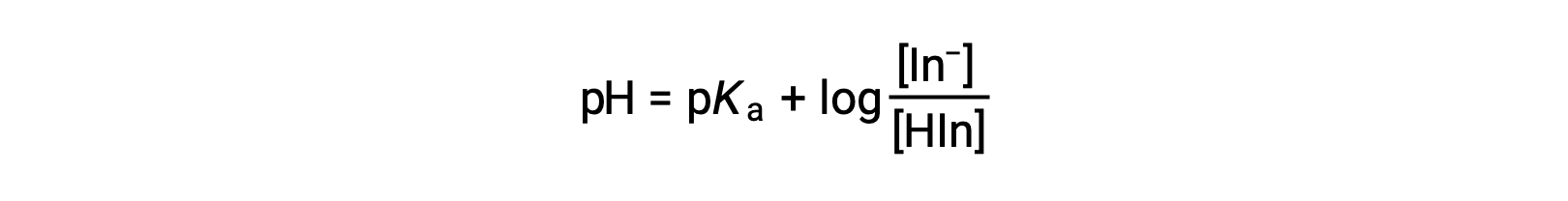
Em soluções em que pH > pKa, o termo logarítmico deve ser positivo, indicando um excesso da forma de base conjugada do indicador (solução amarela). Quando pH > pKa, o termo log deve ser negativo, indicando um excesso do ácido conjugado (solução vermelha). Quando o pH da solução está próximo do indicador pKa, quantidades apreciáveis de ambos os pares conjugados estão presentes, e a cor da solução é a de uma combinação aditiva de cada um (amarelo e vermelho, produzindo laranja). O intervalo de mudança de cor (ou intervalo de pH) para um indicador de ácido-base é definido como a gama de valores de pH sobre os quais é observada uma alteração de cor e, para a maioria dos indicadores, esta gama é de aproximadamente pKa ± 1.
Existem muitos indicadores de ácido-base diferentes que abrangem uma vasta gama de valores de pH e que podem ser utilizados para determinar o pH aproximado de uma solução desconhecida através do processo de eliminação. Os indicadores universais e o papel de pH contêm uma mistura de indicadores e apresentam cores diferentes em pHs diferentes.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.7: Acid-Base Titrations.
