16.8:
Indicateurs de pH
38,893 Views
•
•
Certaines substances organiques changent de couleur dans une solution diluée lorsque la concentration en ions hydronium atteint une valeur particulière. Par exemple, la phénolphtaléine est une substance incolore dans toute solution aqueuse dont la concentration en ions hydronium est supérieure à 5,0 × 10−9 M (pH < 8,3). Dans les solutions plus basiques où la concentration en ions hydronium est inférieure à 5,0 × 10−9 M (pH > 8,3), elle est rouge ou rose. Les substances telles que la phénolphtaléine, qui peuvent être utilisées pour déterminer le pH d’une solution, sont appelées des indicateurs acido-basiques. Les indicateurs acido-basiques sont soit des acides organiques faibles, soit des bases organiques faibles.
L’équilibre dans une solution de l’indicateur acido-basique hélianthine, un acide faible, peut être représenté par une équation dans laquelle nous utilisons HIn comme représentation simple pour la molécule complexe d’hélianthine :
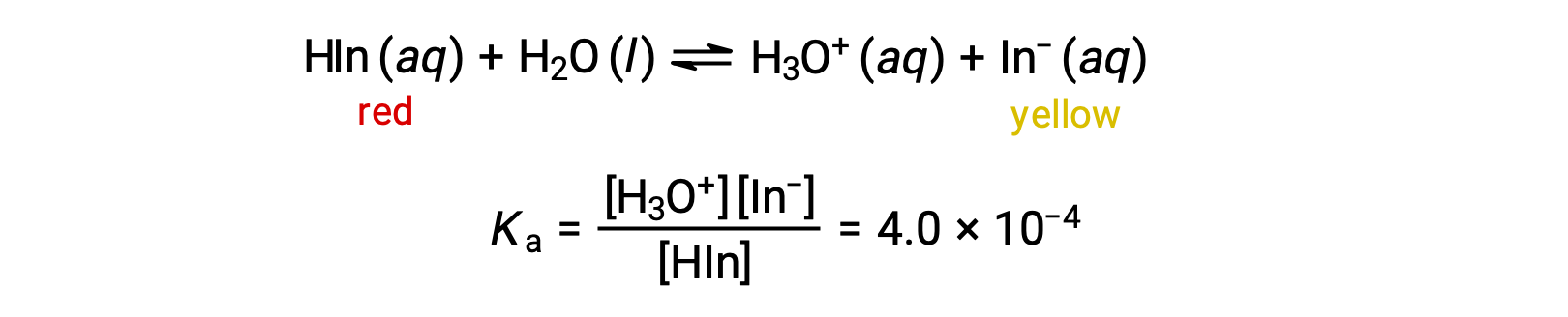
L’anion de l’hélianthine, In−, est jaune et la forme non ionisée, HIn, est rouge. Lorsque nous ajoutons de l’acide à une solution d’hélianthine, la concentration accrue d’ions hydronium déplace l’équilibre vers la forme rouge non ionisée, conformément au principe de Le Châtelier. Si nous ajoutons de la base, nous décalons l’équilibre vers la forme jaune. Ce comportement est totalement analogue à l’action des tampons.
La couleur perçue d’une solution d’indicateur est déterminée par le rapport des concentrations des deux espèces In− et HIn. Si la majeure partie de l’indicateur (généralement environ 60−90% ou plus) est présente en tant que In−, la couleur perçue de la solution est jaune. Si la plus grande partie est présente en tant que HIn, la couleur de la solution paraît rouge. L’équation de Henderson-Hasselbalch est utile pour comprendre la relation entre le pH d’une solution d’indicateur et sa composition (ainsi, la couleur perçue) :
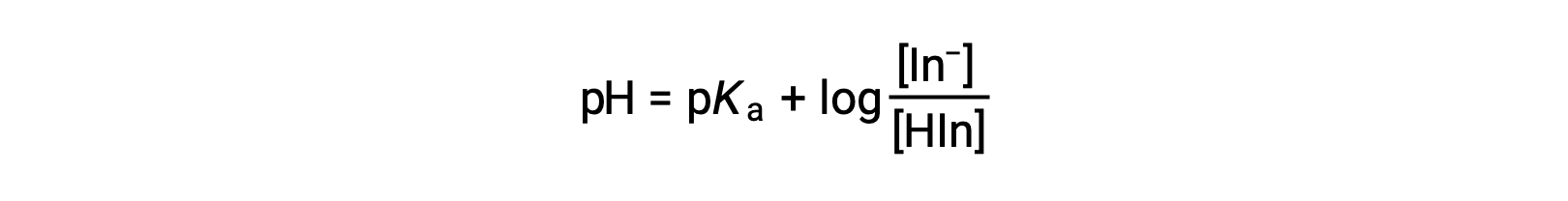
Dans les solutions où pH > pKa, le terme logarithmique doit être positif, indiquant un excès sous la forme de la base conjuguée de l’indicateur (solution jaune). Lorsque pH > pKa, le terme log doit être négatif, indiquant un excès d’acide conjugué (solution rouge). Lorsque le pH de la solution est proche du pKa de l’indicateur, des quantités notables des deux partenaires conjugués sont présentes, et la couleur de la solution est celle d’une combinaison d’addition de chacun (jaune et rouge, produisant de l’orange). L’intervalle du changement de couleur (ou intervalle de pH) d’un indicateur acido-basique est défini comme la plage de valeurs de pH sur laquelle un changement de couleur est observé, et pour la plupart des indicateurs, cette plage est d’environ pKa ± 1.
Il existe de nombreux indicateurs acido-basiques différents qui couvrent une large gamme de valeurs de pH et peuvent être utilisés pour déterminer le pH approximatif d’une solution inconnue par processus d’élimination. Les indicateurs universels et le papier pH contiennent un mélange d’indicateurs et présentent différentes couleurs à différents pH.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.7 : Titrages acido-basiques.
