16.4:
Cálculo de Alterações de pH em uma Solução Tampão
16.4:
Cálculo de Alterações de pH em uma Solução Tampão
Um tampão pode evitar uma queda ou um aumento súbito do pH de uma solução após a adição de um ácido ou base forte até à sua capacidade de tamponamento; no entanto, tal adição de um ácido ou base forte resulta em uma ligeira alteração do pH da solução. A pequena alteração do pH pode ser calculada através da determinação da alteração resultante na concentração dos componentes tampão, ou seja, um ácido fraco e a sua base conjugada ou vice-versa. As concentrações obtidas por meio desses cálculos estequiométricos podem ser utilizadas para determinar o pH final da solução usando a equação de Henderson-Hasselbalch ou uma tabela ICE.
Por exemplo, uma solução tampão contém 0,65 mol de ácido fórmico e formato de sódio. Como a concentração do ácido fraco e da sua base conjugada é a mesma aqui, o pH da solução é igual à pKa do ácido fraco, que é 3,74 neste caso. Se 0,05 mol de HNO3 forem adicionados à solução, as alterações resultantes na concentração do ácido fórmico e do formato de sódio podem ser determinadas através de cálculos estequiométricos, conforme indicado na tabela abaixo.
| H+ (aq) | HCOO− (aq) | HCOOH (aq) | |
| Antes da adição (M) | ~0,00 mol | 0,65 mol | 0,65 mol |
| Adição (M) | 0,050 mol | – | – |
| Após a adição (M) | ~0,00 mol | 0,60 mol | 0,70 mol |
O pH final da solução pode então ser determinado conectando concentrações alteradas de ácido fórmico e de formato de sódio na equação de Henderson-Hasselbalch.
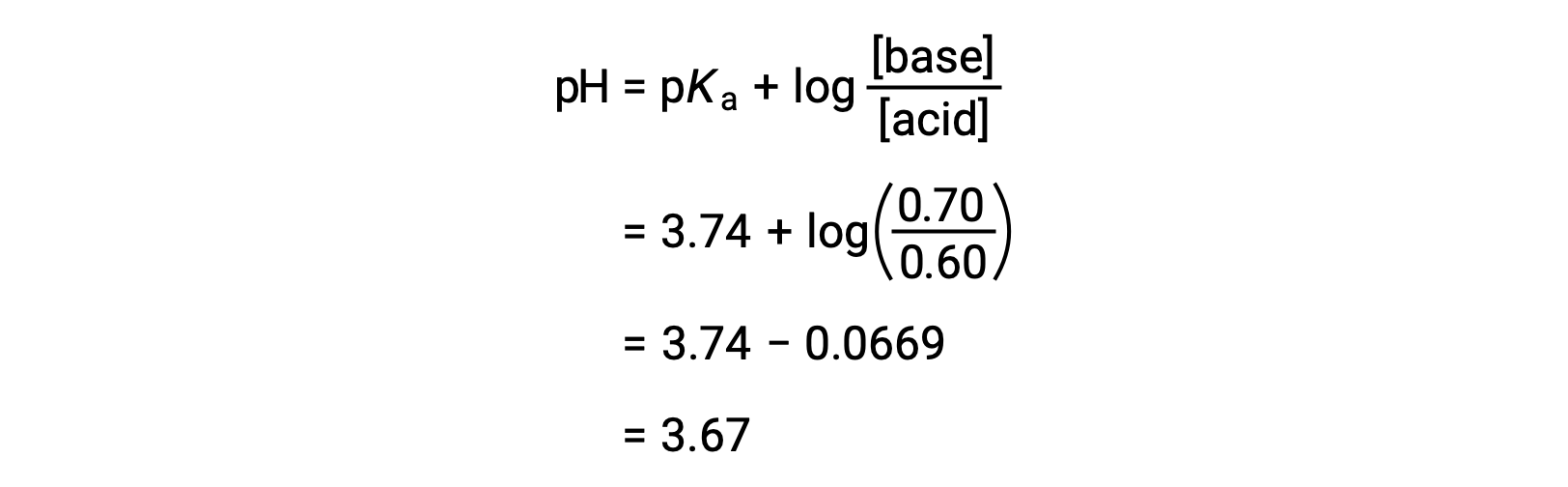
Assim, a adição de 0,05 mol de HNO3 reduz o pH da solução de 3,74 para 3,67.
Da mesma forma, se 0,10 mol de NaOH forem adicionados à mesma solução, as alterações resultantes na concentração do ácido fórmico e do formato de sódio podem ser determinadas por cálculos estequiométricos, conforme indicado na tabela abaixo.
| OH− (aq) | HCOOH (aq) | HCOO− (aq) | H2O (l) | |
| Antes da adição (M) | ~0,00 mol | 0,65 mol | 0,65 mol | - |
| Adição (M) | 0,10 mol | – | – | - |
| Após a adição (M) | ~0,00 mol | 0,55 mol | 0,75 mol | - |
O pH final da solução pode então ser determinado conectando concentrações alteradas de ácido fórmico e de formato de sódio na equação de Henderson-Hasselbalch.
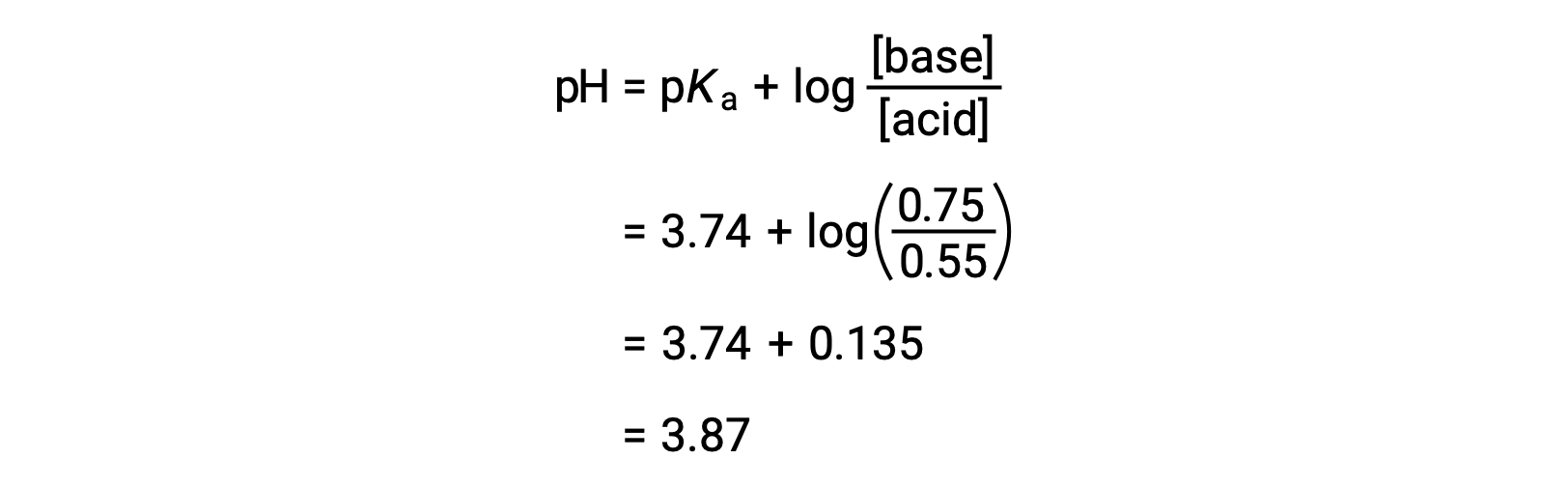
Assim, a adição de 0.10 mol de NaOH aumenta o pH da solução de 3,74 para 3,87.
