15.10:
酸・塩基性イオン
15.10:
酸・塩基性イオン
酸性イオンの塩
塩は陽イオンと陰イオンからなるイオン性化合物で、陽イオンと陰イオンは水との間で酸または塩基を生成する電離反応を起こすことができます。そのため、塩の水溶液は、構成するイオンの酸塩基の強さの違いにより、酸性、塩基性、中性のいずれかになります。例えば、塩化アンモニウムを水に溶かすと、次の式で表されるように電離します。
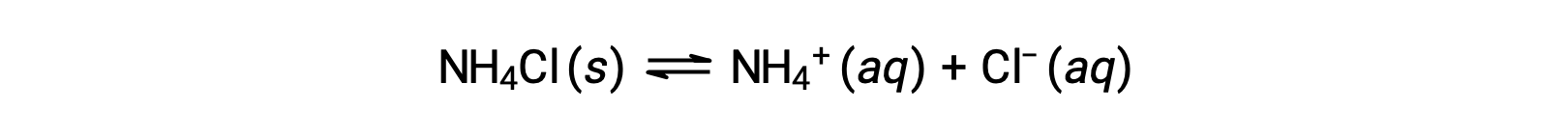
アンモニウムイオンは、塩基であるアンモニア(NH3)の共役酸であり、その酸性イオン化(または酸性となる加水分解)反応は次のように表されます。
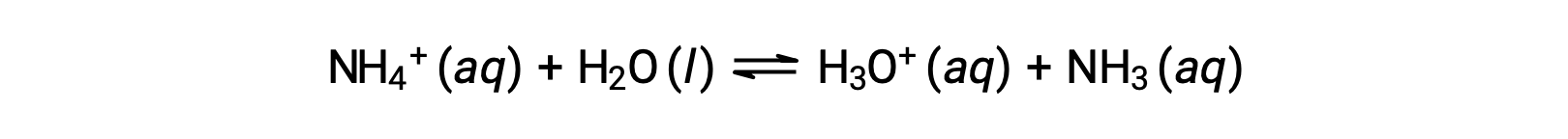
アンモニアは弱塩基であるため、Kbは測定可能であり、Ka > 0(アンモニウムイオンは弱酸性)となります。
塩化物イオンは塩酸の共役塩基であるため、その塩基性イオン化(または塩基性となる加水分解)反応は次のように表されます。
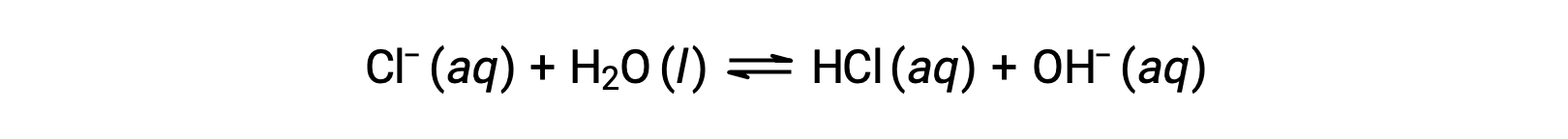
塩酸は強酸なので、Kaは計り知れないほど大きく、Kb ≈0(塩化物イオンは評価できるほど加水分解されない)となります。したがって、塩化アンモニウムを水に溶かすと、弱酸性の陽イオン(NH4+)と不活性陰イオン(Cl−)の溶液となり、結果として酸性の溶液となります。
塩基性イオンの塩
別の例として、酢酸ナトリウムを水に溶かすことを考えます。
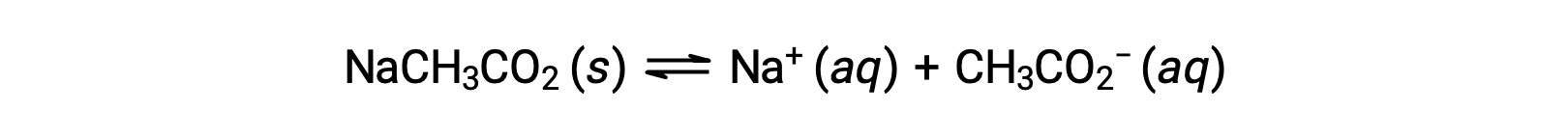
ナトリウムイオンは、酸性や塩基性のイオン化をほとんど起こさず、溶液のpHに影響を与えません。このことは、水素や酸素を含まないイオン式からも明らかですが、後述するように、溶存する金属イオンの中には弱酸性のものもあります。酢酸イオン(CH3CO2−)は、酢酸(CH3CO2H)の共役塩基であるため、塩基性イオン化(または塩基性となる加水分解)反応は次のように表されます。
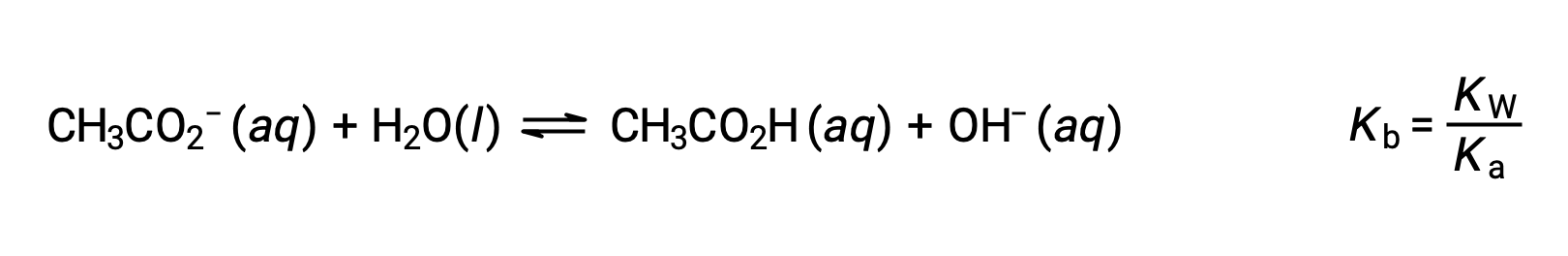
酢酸は弱酸であるため、そのKaは測定可能であり、Kb > 0(酢酸イオンは弱塩基)です。酢酸ナトリウムを水に溶かすと、不活性陽イオン(Na+)と弱塩基性の陰イオン(CH3CO2−)の溶液が得られ、塩基性溶液となります。
酸性イオンと塩基性イオンの塩
塩の中には、酸性イオンと塩基性イオンの両方から構成されているものがあり、その溶液のpHは、この2つの種の相対的な強さに依存します。このような塩の場合、KaとKbの値を比較することで、溶液の酸塩基状態を予測することができます。
水和金属イオンの電離について
先に挙げた例のI族やII族の金属イオン(Na+、Ca2+など)とは異なり、水溶液中で酸として機能する金属イオンもあります。これらのイオンは、溶解したときに水分子にゆるやかに溶けるだけではなく、一定数の水分子と共有結合して複合イオン化する(配位化学の章を参照)。例として、硝酸アルミニウムの水への溶解は、通常、次のように表されます。

しかし、アルミニウム(III)イオンは、実際には6つの水分子と反応して安定した複合イオンを形成するため、溶解プロセスをより明確に表すと次のようになります。
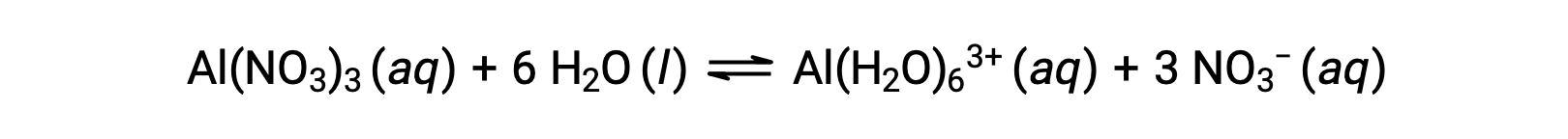
Al(H2O)63+イオンは、中心のAl原子と6つの水分子のO原子との間の結合を含んでいます。その結果、結合している水分子のO-H結合は、結合していない水分子よりも極性が高くなり、水素イオンが供給されやすくなります。
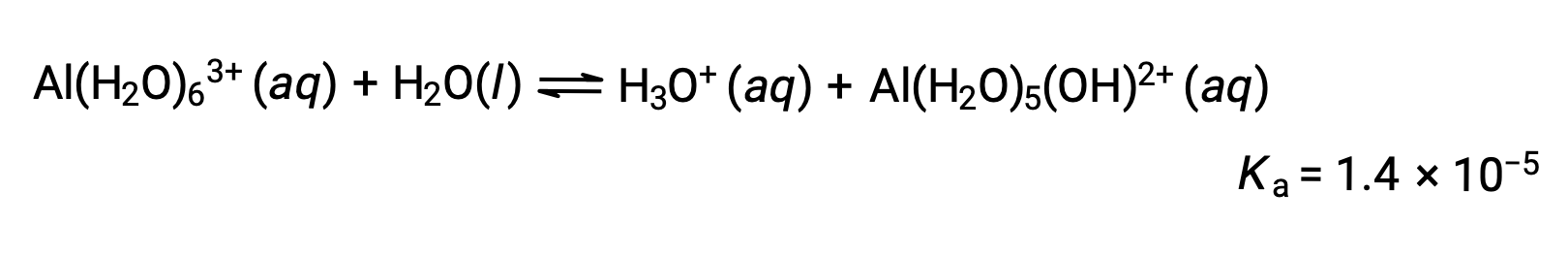
この過程で生成される共役塩基には、酸として働くことのできる5つの結合した水分子が含まれているため、以下のいくつかの式で示されるように、水素イオンの連続的または段階的な移動が可能です。
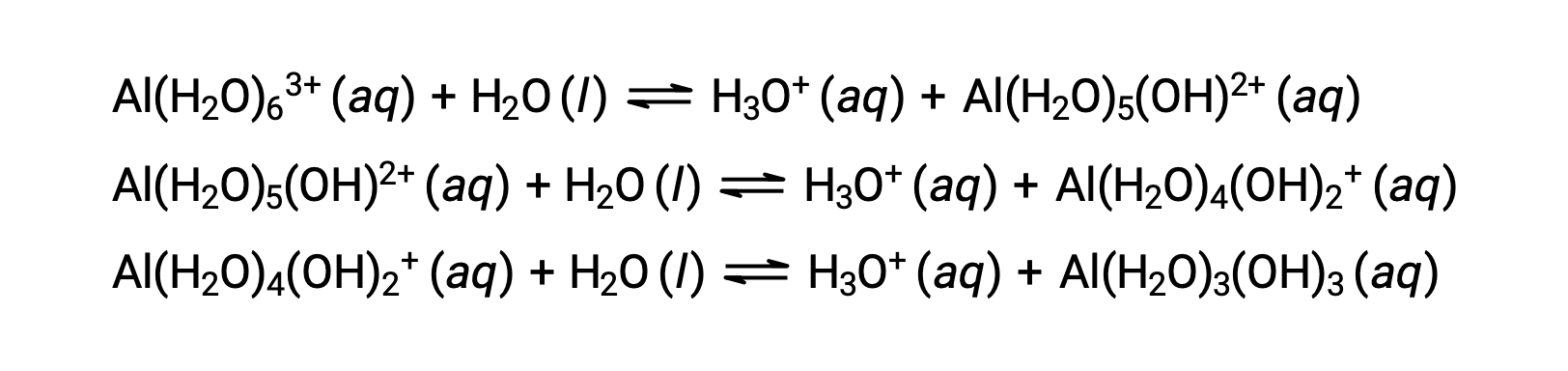
アルカリ金属(I族)と一部のアルカリ土類金属(II族)を除き、他のほとんどの金属イオンは、水に溶解するとある程度の酸性イオン化を起こす。これらの錯イオンの酸強度は、一般的に金属イオンの電荷の増加とサイズの減少に伴って増加します。他のいくつかの酸性金属イオンの第1段階の酸性イオン化式を以下に示します。
| First-step Ionization Equations | pKa |
| Fe(H2O)63+ (aq) + H2O (l) ⇌ H3O+ (aq) + Fe(H2O)5(OH)2+ (aq) | 2.74 |
| Cu(H2O)62+ (aq) + H2O (l) ⇌ H3O+ (aq) + Cu(H2O)5(OH)+ (aq) | ~6.3 |
| Zn(H2O)42+ (aq) + H2O (l) ⇌ H3O+ (aq) + Zn(H2O)3(OH)+ (aq) | 9.6 |
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.4: Hydrolysis of Salts.
