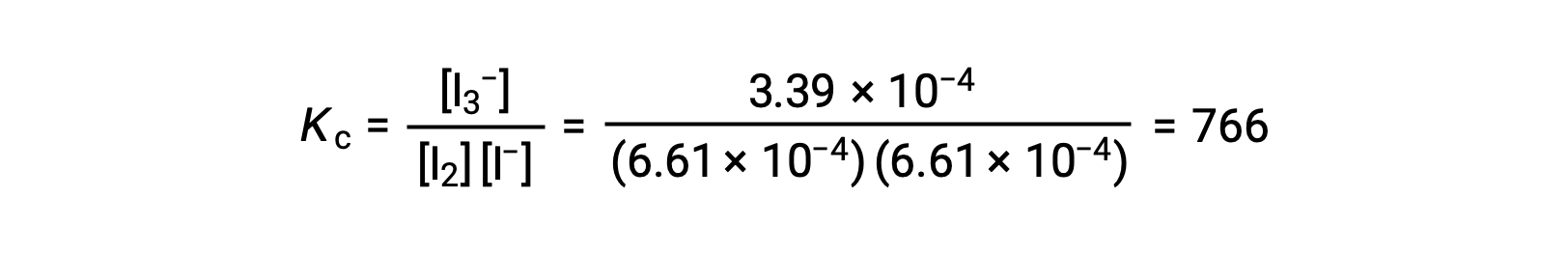14.4:
평형상수 계산
25,488 Views
•
•
반응에 대한 평형 상수는 반응및 제품의 평형 농도(또는 압력)로부터 계산됩니다. 이러한 농도가 알려진 경우 계산에는 Kc 식으로 대체됩니다.
예를 들어, 이 방정식에 따라 기체 이산화질소는 이산화질소를 형성합니다.
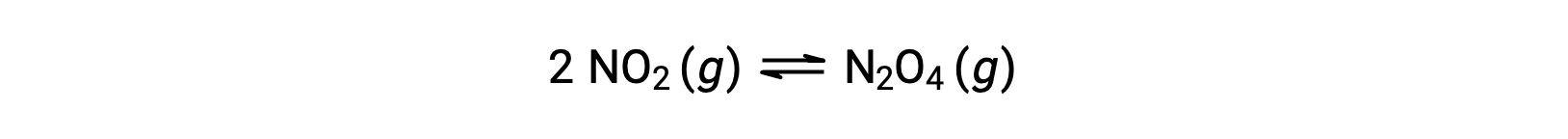
0.10 mol NO2가 25°C에서 1.0-L 플라스크에 첨가되면 평형에서 [NO2]= 0.016 M 및 [N2O4]= 0.042 M의 농도가 변화한다. 반응에 대한 평형 상수의 값은 다음과 같이 계산될 수 있다.
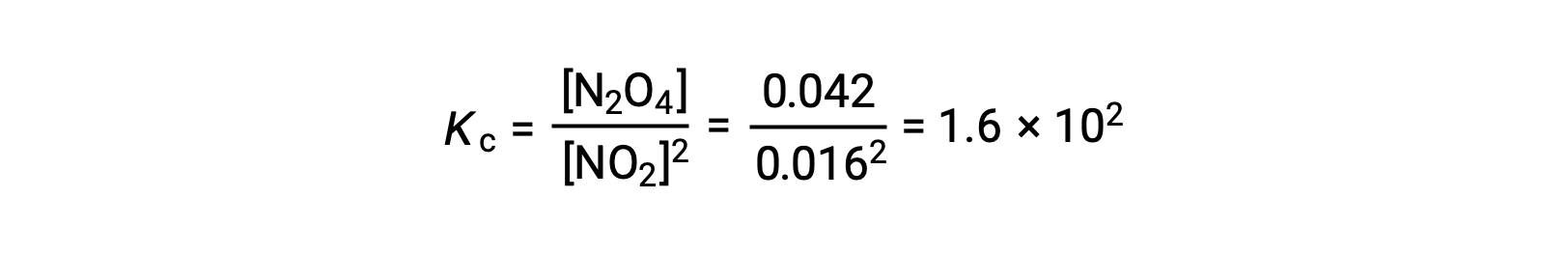
약간 더 도전적인 예는 다음에 제공되며, 반응 스토이치오메트리가 제공된 정보로부터 평형 농도를 도출하는 데 사용된다. 이 계산의 기본 전략은 많은 유형의 평형 계산에 도움이 되며 반응이 진행됨에 따라 어떻게 변화하는지, 시스템이 평형에 도달할 때 어떤 반응을 보이는지에 대해 처음에 존재하는 반응및 제품 농도에 대한 용어 사용에 의존합니다. 약어 ICE는 일반적으로 이 수학 적인 접근 방식을 참조 하는 데 사용 됩니다., 그리고 농도 용어는 일반적으로 ICE 테이블 라는 표 형식으로 수집.
평형 상수 계산
요오드 분자는 요오드 이온과 가역적으로 반응하여 트리오디드 이온을 생성합니다.
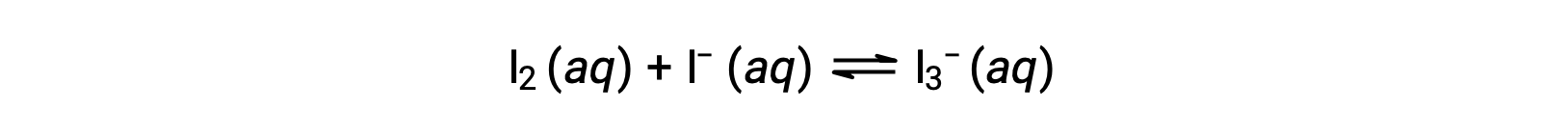
I2와 I의 농도와 솔루션 – 반응 전에 1.000 × 10-3 M과 동일한 모두 6.61 × 10-4 M의 I2의 평형 농도를 제공합니다, 반응에 대한 평형 상수는 무엇입니까?
평형 상수를 계산하려면 모든 반응제 및 제품에 평형 농도가 필요합니다.
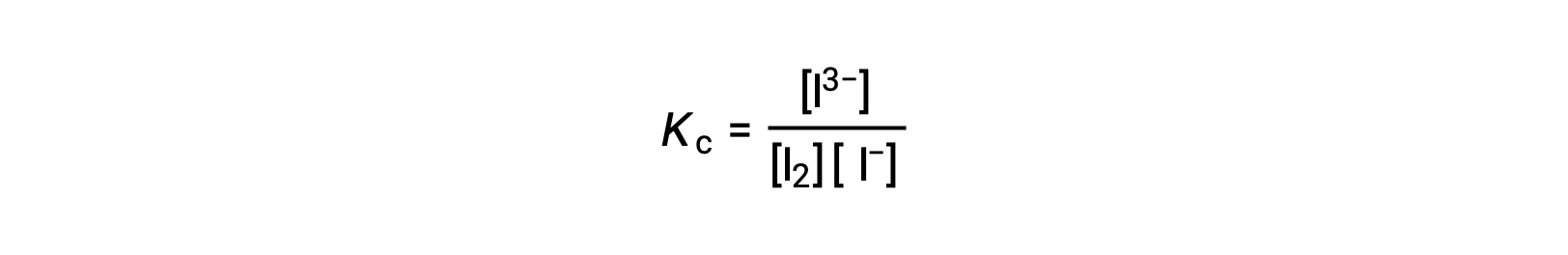
재반응제의 초기 농도와 제품의 평형 농도가 제공된다. 이 정보는 반응제의 평형 농도에 대한 용어를 도출하는 데 사용할 수 있으며, ICE 테이블에 모든 정보를 제시한다.
| I2 (아크) | I– (아크) | I3– (아크) | |
| 초기 농도(M) | 1.000 × 10-3 | 1.000 × 10-3 | 0 |
| 변경(M) | -x | -x | +x |
| 평형 농도 (M) | 1.000 × 10-3 – x | 1.000 × 10-3 – x | Ⅹ |
평형에서 I2의 농도는 6.61 × 10-4 M이므로
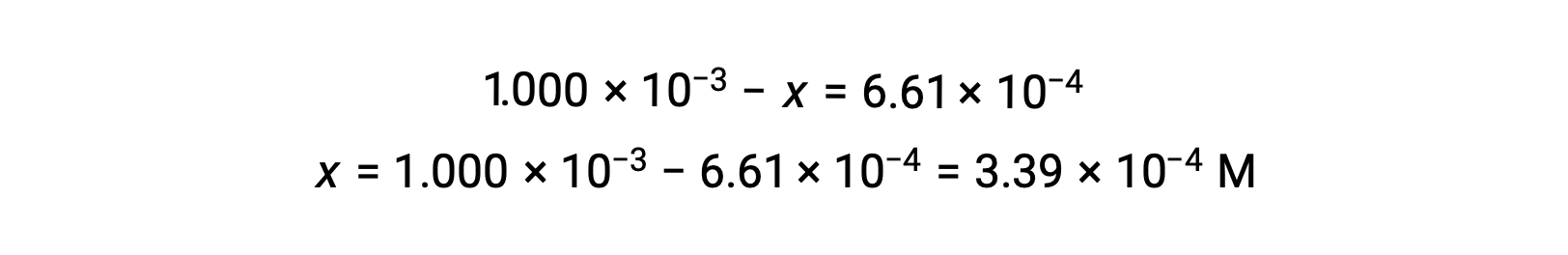
이제 ICE 테이블은 모든 농도에 대한 숫자 값으로 업데이트될 수 있습니다.
| I2 (아크) | I– (아크) | I3– (아크) | |
| 초기 농도(M) | 1.000 × 10-3 | 1.000 × 10-3 | 0 |
| 변경(M) | -3.39 × 10-4 | -3.39 × 10-4 | +3.39 × 10-4 |
| 평형 농도 (M) | 6.61 × 10-4 | 6.61 × 10-4 | 3.39 × 10-4 |
마지막으로 평형 농도는 Kc 표현식으로 대체되어 해결될 수 있습니다.