17.5:
Changement d'entropie standard pour une réaction
17.5:
Changement d'entropie standard pour une réaction
L’entropie est une fonction d’état, de sorte que la variation d’entropie standard pour une réaction chimique (ΔS°R) peut être calculée à partir de la différence d’entropie standard entre les produits et les réactifs.
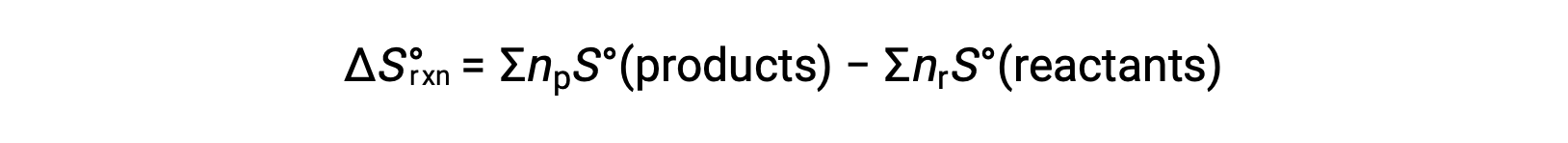
où np et nr représentent respectivement les coefficients stœchiométriques des produits et des réactifs dans l’équation équilibrée.
Par exemple, ΔS°R pour la réaction suivante à température ambiante
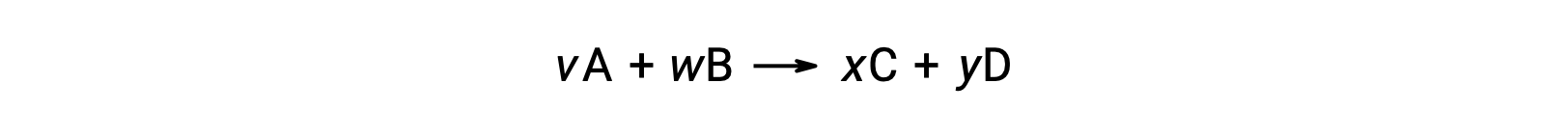
est calculé comme suit :
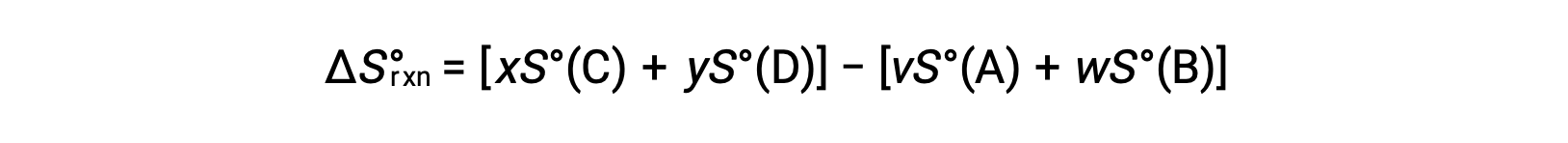
Une liste partielle des entropies standard est fournie dans le tableau.
| Substance | S° (J/mol·K) |
| C (s, graphite) | 5,740 |
| C (s, diamant) | 2,38 |
| CO (g) | 197,7 |
| CO2 (g) | 213,8 |
| CH4 (g) | 186,3 |
| C2H4 (g) | 219,5 |
| C2H6 (g) | 229,5 |
| CH3OH (l) | 126,8 |
| C2H5OH (l) | 160,7 |
| H2 (g) | 130,57 |
| H (g) | 114,6 |
| H2O (g) | 188,71 |
| H2O (l) | 69,91 |
| HCI (g) | 186,8 |
| H2S (g) | 205,7 |
| O2 (g) | 205,03 |
Détermination de ΔS°
Considérons la condensation de l’eau, dans laquelle 1 mole de H2O gazeux se transforme en 1 mole de H2O liquide.
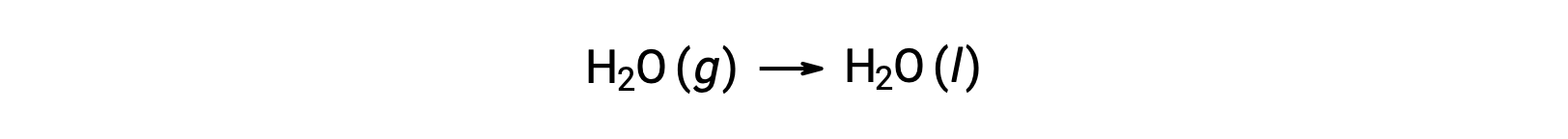
Les variations d’entropie standard pour la réaction, ΔS°R sont calculées à l’aide des entropies molaires standard et des coefficients stœchiométriques.
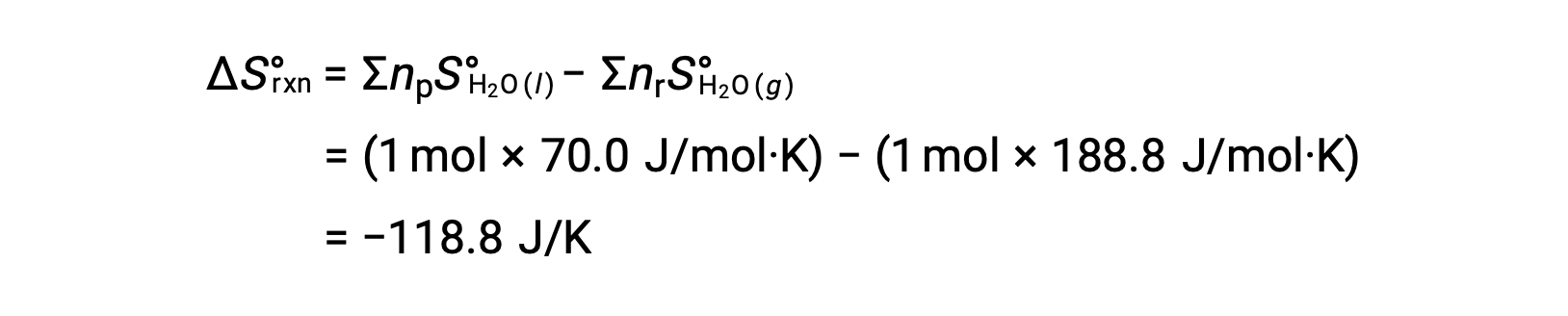
La valeur de ΔS°R est négative, comme prévu pour cette transition de phase (condensation).
Dans un deuxième exemple, prenons la combustion du méthanol, CH3OH :
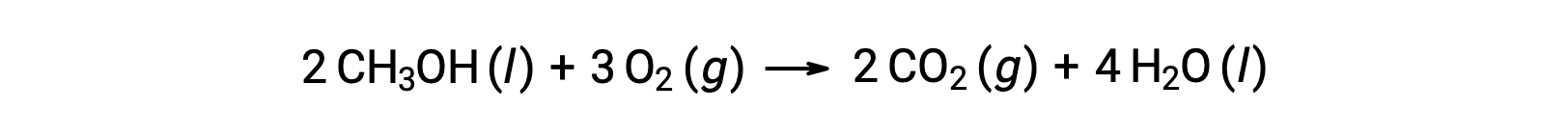
On suit la même procédure pour calculer la variation d’entropie standard de la réaction :
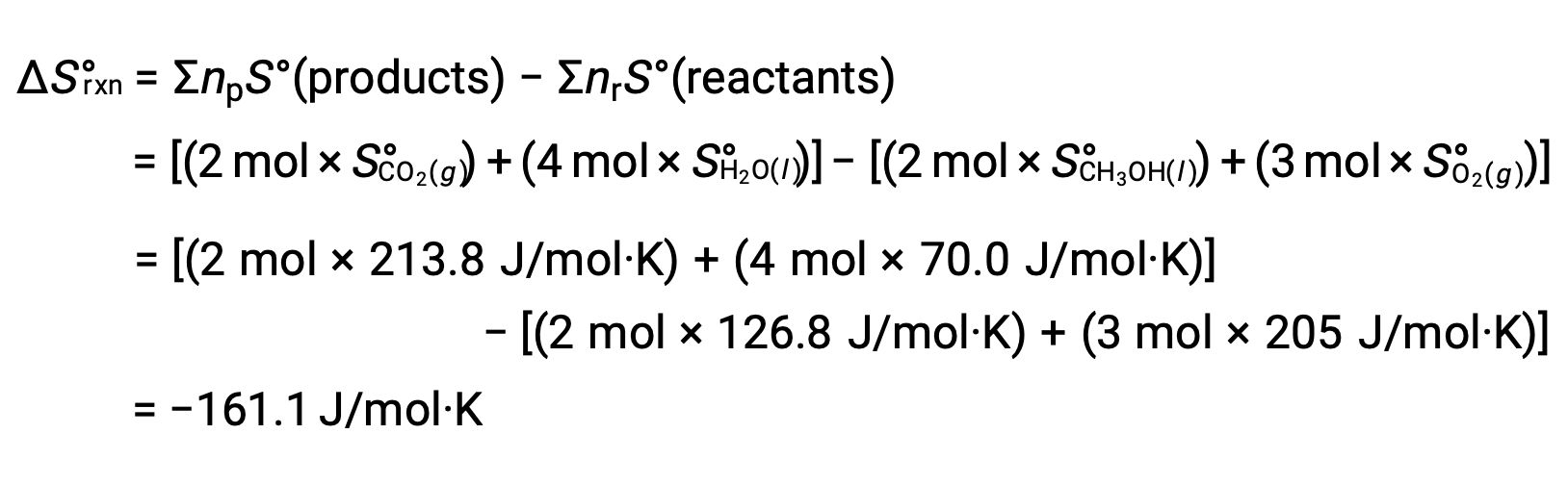
Ce texte est adapté de Openstax, Chimie 2e, Chapitre 16.2 : Le deuxième et troisième principe de la thermodynamique.
