14.3:
التوازن اللتفاعلات الغازية والتفاعلات غير المتجانسة
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Homogeneous Equilibria for Gaseous Reactions
بالنسبة للتفاعلات الكيميائية التي تكون موادها المتفاعلة ونواتجها جميعًا غازات،يمكن حساب ثابت التوازن،باستخدام الضغوط الجزئية الفردية وليس تركيزاتها المولية. وهكذا عندما يتحول الغازان A و B إلى الغازان C وD في تفاعل تعاكسي،يمكن بدلًا عن ذلك،كتابة معادلة التوازن على أنها الضغط الجزئي لكل غاز مرفوعًا إلى قوة معامل قياس تكافؤها. يُشار إلى ثابت التوازن بالرمز Kp حيث يدل الرمز السفلي p على الضغط.في تفاعل غازي معين،ليس بالضرورة أن يتساوى Kp مع Kc،لأن الضغط الجزئي لغاز ما وتركيزه المولي قيمتان منفصلتان. غير أنه يمكن اشتقاق علاقة بين الثابتين باستخدام معادلة الغازات النموذجية وتعريف المولارية. لاشتقاق هذه العلاقة،لنتأمل معادلات التوازن لـKc وKp لتفاعل كيميائي معين.معادلة الغاز النموذجية تربط بين ضغط الغاز وعدد مولاته و حجمه تحت درجة حرارة معينة. باستبدال نسبة المولات إلى الحجم،بالتركيز المولي في معادلة الغاز النموذجية،يسمح لضغط الغاز النموذجي لأن يُعبّر عنه من حيث تركيزه المولي. بهذه الطريقة،يمكن استبدال الضغط الجزئي الفردي في معادلة Kp مكان مكافئ التركيز لكل غاز.ولا يطرأ تغيير على مُعامل قياس تكافؤالعناصر. في المعادلة المعدّلة لـKp،النسبة بين تركيز النواتج وبين تركيز المواد المتفاعلة يمكن استبدالها بـKc. هذه المعادلة تعطي العلاقة بين الثابتين حيث Kp تساوي Kc مضروبة في RT ومرفوعة إلى أس معاملات قياس التكافؤ للنواتج،مطروحًا منها مجموع معاملات المواد المتفاعلة.الفرق بين معاملات المواد المتفاعلة الغازية والنواتج يمكن تمثيلها بالرمز دلتا n.
14.3:
التوازن اللتفاعلات الغازية والتفاعلات غير المتجانسة
<pالتوازن المتجانس للتفاعلات الغازية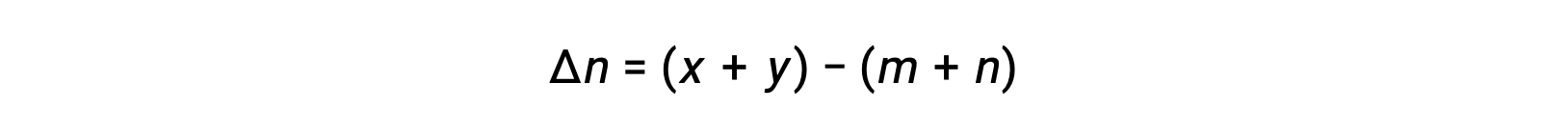
بالنسبة لتفاعلات الطور الغازي، يمكن التعبير عن ثابت التوازن إما من حيث التركيزات المولية (Kc) أو الضغوط الجزئية (Kp) من المواد المتفاعلة والمنتجات. يمكن اشتقاق العلاقة بين قيمتي K هاتين القيمتين ببساطة من معادلة الغاز المثالية وتعريف المولارية. وفقًا لمعادلة الغاز المثالية:
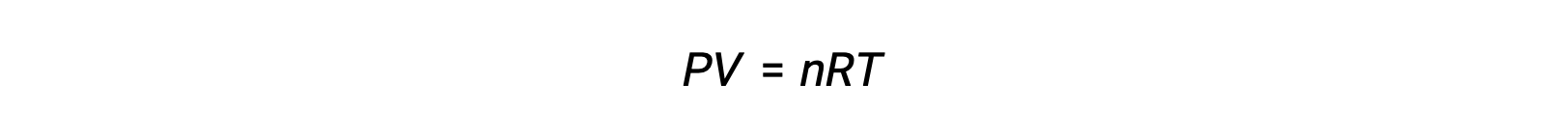
يُعزى التركيز المولي أو المولارية على عدد المولات مقسومًا على الحجم:
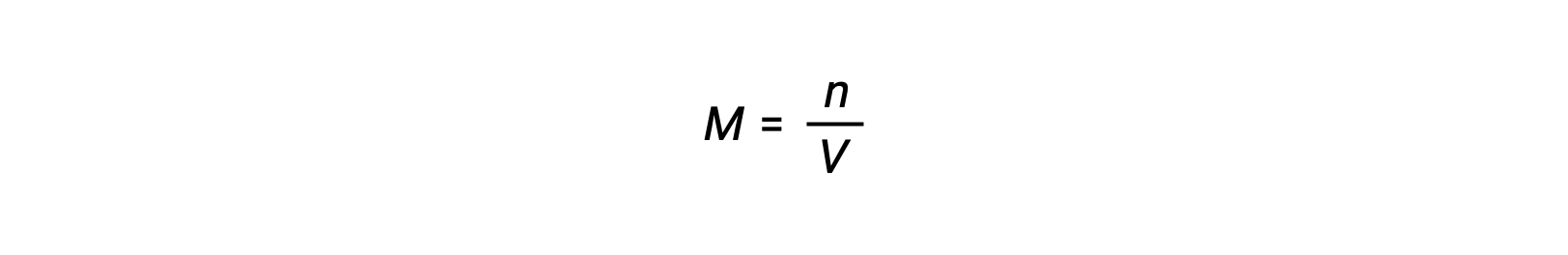
فإذاً,
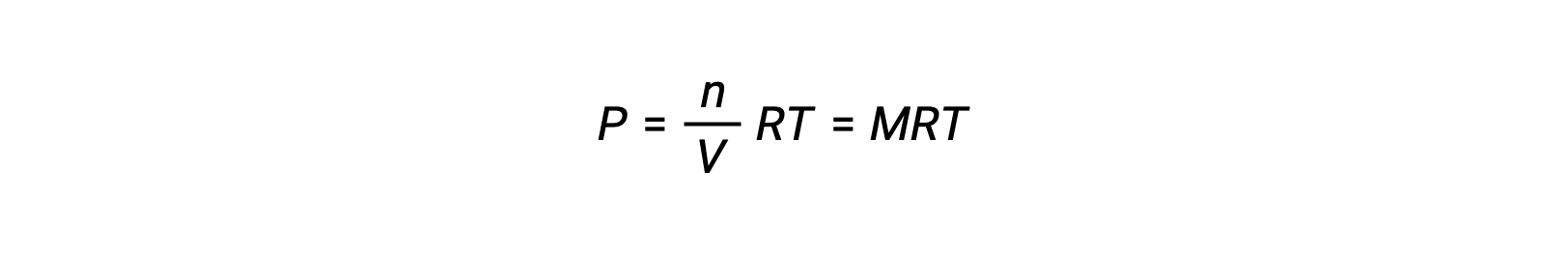
حيث أن P هو الضغط الجزئي، V هو الحجم، n هو عدد المولات، R هو ثابت الغاز، T هو درجة الحرارة، و M هو التركيز المولي.
لتفاعل الطور الغازي: m A + n B ⇌ x C + y D
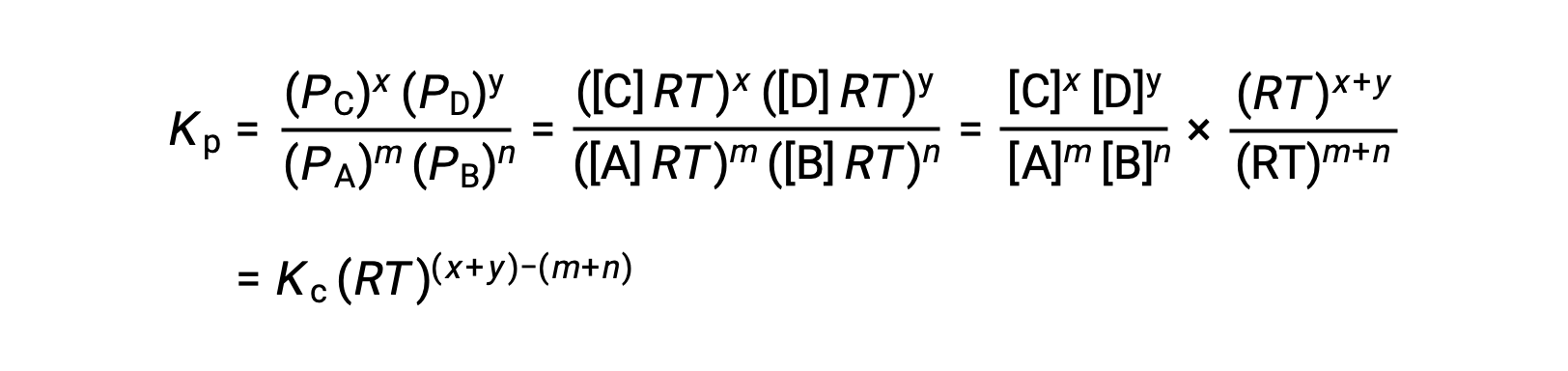
وهكذا، فإن العلاقة بينKc و KP هي
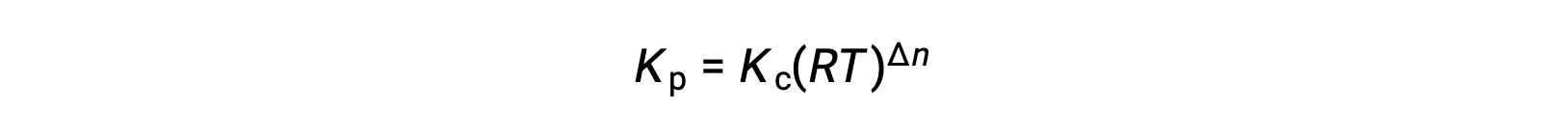
حيث أن Δn هو الفرق في الكميات المولية من المنتج والغازات المتفاعلة، في هذه الحالة:
p style=”text-align: center”>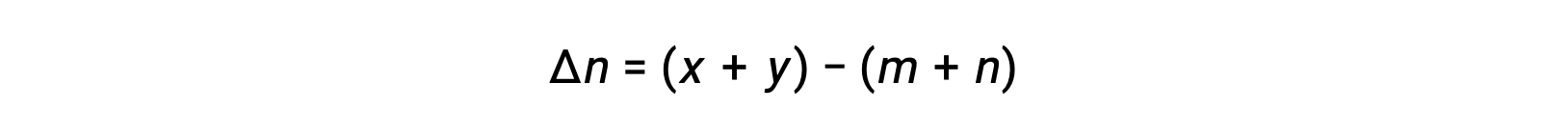
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
