13.1:
Velocidade de Reação
13.1:
Velocidade de Reação
A velocidade de reação é a alteração na quantidade de um reagente ou produto por unidade de tempo. As velocidades de reação são, portanto, determinadas medindo a dependência temporal de alguma propriedade que possa estar relacionada com quantidades de reagentes ou de produtos. As velocidades de reações que consomem ou produzem substâncias gasosas, por exemplo, são convenientemente determinadas através da medição de alterações no volume ou na pressão.
A representação matemática da mudança na concentração de reagentes e produtos, ao longo do tempo, é a expressão da velocidade de reação. Os parênteses indicam concentrações molares e o símbolo delta (Δ) indica “alteração”.
Por exemplo, a concentração de peróxido de hidrogénio, H2O2, em uma solução aquosa, muda lentamente ao longo do tempo, à medida que se decompõe de acordo com a equação:
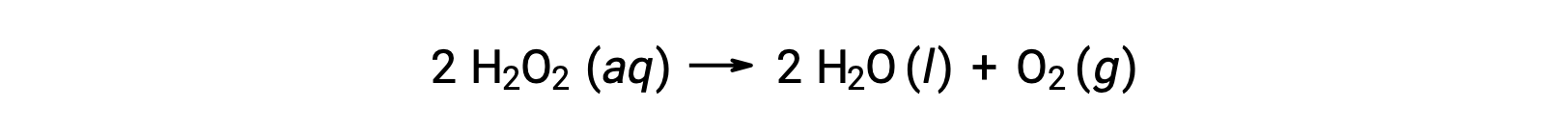
A velocidade de decomposição do peróxido de hidrogénio pode ser expressa em termos da velocidade de variação da sua concentração:

Assim, [H2O2]t1 representa a concentração molar de peróxido de hidrogénio no tempo t1; da mesma forma, [H2O2]t2 representa a concentração molar de peróxido de hidrogénio em um tempo posterior t2; e Δ[H2O2] representa a alteração na concentração molar de peróxido de hidrogénio durante o intervalo de tempo Δt (ou seja, t2 − t1). Uma vez que a concentração de reagentes diminui à medida que a reação prossegue, Δ[H2O2 é uma quantidade negativa. As velocidades de reação são, por convenção, quantidades positivas, pelo que esta alteração negativa da concentração é multiplicada por −1.
Velocidade de reação média e velocidade de reação instantânea
As velocidades de reação variam com o tempo e diminuem à medida que a reação avança. Pode ser calculada uma velocidade de reação média ao longo de um intervalo de tempo, utilizando as concentrações no início e no fim deste período, durante as quais a velocidade da reação está a mudar. A qualquer momento específico, a velocidade à qual uma reação está a ser realizada é conhecida como a sua velocidade instantânea. A velocidade instantânea de uma reação no “tempo zero,”, quando a reação começa, é sua velocidade inicial.
A velocidade instantânea de uma reação pode ser determinada por uma de duas formas. Se as condições experimentais permitirem a medição de alterações de concentração em intervalos de tempo curtos, o cálculo das velocidades médias proporciona aproximações razoavelmente boas das velocidades instantâneas. Em alternativa, pode ser utilizado um procedimento gráfico. Por exemplo, no exemplo da decomposição do peróxido de hidrogénio, ao traçar a concentração de peróxido de hidrogénio em relação ao tempo, a velocidade instantânea de decomposição do H2O2 pode ser calculada a qualquer tempo ‘t’ a partir do declive de uma tangente traçada à curva nesse tempo.
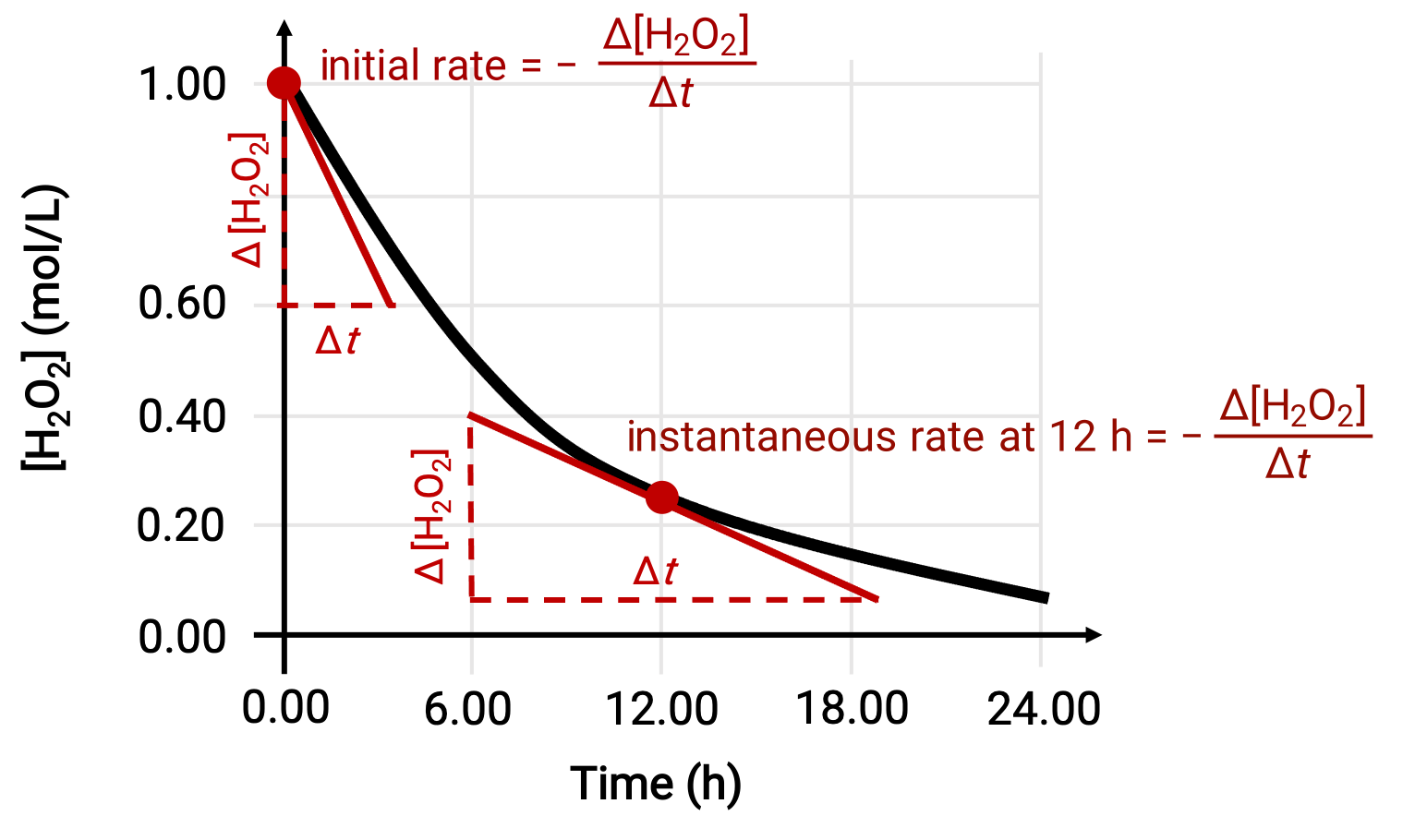
Este gráfico mostra uma representação de concentração versus tempo para uma solução de H2O2 de 1,000 M. A valocidade em qualquer momento é igual ao negativo do declive de uma linha tangente à curva nesse momento. As tangentes são mostradas em t = 0 h (“velocidade inicial”) e em t = 12 h (“velocidade instantânea” às 12 h).
Velocidades de Reação Relativas
A velocidade de reação pode ser expressa como a alteração da concentração de qualquer reagente ou produto. Para qualquer reação, essas expressões de velocidade estão todas relacionadas entre si de acordo com a estequiometria da reação. A velocidade da reação geral aA ⟶ bB pode ser expressa em termos da diminuição da concentração de A ou do aumento da concentração de B. Estas duas expressões de velocidade estão relacionadas com a estequiometria da reação, onde:
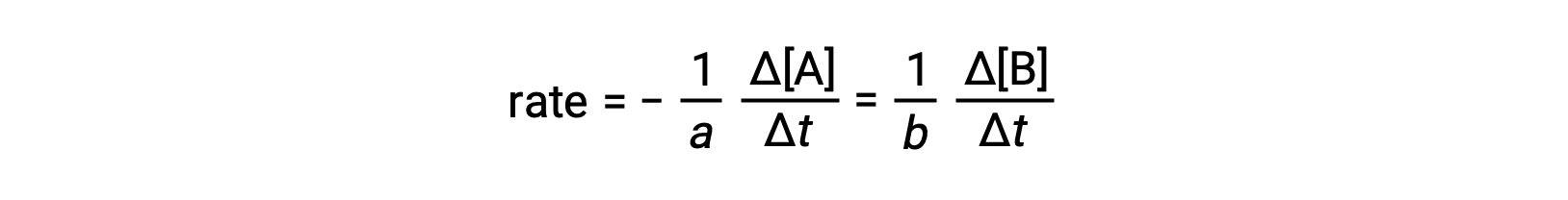
Note que foi incluído um sinal negativo como um factor para ter em conta os sinais opostos das duas variações de quantidade (a quantidade de reagentes está a diminuir enquanto que a quantidade de produtos está a aumentar).
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 12 Introduction e Openstax, Chemistry 2e, Section 12.1: Chemical Reaction Rates.
