6.12:
반응 엔탈피
표준 조건에서 발생하는 반응의 경우 일반 방정식을 사용하여 반응의 표준 엔탈피 변화를 계산합니다. 이 방정식은 생성물의 표준 생성 엔탈피 합계와 반응물의 표준 생성 엔탈피 합계에 각각 그의 화학양론 계수를 곱한 값의 차이를 구하여 풉니다. 5몰의 산소 기체와 2몰의 아세틸렌 기체를 연소하여 표준 조건에서 이산화탄소 기체 4몰과 수증기 2몰을 생성하는 반응을 고찰해 봅시다.반응에 대한 엔탈피는 이산화탄소 기체의 형성 엔탈피의 네 배와 수증기 형성 엔탈피의 두 배의 합에서 아세틸렌 가스의 엔탈피의 두 배와 산소 기체의 엔탈피 다섯 배의 합을 뺀 값입니다. 엔탈피 방정식은 표준 생성 엔탈피와 헤스의 법칙이라는 두 가지 개념을 결합하여 유도합니다. 첫 번째 항은 생성물의 표준 형성 엔탈피를 나타냅니다.방정식 1의 탄소와 산소에서 이산화탄소가 형성되고, 방정식 2의 수소와 산소에서 물이 형성됩니다. 이산화탄소와 물에 대하여 알려진 표준 생성 엔탈피는 각각 마이너스 393.5킬로줄과 마이너스 241.8킬로줄입니다. 연소에서 4몰의 이산화탄소가 발생하기 때문에 델타 H1은 이산화 탄소의 표준 생성 엔탈피 곱하기 4일 것이며 값은 마이너스 1574 킬로줄입니다.연소 과정에 또한 2 몰의 물이 생성되며 따라서 엔탈피 변화, 델타 H2는 물의 표준 생성 엔탈피 곱하기 2가 되며 이 값은 마이너스 483.6 킬로 줄입니다. 이로부터 생성물에 대한 순 표준 생성 엔탈피는 마이너스 2058 킬로 줄로 산출됩니다. 두 번째 항은 아세틸렌이 탄소와 수소로 분해되는 것을 나타냅니다.이것이 방정식 3입니다. 이는 반응물의 표준 생성 엔탈피에 대한 반응의 역 과정이므로, 엔탈피 값인 227.4킬로 줄에 음의 부호가 선행되는데 이것은 엔탈피 방정식에서도 볼 수 있습니다. 반응에서 2몰의 아세틸렌이 소비되기 때문에 델타 H3는 아세틸렌의 표준 생성 엔탈피 곱하기 2의 음수이며, 이는 마이너스 453.4 킬로 줄과 같습니다.산소의 표준 생성 엔탈피는 0입니다. 따라서 반응물의 순 표준 형성 엔탈피는 마이너스 453.4킬로줄입니다. 헤스의 법칙에서 한 단계 반응이 여러 단계로 나뉘어 진행되면 각 단계의 엔탈피 합이 순 엔탈피 변화와 같다는 것을 상기하십시오.생성 엔탈피에 대한 값을 방정식에 대체하면 반응의 엔탈피가 마이너스 2511 킬로줄로 나타납니다.
6.12:
반응 엔탈피
Hess의 법칙은 반응제 및 제품의 형성의 해당 엔탈피를 사용할 수 있는 경우 어떤 반응의 엔탈피 변화를 결정하는 데 사용할 수 있습니다. 주요 반응은 단계적 반응으로 나눌 수 있습니다 : (i) 반응체의 분해는 그들의 성분 요소로, 엔탈피 변화가 반응제의 형성의 엔탈피의 네거티브에 비례하는, -ΔHf°(reactants), (ii) 원소의 재조합(1단계에서 얻어진) 이어서 제품을 제공하기 위해, 제품의 형성의 엔탈피에 비례하는 엔탈피 변화와 함께, ΔHf°(제품). 전체 반응의 표준 엔탈피 변화는 따라서 동일하다 : (ii) 모든 제품의 형성의 표준 엔탈피의 합계 플러스 (i) 반응제의 형성의 표준 엔탈피의 네거티브의 합계, ∑ 나타내는 다음 방정식에 의해 주어진 바와 같이, ∑ “의 합”과 n 스토이치메트릭지오 계수에 대한 의미.
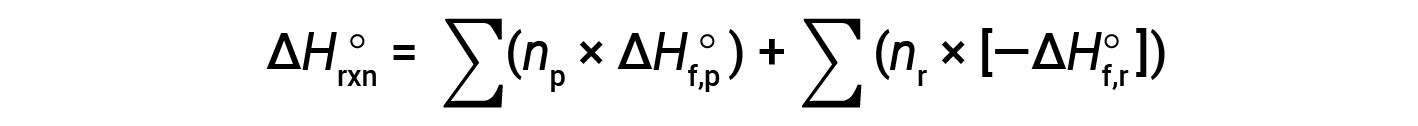
방정식은 일반적으로 다음과 같이 작성할 약간 재배열됩니다.
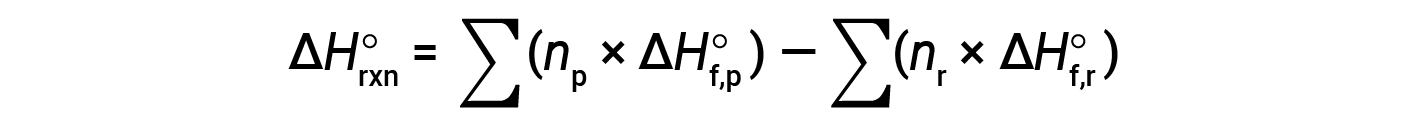
다음 예제에서는 이 방정식이 유효한 이유와 이 방정식을 사용하여 반응에 대한 표준 엔탈피 변경을 계산하는 방법을 자세히 보여 줄 수 있습니다.

여기서, 헤스의 법칙과 반응제 및 제품에 대한 형성 값의 열의 특별한 형태가 사용된다: ΔHf° (HNO3)= -206.64 kJ /mol; ΔHf° (NO) = +90.2 kJ/mol; ΔHf° (NO2)= +33 kJ/mol; ΔHf° (H2O) = -285.8 kJ /mol.


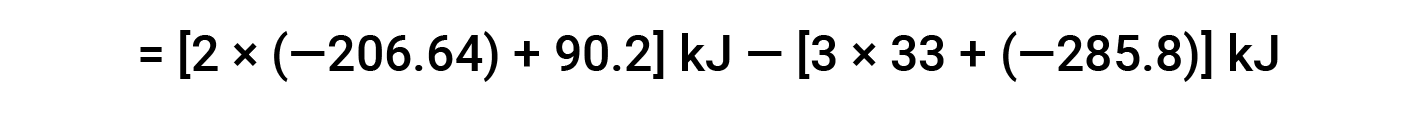
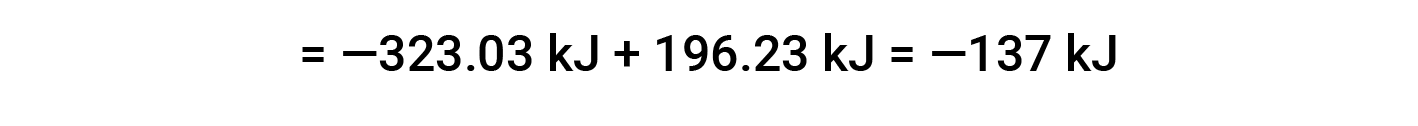
Suggested Reading
- Davis, Thomas W. "A common misunderstanding of Hess' law." Journal of Chemical Education 28, no. 11 (1951): 584.
- Lee, A. L., H. L. Feldkirchner, F. C. Schora, and J. J. Henry. "Heat of Reaction of Hydrogen and Coal." Industrial & Engineering Chemistry Process Design and Development 7, no. 2 (1968): 244-249.
