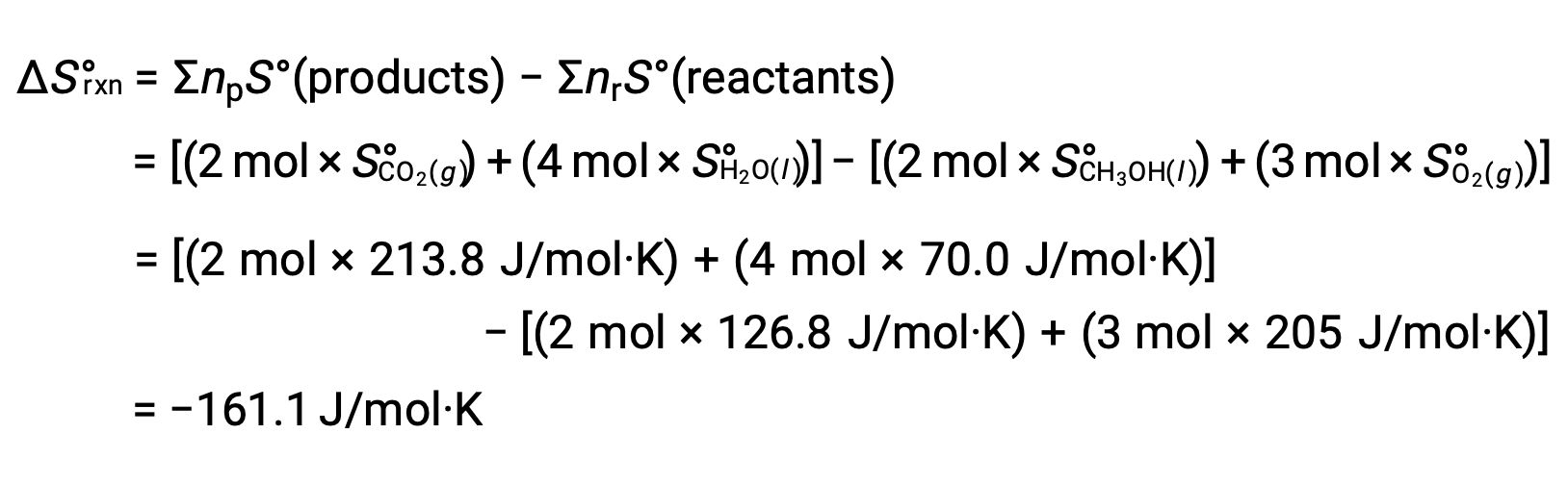17.5:
反应的标准熵值变化
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Standard Entropy Change for a Reaction
与化学反应相关的焓变可以 用热量计测量,但与反应相关的熵变 不能直接测量。熵是一个状态函数,这意味着,一个过程的熵变化,这意味着熵的变化仅取决于 系统的初始状态和最终状态。因此,像焓变一样,熵变 也可以从标准摩尔熵的计算参考表中 得到。对于标准状态下发生的反应,相关熵变由 生成物的标准摩尔熵之和 乘以它们的 化学计量系数 与反应物的标准摩尔熵之和 乘以它们的 化学计量系数之间的差来确定。请考虑标准状态下 乙烯的燃烧,其中 1 摩尔乙烯气体 与 3 摩尔氧气反应,生成 2 摩尔二氧化碳气体 和 2 摩尔水。这个反应的标准熵变 等于 2 倍二氧化碳气体的标准熵 和 2 倍水的标准熵之和,减去乙烯气体的标准熵 和 3 倍氧气的标准熵之和。注意,与元素的标准 生成焓为零不同,所有物质的标准摩尔熵 在 298 开尔文时都大于零。代入参考表中反应物 和生成物的摩尔熵,得到 2 乘 213.8 加 2 乘 70.0,减去 219.5 加 3 乘 205.3。生成物的净熵等于 567.6 焦耳每开尔文,反应物的净熵 为 835.4 焦耳每开尔文。生成物与反应物之间的差 等于负 268 焦耳每开尔文,这是乙烯燃烧的标准熵变。负值表示 熵的减少。即使不计算准确的熵变,也可以通过检查反应来 预测熵的减少。回想一下,气体比液体更无序。反应物中有更多摩尔的气体-4 摩尔气体,其中包括 1 摩尔乙烯和 3 摩尔氧气-与 生成物相比-只有 2 摩尔二氧化碳气体,而另一种生成物是液体。因此,对于这个反应,反应物 比生成物更无序。因此,熵随着反应的进行而减少。
17.5:
反应的标准熵值变化
熵是一种状态函数,因此化学反应的标准熵变化 (ΔS°rxn) 可以根据生成物和反应物之间的标准熵差异来计算。
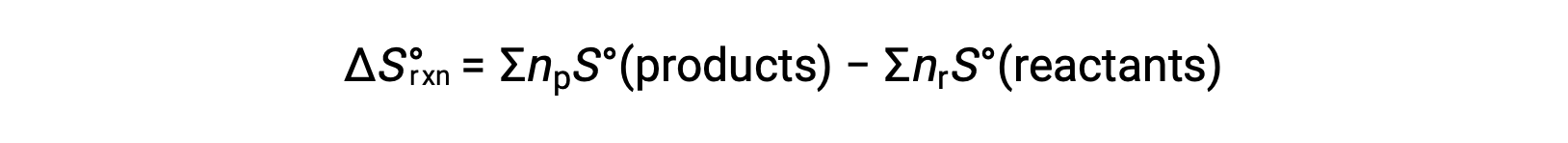
其中 np 和 nr 分别代表生成物和反应物平衡方程中的化学 – 大气系数。
例如,在室温下对以下反应进行 ΔS°rxn
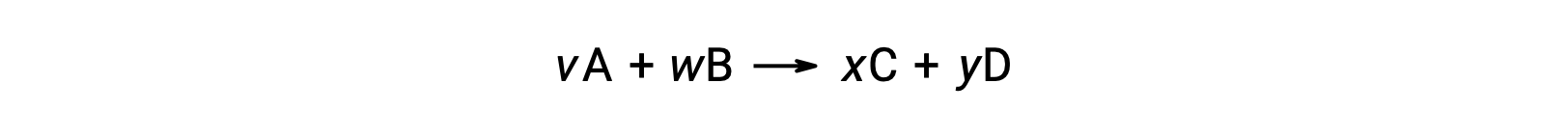
计算方法如下:
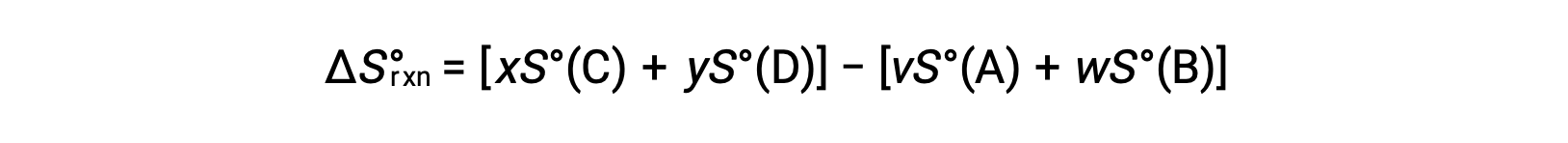
表中提供了标准托架的部分列表。
| S° (焦耳·/ 摩尔 K) | |
| C (s ,石墨) | 5.740) |
| C (s ,菱形) | 2.38. |
| CO (g) | 197.7 |
| 二氧化碳 (g) | 23.8. |
| 甲烷 (g) | 186.3 |
| C2H4(g) | 219.5 |
| C2H6 (g) | 229.5 |
| CH3OH (l) | 126.8 |
| C2H5OH (l) | 160.7. |
| H2 (g) | 130.57. |
| 高 (g) | 114.6. |
| 水 (g) | 188.71 |
| 水 (升) | 69.91. |
| HCI (g) | 186.8 |
| H2S (g) | 205.7 |
| 氧气 (g) | 205.03 |
ΔS° 的确定
考虑凝结 of Water ,其中 1 摩尔气态 H2O 变为 1 摩尔液态 H2O。
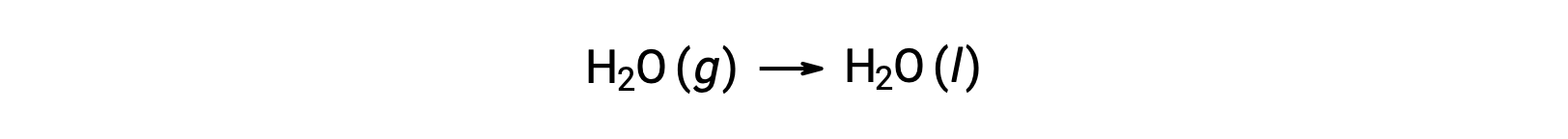
ΔS°反应的标准熵变化, n ü r rxn 是使用标准摩尔根托和化学计量系数计算的。
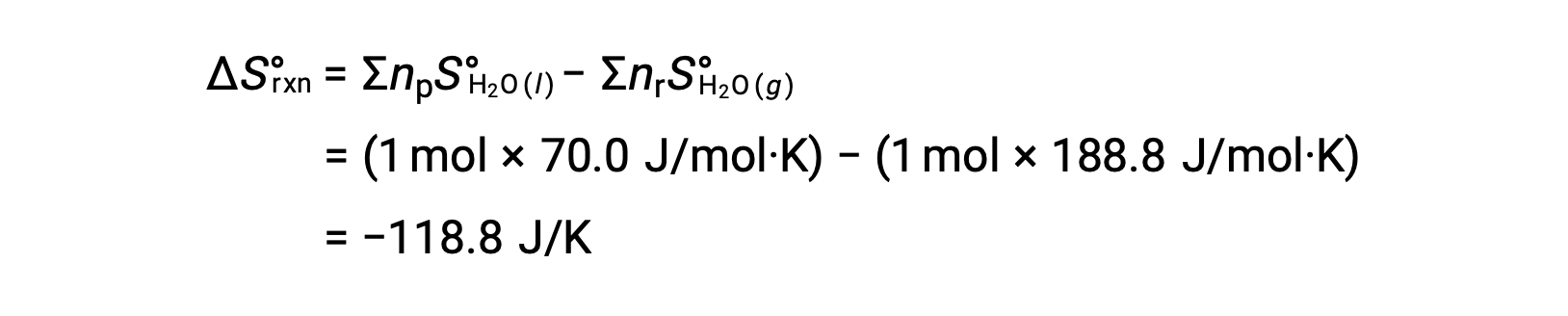
n ü ΔS°rxn 的值为负值,与此相变 (凝结) 的预期值相同。
第二个例子是,考虑甲醇的燃烧, CH3OH :
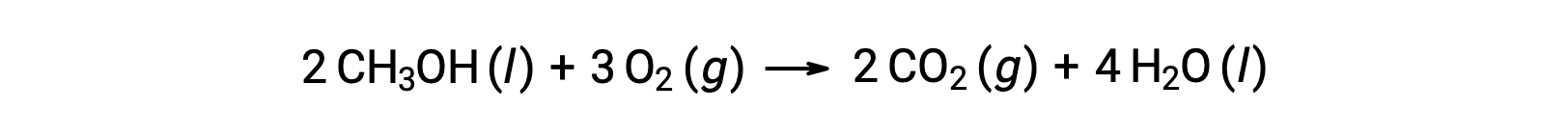
计算 反应的标准熵变化时遵循相同的程序: