17.3:
热力学第二定律
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Second Law of Thermodynamics
根据热力学第一定律,系统中的能量变化与环境的能量变化 相等,并且相反。当把冰块放入一杯热茶中时,冰块可以看做一个系统,热茶是它的环境,冰会融化,而茶则变凉。冰块获得的热量 等于茶损失的热量。无论传热的方向如何,能量都是守恒的。然而,加入冰块永远不会让茶变热,因为传递的热量 并不能决定热量的流动方向。必须考虑熵的相关变化 来解释热传递 和其他自发反应的方向。热力学第二定律指出,体系的熵,即系统和环境的总熵,对于所有自发过程 都是增加的。这意味着,体系的熵变 即体系的最终状态和初始状态的熵差,必须大于零。由于熵是能量扩散的一种度量,当一个过程的体系能量 在最终状态比在初始状态更分散时,这个过程将会自发进行。冰块融化时,水分子 从有序的固态变为更无序的液态,系统的熵变为正;水冻结成冰时,系统的熵变 为负。但是,要让这些过程自发进行,体系的熵必须增加,所以这些过程是否自发进行的区别 一定存在于在环境中。水冻结时,热量释放到环境中,从而增加了环境的能量扩散。为了使体系熵变 为正,环境的熵变 必须为正,并且它的大小必须大于系统的熵变 纯水只有在温度低于 0℃才会自发冻结。这是因为在低温下传递 给环境的热量 比在高温下传递同样的热量 导致的熵变更大。环境熵变 的大小 与系统的热量传递成正比,与温度 T 成 反比。因此,对于在恒定温度和 压力下发生的任何过程,环境熵变 等于 传递到环境的热量 除以开尔文温度。
17.3:
热力学第二定律
为了寻找一个能够可靠预测流程自发性的属性,我们确定了一个有前途的候选人:熵。 涉及系统熵增加 (ΔS > 0) 的过程通常是自发的;但是,相反,实例非常丰富。 通过将熵变更的考虑范围扩大到包括周围环境,可以就该属性与自发性之间的关系得出重要结论。 在热动力模型中,系统和周围由所有东西组成,即宇宙,因此以下是正确的:

为了说明这种关系,请再次考虑两个物体之间的热流过程,一个被标识为系统,另一个被标识为周围。 这一过程有三种可能:
- 物体处于不同的温度,热量从较热的物体流向较冷的物体。 这种情况总是自发发生的。 将较热的对象指定为系统并调用熵的定义会产生以下结果:
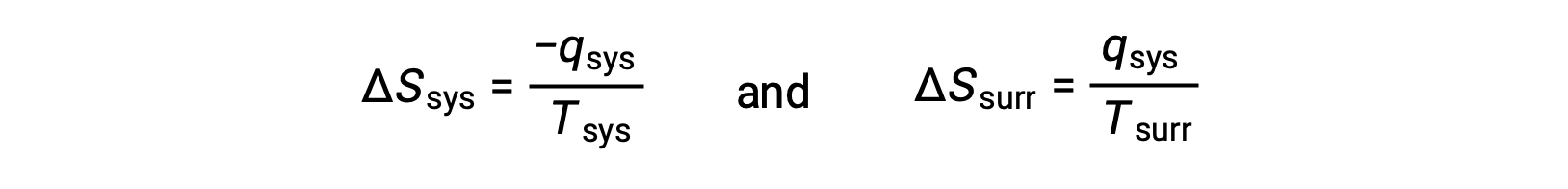
−Qsys 和 Qsys 的大小相等,它们的相反算术符号表示系统的热量损失和周围的热量增加。 由于在这种情况下是 Tsys > Tsurr ,系统的熵减少将是小于周围的熵增加,因此宇宙的熵将增加:
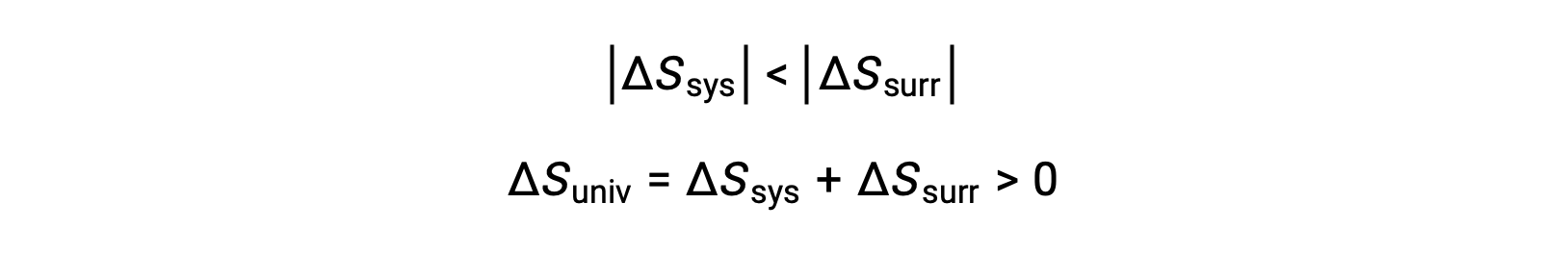
- 物体处于不同的温度,热量从冷却器流向温度更高的物体。 这种情况从未出现过。 再次将较热的对象指定为系统并调用熵的定义,将产生以下结果:
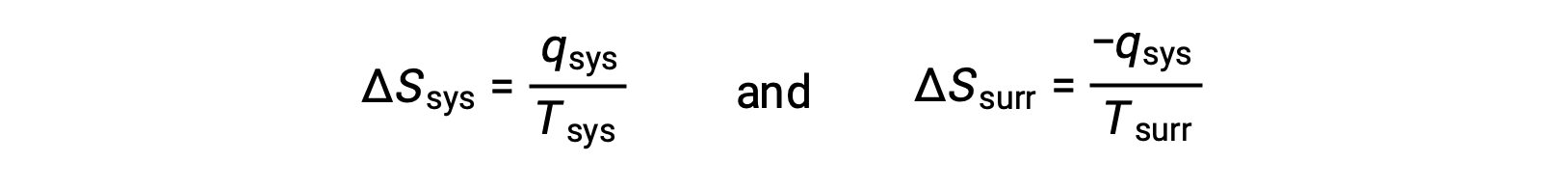
Qsys 的算术符号表示系统的热量增益和周围的热量损失。 熵对周围的变化幅度将再次为系统的大于,但在这种情况下,热量变化的迹象 (即热流的方向) 将产率为 ΔSuniv 的负值。 这一过程涉及宇宙的熵的下降。
- 这些物体的温度基本相同,即 Tsys ≈ Tsurr ,因此熵变化的幅度对系统和周围环境都基本相同。 在这种情况下,宇宙的熵变化为零,系统处于平衡状态。
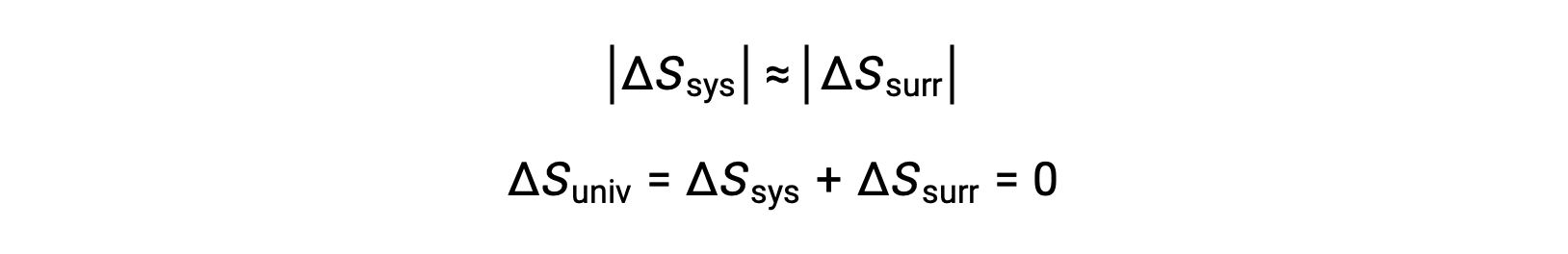
这些结果导致对熵和自发性 (称为热力学第二定律) 之间关系的深刻阐述:所有自发性变化都会导致宇宙的熵增加。 下表概述了这三种关系。
| 热力学第二定律 | |
| ΔSuniv > 0 | 自发的 |
| ΔSuniv < 0 | 非自发 (相反方向自发) |
| ΔSuniv = 0 | 平衡 |
对于许多现实应用,环境与系统相比非常广阔。 在这种情况下,由于某些过程而在周围地区获得或损失的热量在其总热能中所占的比例非常小,几乎是无限的。 例如,空气中燃料的燃烧涉及将热量从系统 (正在发生反应的燃料和氧气分子) 转移到无限大的环境 (地球大气层)。 因此, qsurr 是 Qsys 的良好近似值,第二个定律可能如下所示:
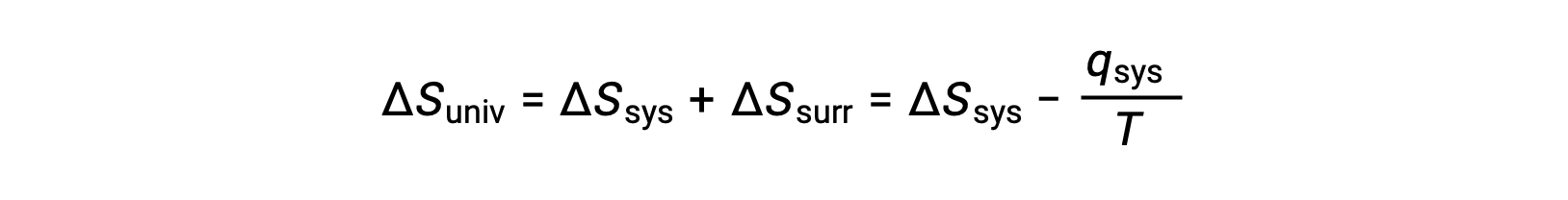
此方程可用于预测流程的自发性。
