16.12:
错合离子的形成
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Formation of Complex Ions
金属离子在水溶液中总是水合的。水分子起着路易斯碱的作用,与金属离子共用一对孤对电子,而金属离子的作用就像路易斯酸。当加入一种比水强的路易斯碱时,它会取代水分子并包围中心金属离子,形成复合离子。作为路易斯碱的分子或离子 称为配体。在氯化六胺钴(III)中,六胺钴是一种复合离子,其中 6 个氨分子 是配体,它们以八面体的形式围绕着 中心钴离子。因为过渡金属离子有很高的电荷密度 和空的 d 轨道来容纳共享的电子,所以它们特别容易形成复合离子。金属离子与配体反应的平衡常数 称为形成常数,Kf。Kf 的值越大,复合离子越稳定。形成这种稳定的复合离子通常会 增加难溶金属盐的溶解度。以硫化银为例,它以水离子和未溶解固体 平衡的状态存在于溶液中。如果在氰化钠溶液中加入硫化银,银离子会与氰化物结合,形成复合离子双氰基丙烯酸酯。如果在一升 0.90M 氰化钠溶液中加入 0.20 摩尔的 硫化银,银离子的平衡浓度,x,可以通过 ICE 表计算出来。银离子,氰化物离子 和双氰基丙烯酸酯离子的初始浓度 分别为 0.20M,0.90M 和 0。由于较高的 Kf,和与银离子相比 更高浓度的氰化物,基本上所有银离子都转化为 双氰基丙烯酸酯离子。1 个水性银离子与 2 个氰化物离子反应 形成双氰基丙烯酸酯。因此,氰化物离子摩尔浓度的变化 将是 2 乘以 0.20,或 0.40M。因此,在平衡状态下,可以假设 双氰基丙烯酸酯离子的浓度与 银离子的初始浓度相同,而氰化物离子浓度为 0.90 减去 0.40M,或 0.50M。将这些值代入 Kf 的表达式,得到 0.2M 除以 x 乘以 0.5 的平方。当通过表达式求解 x 时,所得到的 浓度为 8.0 10⁻²²M. 银离子的平衡浓度非常小,这表明复合离子的形成 耗尽了溶液中的游离银离子。这驱使硫化银溶解度平衡 朝向离子的方向移动,允许更多的固体溶解。
16.12:
错合离子的形成
一种路易斯 酸-碱 化学涉及形成一个错合离子 (或一个协调综合体) ,由一个中心原子 (通常是一个过渡金属阳离子) 组成,由被称为配体的离子或分子包围。 这些配体可以是中性分子 (如 H2O 或 NH3) ,也可以是离子 (如 CN− 或 OH−)。 通常,配体充当路易斯碱,向中心原子捐献一对电子。 这些类型的路易斯 酸-碱 反应是一个广泛的细分领域的示例,称为协调化学——这是本文件中另一章的主题。
一种或多种配体的金属离子形成协调复合物的反应的平衡常数称为形成常数 (Kf) (有时称为稳定性常数)。 例如,错合离子 [Cu(CN)2]− 由反应产生
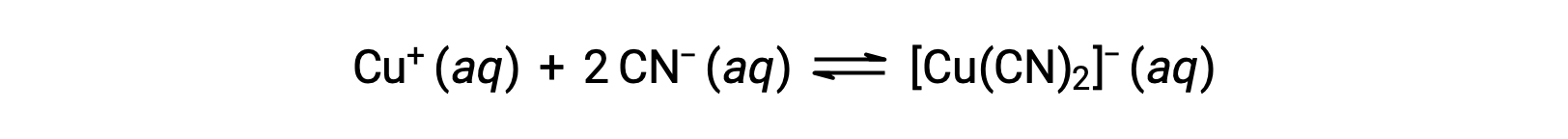
这种反应的形成常数是
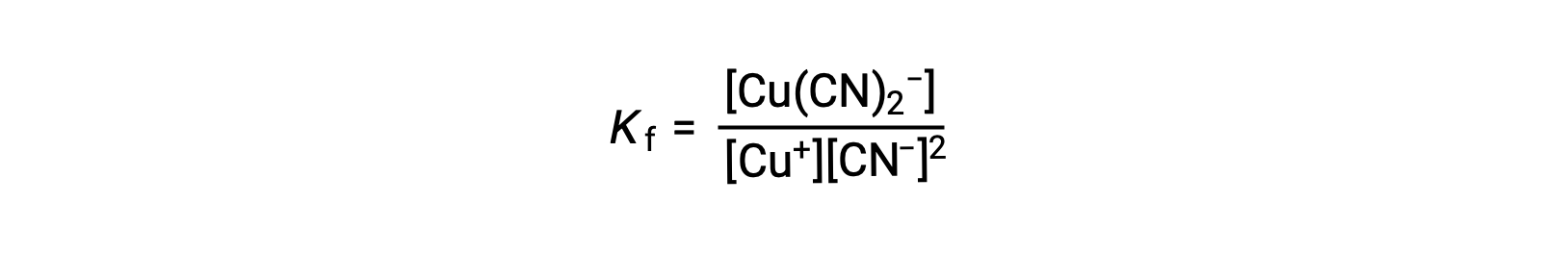
或者,可以考虑反向反应 (错合离子分解) ,在这种情况下,平衡常数为解离常数 (Kd)。 根据所述对等反应的平衡常数之间的关系,解离常数是形成常数的数学反函数 Kd = Kf−1。
作为错合离子形成溶解的一个例子,请考虑在氯化银和水的混合物中添加水氨时会发生什么情况。 氯化银在水中稍溶解,从而产生一个小浓度 Ag+ ([Ag+] = 1.3 × 10−5 M):
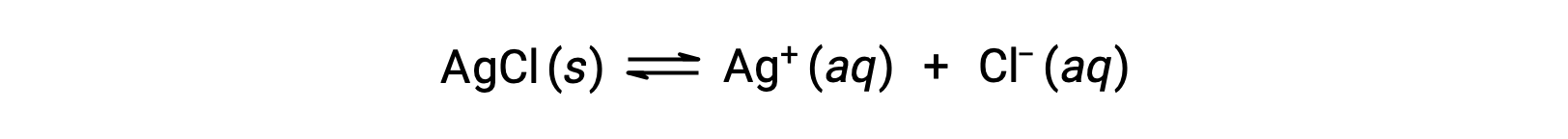
但是,如果水中存在 NH3,则错合离子 [Ag(NH3)2]+ 可以根据方程:
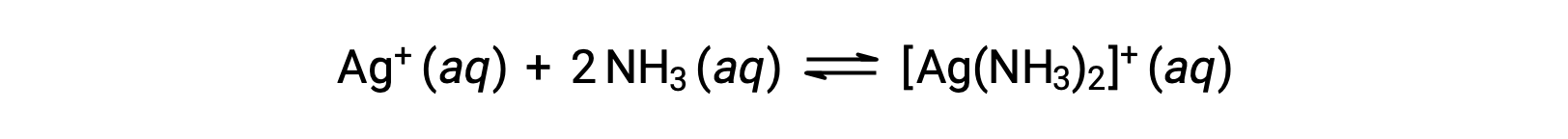
Suggested Reading
- Xie, Feng, and David B. Dreisinger. "Leaching of silver sulfide with ferricyanide–cyanide solution." Hydrometallurgy 88, no. 1-4 (2007): 98-108.
- Glueck, A. R. "Desalination by an ion exchange-precipitation-complex process." Desalination 4, no. 1 (1968): 32-37.
- Shakhashiri, Bassam Z., Glen E. Dirreen, and Fred Juergens. "Solubility and complex ion equilibria of silver (I) species in aqueous solution." Journal of Chemical Education 57, no. 11 (1980): 813.
