16.9:
多価酸の滴定
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Titration of a Polyprotic Acid
A polyprotic acid contains multiple ionizable protons, and each dissociates in a distinct step. The loss of each proton has a different Ka, and each subsequent acid dissociation constant is weaker than the previous one. For example, sulfurous acid has two ionizable protons. Ka1 for the dissociation of the first proton is 1.6 × 10−2, whereas Ka2 for the dissociation of the second proton is 6.4 × 10−8. If sulfurous acid is titrated with a strong base, such as sodium hydroxide, the first ionizable proton is removed initially, generating hydrogen sulfite ions. This part of the titration curve is similar to that of a weak monoprotic acid and a strong base. It has an equivalence point, and the pH of the solution at the half-equivalence point is equal to pKa1. As more base is added, it neutralizes the second ionizable proton. As the concentration of hydrogen sulfite ion is equal to the initial sulfurous acid, the same amount of base is needed to neutralize it. Therefore, two moles of a base is necessary to neutralize one mole of a diprotic acid completely. The titration curve for the second neutralization step also has a second half-equivalence point, where the pH of the solution equals pKa2, and a second equivalence point, which lies in the basic region. Similarly, the curve for the titration of triprotic phosphoric acid with a strong base has three equivalence points. Therefore, during the titration of a weak polyprotic acid, the number of equivalence points generated in the titration curve is equal to the number of ionizable protons present as long as the difference between the Ka values of the ionizable protons is more than ten thousand fold.
16.9:
多価酸の滴定
多価酸は複数の電離可能な水素を含み、段階的な電離過程を経ます。 イオン化可能なプロトンの酸解離定数が互いに十分に異なる場合、このような多価酸の滴定曲線には、イオン化可能な水素ごとに異なる当量点が形成されます。したがって、二価酸の滴定では2つの当量点が、三価酸の滴定では滴定曲線上に3つの当量点が形成されることになります。
炭酸(H2CO3)は、弱い二価酸の一例です。炭酸の最初のイオン化では、わずかなヒドロニウムイオンと炭酸水素イオンが生成されます。
1段階目の電離:
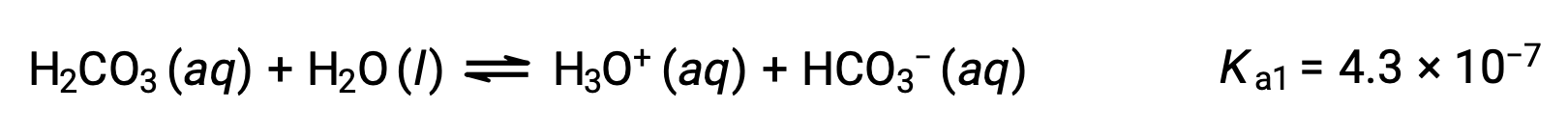
炭酸水素イオンは、酸としても作用します。電離した後、さらに少量のヒドロニウムイオンや炭酸イオンを生成します。
2段階目の電離:
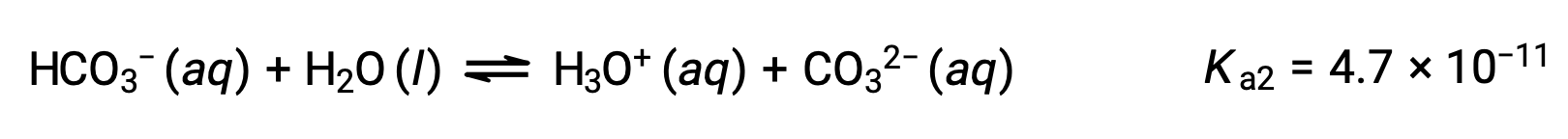
Ka1はKa2よりも104倍も大きいです。そのため、H2CO3をNaOHのような強塩基で滴定すると、電離可能な水素ごとに2つの異なる当量点が得られます。
三価酸であるリン酸は、3段階で電離します。
1段階目の電離:
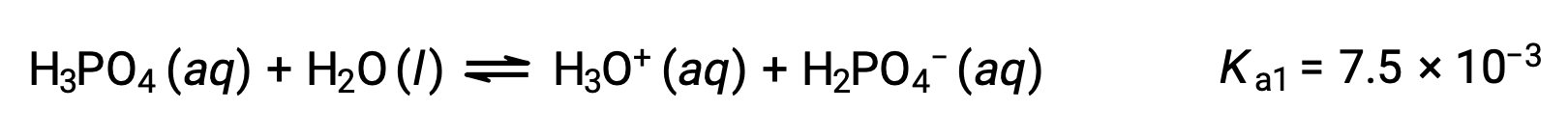
2段階目の電離:
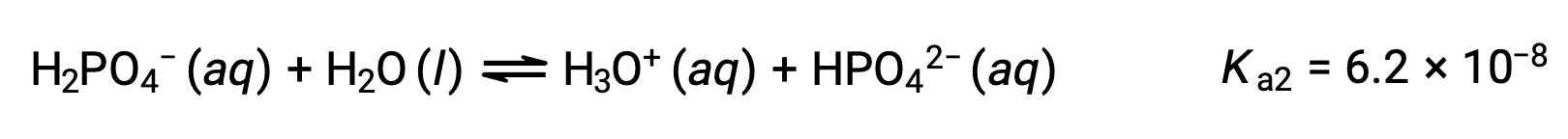
3段階目の電離:
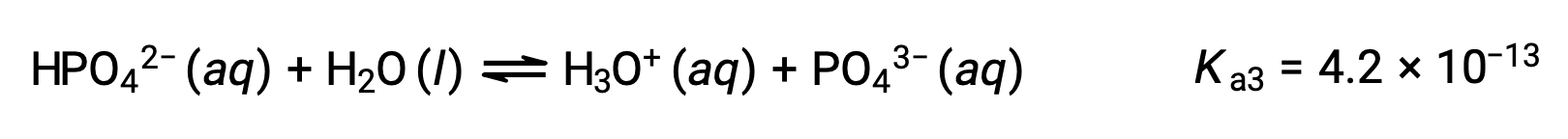
H3PO4をKOHのような強塩基で滴定すると、電離可能な各水素に対して3つの当量点が得られます。しかし、HPO42−は非常に弱い酸であるため、3つ目の当量点は滴定曲線上では容易に見分けることができません。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.5: Polyprotic Acids.
