16.7:
Calculs de titrage : acide faible - base forte
16.7:
Calculs de titrage : acide faible - base forte
Calcul du pH pour les solutions de titrage : acide faible/base forte
Pour le titrage de 25,00 ml de CH3CO2H 0,100 M avec NaOH 0,100 M, la réaction peut être représentée comme suit :
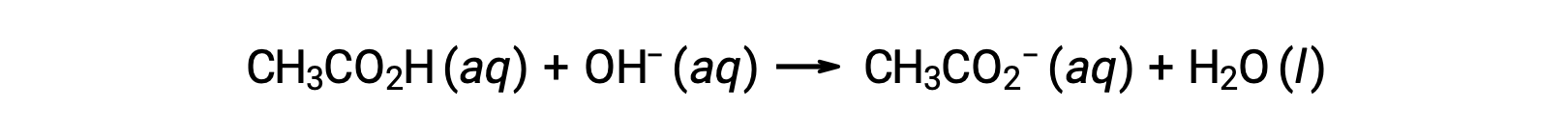
Le pH de la solution de titrage après l’ajout des différents volumes de titrant NaOH peut être calculé comme suit :
(a) Le pH initial est calculé pour la solution d’acide acétique suivant l’approche ICE habituelle :
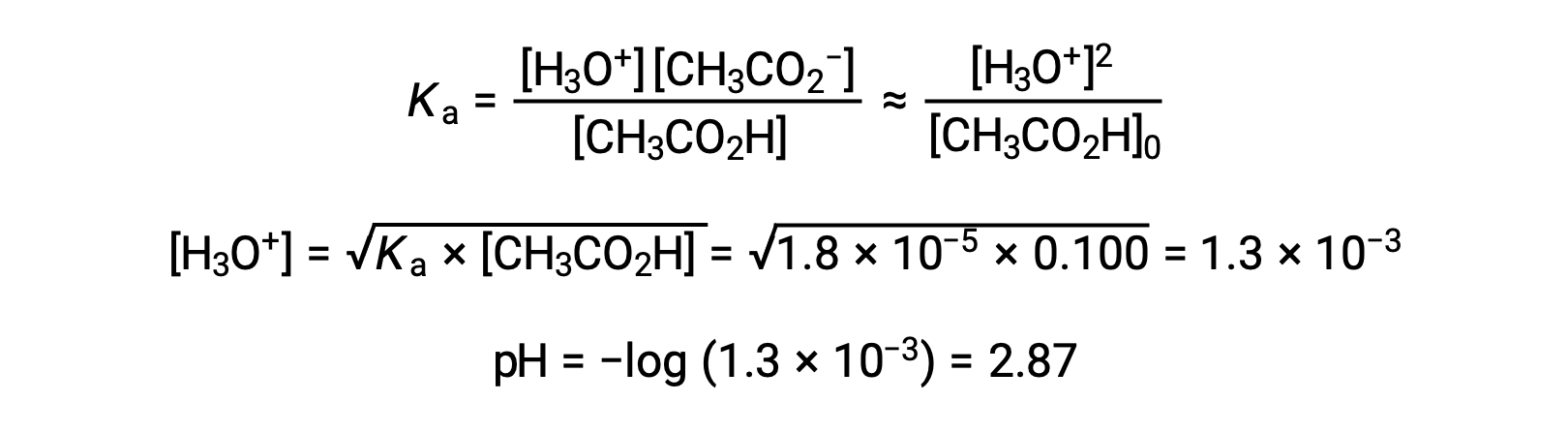
(b) L’acide et le titrant sont tous deux monoprotiques et les solutions d’échantillon et de titrant sont de concentrations égales ; ainsi, ce volume de titrant représente le point d’équivalence. Contrairement à l’exemple de l’acide fort, le mélange réactionnel contient dans ce cas une base conjuguée faible (ion acétate). Le pH de la solution est calculé en tenant compte de l’ionisation de la base de l’acétate, qui est présent à une concentration de
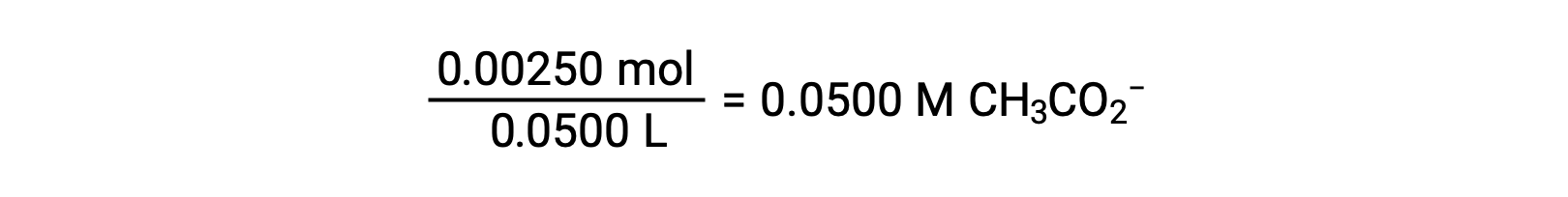
L’ionisation de la base de l’acétate est représentée par l’équation
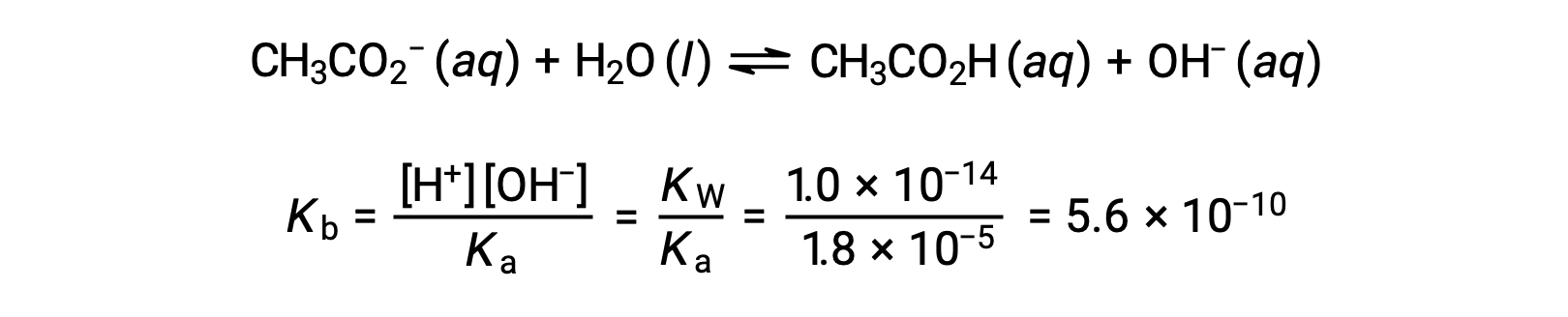
En supposant que x << 0,0500, le pH peut être calculé selon l’approche ICE habituelle :
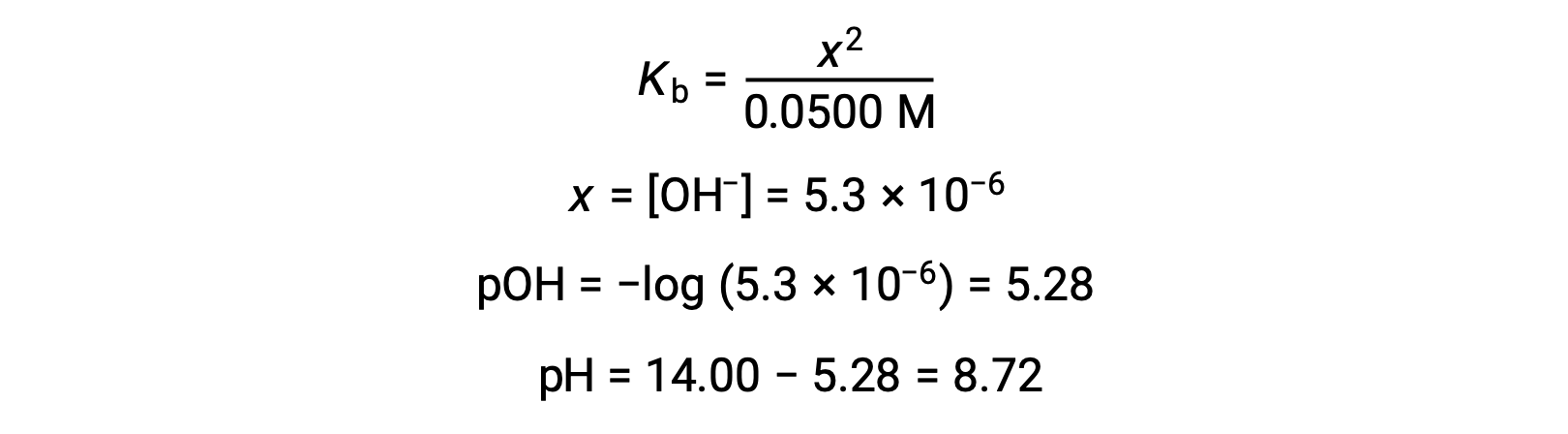
Notez que le pH au point d’équivalence de ce titrage est significativement supérieur à 7, comme prévu lors du titrage d’un acide faible avec une base forte.
(c) Volume du titrant = 12,50 mL. Ce volume représente la moitié de la quantité stœchiométrique de titrant, et donc la moitié de l’acide acétique a été neutralisée pour produire une quantité équivalente d’ion acétate. Les concentrations de ces partenaires acide-base conjugués sont donc égales. Une approche pratique pour calculer le pH est l’utilisation de l’équation de Henderson-Hasselbalch :
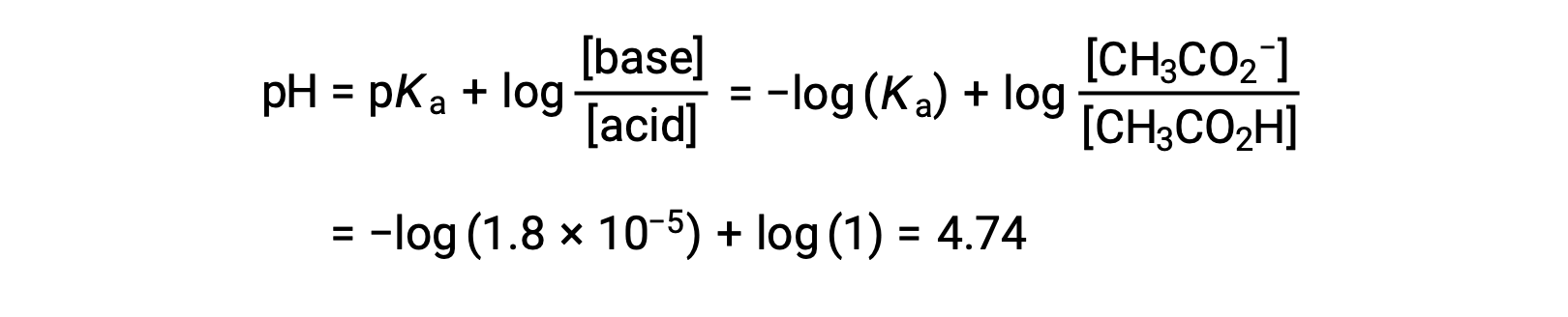
(pH = pKa au point de demi-équivalence dans le titrage d’un acide faible)
(d) Volume du titrant = 37,50 mL. Ce volume représente un excès stœchiométrique de titrant et une solution de réaction contenant à la fois le produit du titrage, l’ion acétate, et l’excès de titrant fort. Dans de telles solutions, le pH de la solution est déterminé principalement par la quantité de base forte en excès :

Ce texte est adapté de Openstax, Chimie 2e, Section 14.7 : Titrages acido-basiques.
