13.8:
阿伦尼乌斯图
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Arrhenius Plots
化学反应的速率对温度的变化 非常敏感。这种温度依赖性可以用阿伦尼乌斯方程 从数学上给出解释;该方程 表示了速率常数、绝对温度、频率因子 和活化能之间的关系。活化能和频率因子 也可以通过将阿伦尼乌斯方程 转换成非指数形式 以图形方式确定。利用两边的自然对数,生成一个线性函数的方程。斜率值对应于活化能 对气体常数的负值,y 截距对应于频率因子的 自然对数。这个方程可以用来生成一个称为 阿伦尼乌斯图的图,其中速率常数的 自然对数表示为温度倒数的 函数(开尔文)实验和反应的动力学数据 可以用阿伦尼乌斯图加以说明和分析。在本例中,图形生成一条直线。设定以开尔文为单位给出的斜率值 等于活化能的负值除以 R。在为气体常数赋值 并求解活化能之后,得到了 93.1 千焦耳每摩尔的值。此外,y 截距为 26.8 等于频率因子的自然对数。因此,求解 A 得到的值为 4.36 10¹¹,单位为 1 除以体积摩尔浓度秒—与速率常数相同的单位。在动力学数据有限或 图形表示困难的情况下,可以利用 阿伦尼乌斯方程的两点形式 以非图形方式 计算活化能。在这种情况下,阿伦尼乌斯方程的 非指数形式被修改为 包括两个不同温度下的速率常数。随后对表达式进行减法和重排,得到两点形式的阿伦尼乌斯方程,用于根据两个不同温度下 实验生成的速率常数 计算活化能。通过代入这些值,计算出该反应的 活化能为 145 千焦耳每摩尔。
13.8:
阿伦尼乌斯图
阿伦尼乌斯方程将激活能量和率值常数 k 与化学反应相关。 在阿伦尼乌斯方程中,k = Ae−Ea/RT, R 是理想的气体常数,其值为 8.314 焦耳 / 摩尔 K ,T是开氏刻度的温度,Ea是 J/mole 中的激活能量,e是恒定·2.7183,A是一个称为频率因子的常数,这与碰撞频率和反应分子的方向有关。
阿伦尼乌斯方程可用于计算实验动能数据的反应的激活能量。 一种方便的方法来确定Ea进行反应,即在两个或多个不同温度下测量 k。 它使用方程的修改版本,其形式为线性阿伦尼乌斯方程:
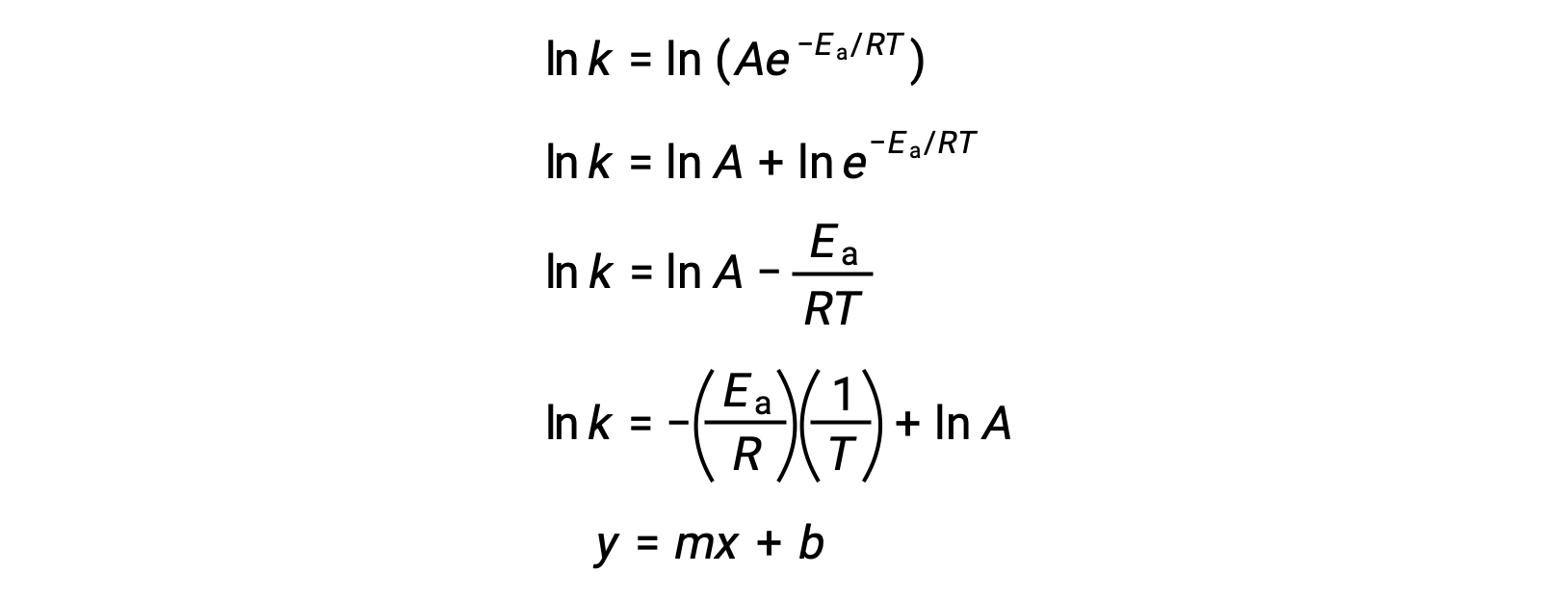
ln k与 1/T 的图解是线性的,斜率等于 −Ea/R ,y 截距等于 ln A
考虑以下反应:
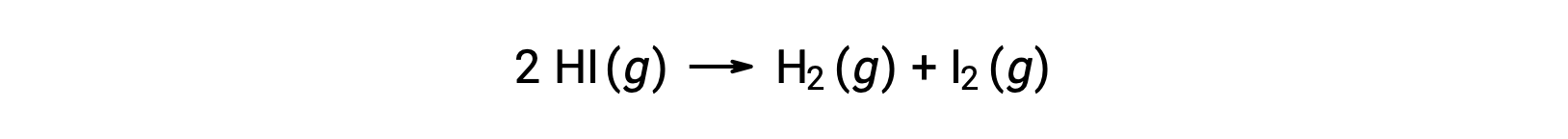
如果通过反应动能数据了解率值常数与温度的变化,则可以确定此反应的激活能量,如图所示。
| 温度 (K) | 率值常数 (L/mol/s) |
| 555 | 3.52 × 10–7 |
| 575 | 1.22 × 10–6 |
| 645 | 8.59 × 10–5 |
| 700 | 1.16 × 10–3 |
| 781 | 3.95 × 10–2 |
所提供的数据可用于导出温度的反向值 (1/T) 和 k (ln k)的自然对数。
| 1/T (K–1) | ln k |
| 1.80 × 10–3 | –14.860 |
| 1.74 × 10–3 | –13.617 |
| 1.55 × 10–3 | –9.362 |
| 1.43 × 10–3 | –6.759 |
| 1.28 × 10–3 | –3.231 |
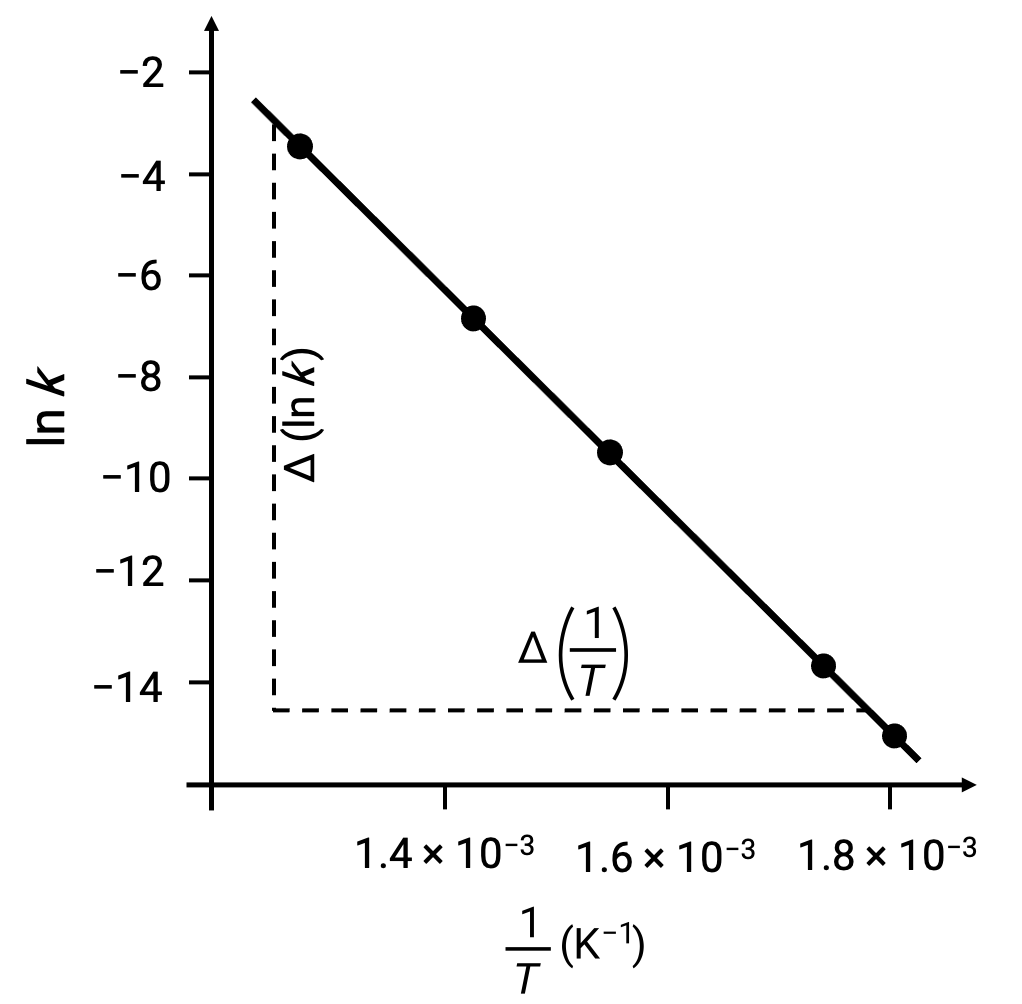
在用 ln k 与1/T 绘制派生数据点时,将生成一个线性关系图,显示 ln k与1/T之间的线性关系,如图所示。
可以使用任意两个实验数据对来估计与激活能量相对应的线路斜率。

派生激活能量的另一种方法是在两个不同的温度下使用率值常数。 通过这种方法,阿伦尼乌斯方程被重新排列为方便的两点形式:
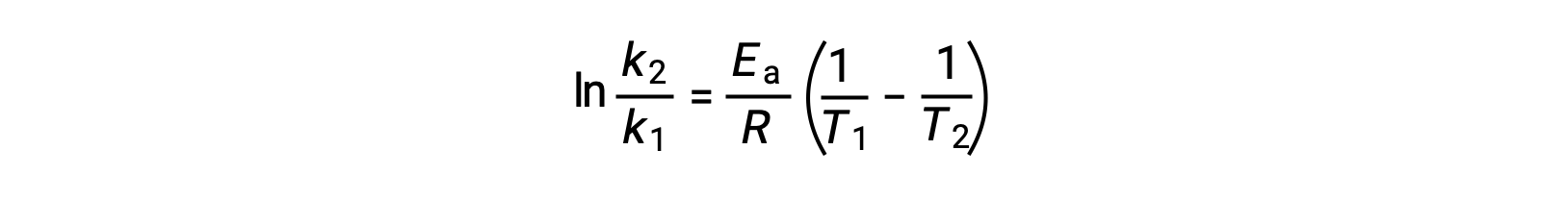
重新排列方程时,将生成激活能量的表达式。
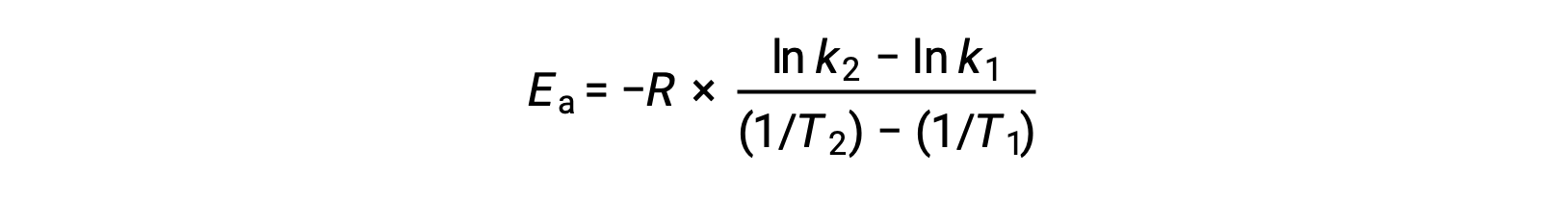
通过替换任何两个数据对并进一步计算生成激活能量的值以焦耳每摩尔或千焦耳每摩尔为单位。
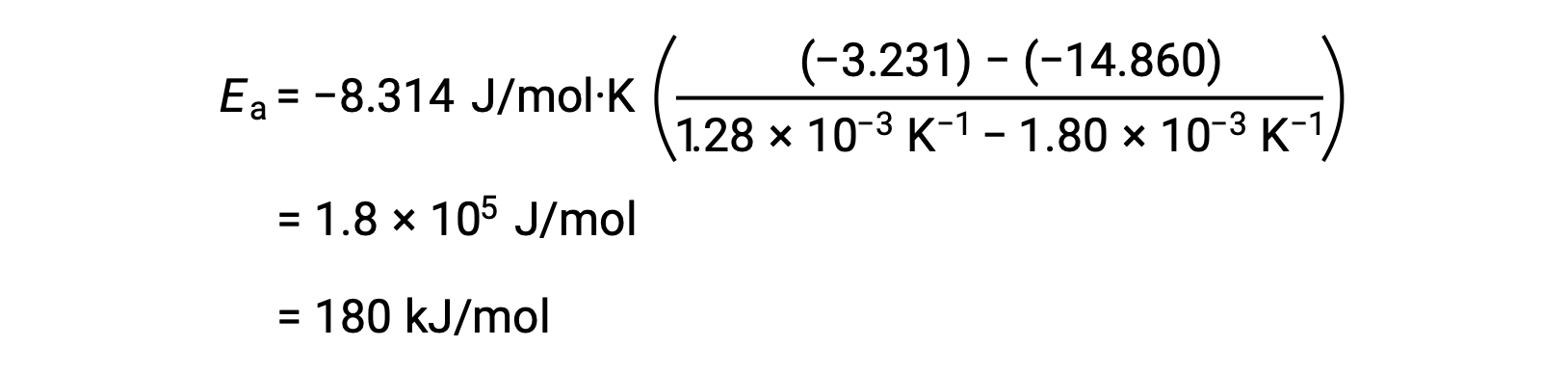
这种备选两点方法生成的结果与图形方法的结果相同。 但是,在实践中,图形方法通常在处理实际实验数据的同时提供更可靠的结果。
本文改编自 Openstax, 化学 2e, 第12.5节:碰撞理论。
Tags
Arrhenius PlotsChemical Reaction RateTemperature DependenceArrhenius EquationRate ConstantAbsolute TemperatureFrequency FactorActivation EnergyNon-exponential FormLinear FunctionSlope ValueY-interceptNatural LogarithmArrhenius PlotInverse Of TemperatureKinetic DataExperimentsReactionsStraight LineGas ConstantKelvinActivation Energy ValueFrequency Factor Value
